Введение
Хантавирусы (род Hantavirus, семейство Bunyaviridae), как и некоторые другие вирусы — возбудители зоонозов, вызывают у природных хозяев — грызунов и насекомоядных бессимптомную хроническую персистентную инфекцию [1]. У людей некоторые типы хантавирусов вызывают такие тяжелые заболевания, как геморрагическая лихорадка с почечным синдромом (ГЛПС) и хантавирусный кардиолегочный синдром (ХКЛС). Отсутствие в настоящее время эффективной специфической противовирусной терапии делает крайне необходимым постоянный поиск новых, специфических и не специфических противовирусных средств, а также профилактических средств, способных помочь организму человека справиться с тяжелой и, в ряде случаев, летальной инфекцией. Ранее, на модели хантавирусной инфекции in vitro показано противовирусное действие биологически-активных молекул сульфатированных полисахаридов из морских гидробионтов [2, 3].
Полиоксидоний (ПО) — это первый в мире химически чистый высокомолекулярный иммуномодулятор, N-оксидированное производное полиэтиленпиперазина, созданный отечественными ученными Петровым Р. В., Хаитовым Р. М., Некрасовым А. В. и др. ПО является уникальной полимерной молекулой с многогранным положительным воздействием на организм человека, которое заключается в следующих эффектах: иммуностимулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем [4]. ПО разрешен к медицинскому применению у детей и взрослых в дозе 0,1 мг/кг в двух лекарственных формах: инъекционной и в виде суппозиториев и входит в реестр ЖНВЛС (распоряжение Правительства РФ от 29 марта 2007 г. № 376-р).
Цель работы состояла в изучении влияния иммуномодулятора Полиоксидоний на гуморальный иммунный ответ у мышей при экспериментальной хантавирусной инфекции.
Материалы и методы
Штамм хантавируса. Для иммунизации лабораторных животных использовали штамм хантавируса Аа 60343 79–95 (ПМ-95) из рабочей коллекции лаборатории хантавирусных инфекций ФГБУ «НИИЭМ имени Г. П. Сомова», обладающий значительной высокой вирулентностью для сосунков белых лабораторных мышей и иммуногенностью [5]. В эксперименте использовали вируссодержащий супернатант, полученный при инфицировании линии клеток Vero E-6 вышеуказанным штаммом хантавируса. Титр вируса для иммунизации составлял не менее 5,0 lg ФОЕ/1,0 мл.
Препарат. В качестве иммуномодулятора выбран коммерческий препарат с торговым названием Полиоксидоний® (ООО «НПО Петровакс Фарм»). Регистрационный номер: Р N002935/02. Международное непатентованное название: Азоксимера бромид. Сополимер N-оксида 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида. Препарат в виде лиофилизата для приготовления раствора для инъекций и местного применения, дозировка 1,0 г (3 мг АФИ). Фармакотерапевтическая группа: иммуномодулирующее средство. Код АТХ: [L0З]
Доза Полиоксидония подбиралась экспериментальным путем, на массу тела, как это проводилось для дозирования препарата у людей (обычная дозировка — 6 мг/среднюю массу тела человека 63 кг). Учитывая, что в возрасте 3–4 недели средняя масса тела белой крысы составляет примерно 80–100 г, средняя доза/крысу составила примерно 8,6 мкг/крысу. Концентрация полиоксидония в исходном растворе составила 3 мг/мл, для иммунизации использовали рабочий раствор полиоксидония — 30 мкг/мл.
Животные. В эксперименте использовали самцов белых лабораторных крыс Wistar в возрасте 3–4 недели, средняя масса 80–100 г (n= 42). Животных содержали в стандартных условиях вивария: в пластиковых клетках с мелкой древесной стружкой, не более 5 особей в клетке, стандартный рацион и питьевой режим в соответствии с нормами, утвержденными приказом Министра здравоохранения СССР от 10 марта 1966 г. № 163 и приказом Минздрава СССР от 10.10.83 № 1179 (пункт 4.1). Все эксперименты проведены в соответствии с «Правилами проведения работ с использованием экспериментальных животных» и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г. Уход за инфицированными животными и работу с ними осуществляли в условиях вивария с уровнем безопасности Р-3 (BSL-3).
Схема иммунизации. Животные были разделены на 2 экспериментальные группы: в I контрольной группе животные получали внутримышечно однократно инъекции вируссодержащей жидкости (0,1 мл, 0,2 мл, 0,3 мл, 0,4 мл, 0,5 мл); во II группе однократно в левую заднюю лапку внутримышечно вводили вируссодержащую жидкость (0,1 мл, 0,2 мл, 0,3 мл, 0,4 мл, 05 мл) и в правую — раствор Полиоксидония в дозе 0,28 мл (8,6 мкг). Для уменьшения болевых ощущений, возникающих у животных при внутримышечном введении препаратов, рабочее разведение полиоксидония готовили на 0,5 % растворе новокаина, учитывая его анестезирующее действие и отсутствие лекарственного взаимодействия с Полиоксидонием. На 35–40 день после заражения животных обескровливали под общим наркозом и исследовали образцы крови на наличие специфических антител.
Непрямой метод флюоресцирующих антител (НМФА). Для выявления титра специфических антител в сыворотках крови экспериментально инфицированных животных использовали НМФА, постановка которого осуществлялась согласно методическим рекомендациям [6].
Определение авидности антител проводили согласно прописанной методике K. Hedman с соавторами (1991) [7].
Реакция нейтрализации (РН) проводилась для обнаружения антихантавирусных нейтрализующих антител. Реакция основана на методе выявления фокусобразующих единиц (ФОЕ) в культуре клеток под полужидким покрытием (0,6 % карбоксиметилцеллюлозы) [8].
В тексте показатели титра антител представлены в обратных величинах (т. е. при получении титра антител 1:128, расчет проводился исходя из величины 128).
Все полученные данные статистически обрабатывались при помощи программы «BIOSTAT».
Результаты и обсуждения
В первой (контрольной) группе животные получали только инъекции вируссодержащей жидкости (0,1 мл, 0,2 мл, 0,3 мл, 0,4 мл, 0,5 мл). Первичную оценку зависимости величины титра антител от введенной дозы вируса проводили в НМФА. Показано, что у отдельных животных в первой и четвертой группах выявлены максимальные значения титра антител — 256, минимальный титр 32 выявлен у животных во второй группе. Средний титр антител у животных первой группы составил — 176, во второй — 74,67, в третьей — 80, в четвертой — 149,3 и в пятой — 96. Таким образом, при первичном анализе средних показателей не выявлено линейной прямо пропорциональной зависимости величины титра антител от введенной дозы вируса. Однако анализ тенденции показал линейную зависимость средней величины титра антител в НМФА от дозы вируса. То есть, максимальная доза вируса приводила к большей стимуляции процесс антителообразования.
Для того, чтобы доказать иммуностимулирующие характеристики полиоксидония во второй (экспериментальной) группе мышам вводили вирус (в тех же дозах, что и в первой группе) и иммуномодулятор Полиоксидоний. В НМФА у первой группы животных средний титр АТ составил 1024, во второй группе — 819,2, в третьей группе — 614,4, в четвертой и пятой группах средний титр составил — 409,6.
Сравнение результатов средних титров в НМФА в контрольной и экспериментальной группах показало значимую разницу в средних титрах: при введении полиоксидония, средние титры были выше в 5,8 раза, 10,97 раза, 7,7 раз, 2,7 раза и 4,2 раза в группах с 1 по 5 соответственно. Во второй группе также прослеживалась линейная зависимость средней величины титра антител от введенной дозы вируса, что подтверждено анализом тенденции. Следует отметить, что интенсивность иммунного ответа была выше в группах животных, получивших более высокие дозы вируса.
Полученные результаты свидетельствовали о том, что введение полиоксидония статистически достоверно стимулировало антителообразование при всех дозах вируса (рис.1).
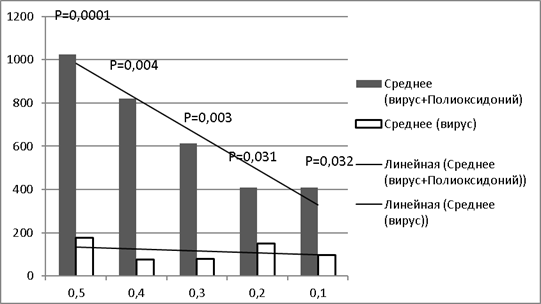
Рис. 1. Зависимость среднего титра антител от дозы хантавируса (без введения полиоксидония и при одновременном введении вируса и полиоксидония) в двух группах. Примечание: по оси ординат — обратные значения титра антител в сыворотке крови животных НМФА; по оси абсцисс — доза вируссодержащей жидкости (мл), использованная для иммунизации животных; р — доверительная вероятность (по коэффициенту Стьюдента)
Во всех исследованный сыворотках крови экспериментальных животных выявлены антитела высокой авидности, что дополнительно свидетельствует о эффективности противовирусного иммунитета.
Специфичность иммунного ответа изучали при анализе нейтрализующих антител (нАТ) (реакция нейтрализации). В контрольной группе максимальный титр нАТ выявлен у животных в 1 группе — 384 (доза вируса — 0,5 мл), минимальный титр в 4 и 5 группах (доза вируса 0,2 мл и 0,1 мл соответственно). Средний титр составил — 208, 122,7, 108, 160 и 176 в 1,2,3, 4 и 5 группах соответственно. Как и в НМФА, при первичном анализе результатов реакции нейтрализации четкая линейная прямо пропорциональная зависимость величины титра антител от введенной дозы вируса не прослеживалась. Но анализ тенденции показал линейную зависимость средней величины титра антител в РН от дозы вируса, вводимой лабораторным животным.
Таким образом, результаты изучения иммуногенности штамма ПМ-95 свидетельствуют, что даже минимальная исследованная доза вируса приводила к значительной стимуляции полноценного нейтрализующего вирус иммунного ответа.
Сравнение результатов средних титров в РН в экспериментальной группе животных, получавших Полиоксидоний, с контрольной группой показало значимую разницу в средних титрах при введении полиоксидония, средние титры были выше в 5,8 раза, 10,97 раза, 7,7 раз, 2,7 раза и 4,2 раза в группах с 1 по 5 соответственно.
Как и в НМФА отмечена явная зависимость увеличения антителообразования при повышении дозы вируса. При сравнении между группами, получавшими одинаковую дозу вируса вместе с препаратом или без него, отмечено, что титр антител после введение Полиоксидония был статистически достоверно выше (рис.2).
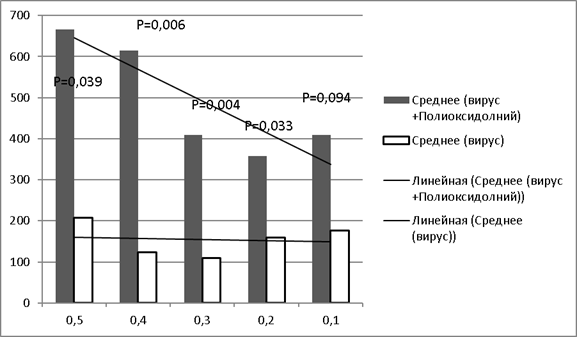
Рис. 2. Зависимость среднего титра антител от дозы вируса (без введения полиоксидония и при одновременном введении вируса и полиоксидония) в двух группах. Примечание: по оси ординат — обратные значения титра антител в сыворотке крови животных РН; по оси абсцисс — доза вируссодержащей жидкости (мл), использованная для иммунизации животных; р — доверительная вероятность (по коэффициенту Стьюдента)
Выводы
1. Установлено, что применение препарата Полиоксидоний приводит к стимуляции выработки специфических антител в крови экспериментальных животных при введении разных доз хантавируса.
2. Показано, что стимулирующее действие препарата Полиоксидоний проявляется в значительном увеличении выработки специфических антител в крови экспериментальных животных даже при наименьшей антигенной нагрузке.
3. Использование препарата Полиоксидоний вызывает формирование антител, обладающих вируснейтрализующей активностью в крови экспериментальных животных.
4. Титр специфических антител при введении Полиоксидония был статистически достоверно выше, чем титр антител при введении любых исследованных доз хантавируса.
Литература:
1. Schmaljohn C., Hjelle B. Hantaviruses: a global disease problem // Emerging Infectious Diseases. — 1997. — Vol. 3, № 2. — P. 95–104.
2. Макаренкова И. Д., Компанец Г. Г., Беседнова Н. Н., Слонова Р. А. Скрининг биополимеров из морских гидробионтов, влияющих на адсорбцию вируса Хантаан // Вопр. вирусол. — 2007. — № 2. — С. 29–32.
3. Максема И. Г., Компанец Г. Г., Барабанова А. О., Ермак И. М., Слонова Р. А.. Противовирусное действие каррагинанов из красной водоросли при экспериментальной хантавирусной инфекции // Тихоок. мед.журн., 2012, № 1. С. 32–34.
4. Хаитов Р. В., Пинегин Б. В. Иммуномодуляторы и некоторые аспекты их клинического применения // Клиническая медицина. — 1996. — № 8. — С. 7–12.
5. Компанец Г. Г. Биологические свойства хантавирусов, циркулирующих в Приморском крае // Тихоокеанский медицинский журнал. — 2008. — № 2. — С. 61–64.
6. Методы лабораторной диагностики геморрагической лихорадки с почечным синдромом. — М., 1982.
7. Hedman K., Vaheri A., Brummer-Korvenkontio M. Rapid diagnosis of hantavirus disease with an IgG-avidity assay // The Lancet. — 1991. — Vol. 338, № 8779. — P.1353–1356.
8. Дзагурова Т. К., Ткаченко Е. А., Башкирцев В. Н., Окулова Н. М., Апекина Н. С. и др. Выделение и идентификация штаммов хантавирусов-возбудителей ГЛПС в европейской части России // Медицинская вирусология. — 2008. — Т. XXV. — С. 142–50.

