Анализ российского рынка садовых, декоративных культур свидетельствует: в последние годы интерес на новые сорта данных культур существенно вырос. В ходе процесса перехода экономики страны к импортозамещению очевидна необходимость сокращения импорта посадочного материала, становится актуальной проблема массового производства различных сортов однолетних и многолетних цветочных культур внутри России. Отстраняться от неё нельзя: наличие высокого инфекционного фона у завезённого посадочного материала сказывается не только на качестве цветения, внешнем виде и продолжительности жизни растений, но и вызывает заражение окружающей среды опасными патогенами, что оказывает отрицательное влияние на экологию регионов. Проблема может быть успешно решена с использованием при размножении ценных сортов методов биотехнологии [1].
В промышленном производстве цветочных культур во всем мире в настоящее время наиболее перспективным методом размножения растений считается метод in vitro.
Этот метод имеет существенные преимущества перед традиционными способами размножения растений:
получение генетически однородного посадочного материала;
получение безвирусных растений за счет использования меристемной культуры;
высокий коэффициент размножения;
возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
пробирочные растения легко транспортировать на любые расстояния.
Использование технологий микроклонального размножения позволяет сократить время выращивания до товарного стандарта, к примеру, для декоративно-лиственных бегоний и сенполий на 1–1,5 мес., для хризантем, лилий, гвоздик и орхидей — на 3–4 месяца. Размножая какой-либо новейший сорт, можно вырастить несколько миллионов растений за один год, и, дорастив их в течение 2–3 лет, получить качественный посадочный материал. При обычных методах размножения для этого понадобилось бы более 10 лет [2].
В мировом масштабе большая часть декоративно-цветочного ассортимента массового производства выпускается с применением технологий микроклонального размножения.
Микроразмножение растений, начавшее распространяться в 60-е годы 20 века, оформилось как мощное промышленное производство, быстро реагирующее на запросы рынка. К примеру, только за период с 1985 по 1990 годы число растений, размножаемых in vitro, возросло с 130 млн. до 513 млн. Мировыми лидерами в этой области являются Нидерланды, США, Индия, Израиль, Италия, Польша и другие страны. В США микроразмножением занимаются около 100 лабораторий, 5 из которых имеют производительность 15–20 млн. растений в год, 8–10 лабораторий — от 2–10 млн., остальные менее 1 млн. растений. Из 248 коммерческих лабораторий Западной Европы с общей годовой производительностью 212 миллионов растений только 37 производят более 1 млн.
Лидером микроразмножения растений в Западной Европе являются Нидерланды (около 70 лабораторий занимается микроразмножением). Это связано с традиционнной ориентацией на производство декоративных культур, где Нидерланды доминируют на мировом рынке (около половины мирового экспорта цветов на срезку и декоративных растений экспортируется из этой страны). Наиболее важными группами растений, размножаемых in vitro в этой стране, являются такие декоративные культуры, как горшечные растения на срезку, орхидеи и луковичные.
В России накоплен большой опыт по микроклональному размножению наиболее востребованных культур; практически во всех научно-исследовательских институтах, селекционных центрах созданы лаборатории биотехнологии, одна из главных задач которых оздоровление и микроклональное размножение ценного селекционного материала и перспективных сортов.
Сейчас технологии клонального микроразмножения invitro на лабораторном уровне разработаны в мире более чем для 2400 видов растений. Однако коммерческих лабораторий, использующих эти приёмы, относительно немного, около 200. Это объясняется отчасти тем, что не все, разработанные в сугубо лабораторных условиях методики, применимы непосредственно в производстве. Часто требуется решение отдельных узловых моментов для конкретных видов растений. Немаловажным является и вопрос экономической эффективности [3].
Среди цветочных культур большой популярностью и спросом несомненно пользуется хризантема. Хризантема сегодня входит в список наиболее популярных цветочных культур, которые распространены по всему миру. Для потребителя предлагаются как срезочные, так и горшечные, садовые и тепличные растения. По объему продаж хризантемы уступают только розам. Более чем за 2000-летнию историю культуры создано около 7000 сортов хризантем, часть из которых используют в кулинарии, в фармацевтической промышленности, а также в качестве инсектицидов. Однако наибольшую популярность хризантема снискала в цветоводстве [4].
В тоже время на территории Российской Федерации объемы производства посадочного материала современных сортов недостаточны, а имеющийся материал дорогостоящий. В связи с этим разработка современной технологии увеличения объёмов производства, равно как, и удешевления посадочного материала весьма актуальны.
В лаборатории биотехнологии сельскохозяйственных растений Самарского НИИСХ мы провели оптимизацию основных элементов технологии микроклонального размножения хризантемы корейской в условиях invitro. В качестве объекта исследования были использованы микрорастения хризантемы корейской сорта Улыбка Гагарина.
В нашем эксперименте мы использовали классическую схему микрокланального размножения основанную на активации развития уже существующих в растении меристем (апекс стебля, пазушные и спящие почки и интеркалярные зоны стебля) и индукции возникновения адвентивных почек непосредственно тканями экспланта. Рисунок 1.
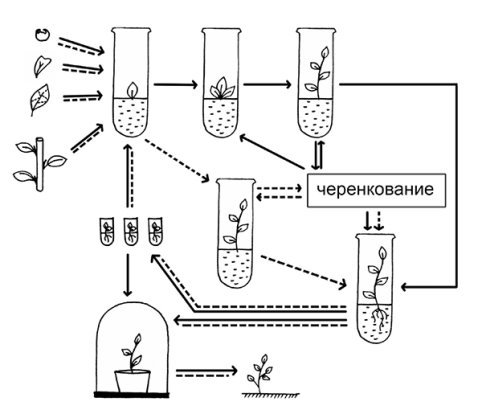
Рис. 1. Схема микроклонального размножения растений
В качестве питательной среды в эксперименте использовалась минеральная основа среды Мурасиге и Скуга с добавлением природного биологического загустителя Агар-Агара в количестве 6 г/л, а также различных концентраций фитогормонов, витаминов и органических добавок. Таблица 1.
Таблица 1
Минеральная основа среды Мурасиге и Скуга
|
Компоненты |
Содержание, мг/л |
Компоненты |
Содержание, мг/л |
|
NH4NO3 |
1650 |
Fe2SO4 7H2O |
27,8 |
|
KNO3 |
1900 |
Na2-ЭДТА 2H2O |
37,3 |
|
CaCl2. 2H2O |
440 |
Тиамин — HCl |
0,1 |
|
MgSO4. 4H2O |
370 |
Пиридоксин — HCl |
0,5 |
|
KH2PO4 |
170 |
Никотиновая кислота |
0,5 |
|
MnSO4. 4H2O |
22,3 |
Мезо-инозит |
100 |
|
CoCl2.6H2O |
0,025 |
Сахароза |
30.000 |
|
ZnSO4. 7H2O |
8,6 |
рН 5,6–5,8 | |
|
CuSO4. 5H2O |
0,025 | ||
|
Na2MoO4. 2H2O |
0,25 | ||
|
Kl |
0,83 | ||
Традиционно процесс клонального микроразмножения включает в себя четыре основныхэтапа:
выбор растения-донора и получение хорошо растущей стерильной культуры;
собственно микроразмножение;
укоренение микропобегов и при необходимости их депонирование при пониженных температурах;
адаптацию пробирочных растений к почвенным условиям теплицы или открытого грунта.
В наших экспериментах в качестве эксплантов были взяты растительные побеги хризантемы длиной 2,5–3 см.
Важным этапом введение в культуру invitro является получение хорошо растущей стерильной культуры или ростков. От правильно выбранных для стерилизации растительных объектов химических реагентов зависит эффективность разработанной технологии микроклонального размножения и общий успех производства. В результате проведенных исследований было установлено, что наиболее эффективной схемой стерилизации при введении хризантемы в условия invitro является двухэтапная схема стерилизации. Первый этап стерилизация растительных эксплантов в растворе пероксида водорода (12 %) в течении 5 мин. Далее трижды промывают стерильной дистиллированной водой. Второй этап с использованием препаратов «Белизна» или «Domestos» в разведении 1:9, в течении 10 мин. Завершающим этапом стерилизации, тройная промывка растительных объектов стерильной дистиллированной водой. При данном способе стерилизации жизнеспособность эксплантов составляла более 70 %.
После выполнения этапа стерилизации у растительных эксплантов скальпелем подрезается нижняя часть стебля и далее подготовленные черенки высаживают на питательную среду Мурасиге и Скуга, дополненную сахарозой 30 г/л и регуляторами роста 1,0 мг/л кинетина и 0,5 мг/л нафтилуксусной кислоты. Дальнейшее культивирование микро растений осуществляется в факторостатной комнате при 16-часовом освещении люминесцентными фитолампами с интенсивностью около 3000 лк, при температуре 20–25°C (физические условия выращивания близки к оптимальным для культивирования эксплантов растений).
В процессе культивирования на стерильных эксплантах формируются боковые побеги, которые в последующем отделяют от маточного растения и помещают на свежую питательную среду для роста и укоренения, или используют для дальнейшего черенкования. В первом случае используют питательную среду с 50 %-ным составом макросолей с добавлением стимулятора ростовых процессов Рибав-Экстра (0,00152 г/л L-аланин + 0,00196 г/л L-глутаминновой кислоты) в количестве 0,1 мг/л. Во втором случае используется прежний состав питательной среды.
При укоренении микропобегов на агаризованной питательной среде Мурасиге-Скуга с добавлением Рибав-Экстра в течение 2 недель культивирования формируются побеги максимальной длины — 5–6 см. и 3–4 корешками длинной 1,5–2 см. В дальнейшем сформировавшиеся побеги с корнями переносят для адаптации к естественным условиям открытого грунта. Микро-растения пересаживаются в кассеты с питательным субстратом состоящим из смеси нейтрализованного торфа и перлита (вермикулит) в соотношении 1:1. Для более эффективной приживаемости микроклонов в помещении для адаптации необходимо использовать систему туманообразования фирмы «СОХРА». Данная система поддерживает в оптимальном режиме влажность воздуха и тем самым не дает листовой поверхности интенсивно терять влагу. После укоренения размноженные растения выращивают обычным способом.
Литература:
- Шевченко, С. Н. Самарская наука: ответ на зарубежные санкции // Шевченко С. Н., Милехин А. В., Рубцов С. Л. / Агроинформ, № 3 (197) // март 2015, с. 36–37.
- Бутенко Р. Г. Биология клеток высших растений in vitro и биотехнологии на их основе: Учеб. пособие — М.: ФБК-ПРЕСС, 1999.
- СассонА.Биотехнология:свершенияи надежды: Пер. с англ. / Под ред., с предисл. и допл. В. Г. Дебабова. — М.: Мир1987. — 411с.
- Гранда Харамильо Роберто Карлос. Идентификация В вируса хризантем и создание коллекций invitro оздоровленного посадочного материала. — автореферат дис…к.б.н. /МСХА имени К. А. Тимирязева. — Москва, 2009. — 19 с.

