Показана возможность применения серосодержащих реагентов в качестве аналитических реагентов на благородные металлы и оптимизированы условия титрования на различных по кислотно-основным свойствам фоновых электролитах и буферных смесях.
В связи с этим, в аналитических целях, также была оценена возможность и выявлены особенности использования серосодержащих реагентов в качестве подходящего титранта на ионы различных металлов в водной, смешанной и неводной средах.
Ключевые слова: тиолы, тиоамид, тиомочевина, таутомер, селективность, воспроизводимость, титрант, реагент, избирательность, экспрессность.
Введение. Синтез новых органических и неорганических соединений и изучение их электрохимических, физико-химических и других свойств, а также биологической активности были и остаются одной из наиболее актуальных задач современной науки, медицины, промышленности, техники и народного хозяйства.
В настоящее время значительный интерес с аналитической точки зрения представляют органические реагенты, содержащие тиольную (R-SH), тионную 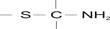 и другие группы, образующие внутрикомплексные соединения с ионами благородных металлов: золота, платины, меди, кобальта, никеля и других элементов и кроме того взаимодействующие с котионами аналогично сероводороду. Не маловажное место в этом плане также занимают реагенты, полученные на основе ацетилена и его производных, обладающих значительными донорно-акцепторными свойствами, необходимыми в электроаналитике.
и другие группы, образующие внутрикомплексные соединения с ионами благородных металлов: золота, платины, меди, кобальта, никеля и других элементов и кроме того взаимодействующие с котионами аналогично сероводороду. Не маловажное место в этом плане также занимают реагенты, полученные на основе ацетилена и его производных, обладающих значительными донорно-акцепторными свойствами, необходимыми в электроаналитике.
Методы титрования с применением подобного рода реагентов [1], объединенные в особую группу методов анализа — тиолометрическую, отличаются более высокой селективностью определения по сравнению с комплоксономотрическими, так как серосодержащие реагенты взаимодействуют с гораздо меньшим числом ионов металлов, чем ЭДТА и ее аналоги. С другой стороны, их особенностью является способность реагировать с отдельными группами элементов в определенном интервале рН, при котором другие комплексующие реактивы не дают положительного эффекта. Высокая чувствительность их реакций позволяет определять малые количества различных металлов с достаточно высокой степенью точности, причем в некоторых случаях возможно избирательное определение одного элемента в присутствии других без их предварительного разделения.
Кузнецов В. И. отмечает идентичность действия реагентов типа R-SН и сероводорода при определении благородных и тяжелых металлов. Как известно, серосодержащие органические соединения специфичны к комплексообразованию с ионами различных металлов, в особенности благородных элементов.
Тиоамиды (R-CS-NH2) легко синтезируются и успешно применяются в весовых, объёмных и колориметрических методах анализа. В основном, как заменители сероводорода они применяются в виде трех соединений:
- тиомочевина (NH2-CS-NH2);
- тиокарбаминат аммония (NH4О-CS-NH2);
- тиоацетамид — (СН3-CS-NH2).
Механизм действия тиоамидов основан на процессах их гидролиза с последующим образованием сероводорода:
NH2-CS-NH2 + 2H2O = 2NH3 + CO2 + H2S;
NH4О-CS-NH2 + H2O = 2NH3 + CO2 + H2S;
СН3-CS-NH2+ 2H2O = СН3-COO-NH4 + H2S.
Существенное преимущество тиоамидов заключается в том, что образование сероводорода происходит в растворе, благодаря чему, изменяя количество осадителя можно просто и легко регулировать скорость реакции и полноту выделения сульфидов.
Примером аналитического реагента с группой 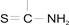 служит рубеановодородная кислота (РК), молекулы которой в виде двух таутомерных форм находятся в следующем равновесии:
служит рубеановодородная кислота (РК), молекулы которой в виде двух таутомерных форм находятся в следующем равновесии:
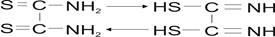
При этом диамидная форма ведет себя как слабая кислота:
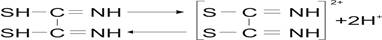
Как видно из равновесия, соотношение в растворе разных форм сильно зависит от кислотности и основности среды.
Соединения РК с ионами металлов получили названия рубеанатов и представляют собой весьма прочные комплексы, состоящие из двух пятичленных колец, обшей структурной формулой:
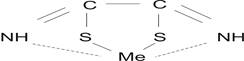
Весьма высокая чувствительность реакций РК с некоторыми катионами была нами использована для разработки методик амперометрического титрования Cu(II), Pd(II), Ni(II) и ионов других металлов в водных, смешанных и неводных средах.
Применение дитизона (ДТЗ) в количественном анализе особенно рекомендуется в тех случаях, когда требуется определить микроколичества металлов. Большая молекулярная масса этого реагента, сравнительно малая растворимость в воде и весьма хорошая — в органических растворителях позволяет разнообразить и расширить возможности анализа с использованием этого реагента, а в отдельных случаях предпочесть даже дитизоновый метод.
ДТЗ в водных растворах ведет себя как одноосновная кислота и участвует в реакциях в виде таутомерных равновесных форм (тион-тиольных):
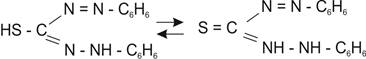
Отсюда можно заключить, что ионы металлов могут образовывать с этим реагентом два типа дитизонатов. Наиболее обычной является «первичная» форма, получающаяся в кислых средах и при этом в комплексообразовании участвует тиолат-ион.
На основании литературных данных, а также стехиометрии образования комплексов этого реагента с ионами различных металлов было установлено, что ДТЗ ведет себя как двухосновная кислота. Переход кислых солей в средние при подщелачивании или, наоборот, средних в кислые при подкислении среды происходит по уравнениям:
Me(HDZ)2 → MeDZ+ H2DZ
Благодаря наличию в молекуле ДТЗ амино- и сульфамидных групп он образует типичные внутрикомплексные соли почти со всеми металлами, способными комплексоваться с этими группами.
С аналитической точки зрения первичные дитизоны из-за их весьма высокой прочности имеют гораздо большее значение, чем вторичные (менее растворимые в органических растворителях). С другой стороны первичные дитизонаты образуются только в кислых растворах, содержащих в избытке лиганд, а вторичные — при избытке ионов металлов.
Для титриметрического определения ионов различных металлов в амперометрическом варианте в неводных, смешанных и водно-органических средах серосодержащие реагенты до сих пор не нашли широкого применения, несмотря на достаточно высокую прочность и постоянство состава многих их комплексов с благородными и тяжелыми металлами.
Аналитические возможности [2] серосодержащих реагентов достаточно успешно могут быть улучшены путем перехода от водных растворов к неводным, так как в неводных протолитических средах (особенно протофильных) исключается гидролиз, являющийся одним из основных факторов, препятствующих использованию максимальных возможностей органических реагентов в аналитической практике.
Еще один из представителей серосодержащих реагентов это амид изотиоугольной кислоты 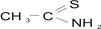 - тиоацетамид, кратко ТАА, белое кристаллическос вещество, хорошо растворимое в воде, спиртах, ацетонитриле, уксусной кислоте, тетрогидрофуране (ТГФ) и сравнительно малорастворимое в бензоле, эфире и кетонах.
- тиоацетамид, кратко ТАА, белое кристаллическос вещество, хорошо растворимое в воде, спиртах, ацетонитриле, уксусной кислоте, тетрогидрофуране (ТГФ) и сравнительно малорастворимое в бензоле, эфире и кетонах.
Почти все известные в настоящее время методы количественного определения различных металлов с применением ТАА основаны на предварительном их осаждении в виде соответствующих сульфидов с последующим гравиметрическим, титриметрическим, полярографическим, фотометрическим, спектральным и радиометрическим методами обнаружений. При титриметрическом же завершении анализа, как правило, осадок сульфида металла растворяют в полученном растворе с последующим оттитровыванием определяемого катиона раствором ЭДТА или другого подходящего реагента.
Методы же прямого титрования каких-либо катионов стандартным раствором ТАА в водных средах предлагались эпизодически и весьма редко. Такое положение объясняется тем, что взаимодействие его с катионами, приводящее к образованию сульфида соответствующего металла, протекает слишком медленно, особенно, в кислом растворе, вследствие малой скорости гидролиза ТАА.
При взаимодействии ТАА с катионами различных металлов, постоянно осаждаются в виде сульфидов за счет образующегося при гидролизе сероводорода, образуя достаточно прочные и хорошо растворимые в воде комплексы составов: [Ме(TAA)]n+, [Ме(TAA)2]n+, [Ме(TAA)3]n+ и [Ме(TAA)4]n+. Образующийся при гидролизе H2S или S2- можно использовать для осаждения ряда катионов, образующих мало растворимые сульфиды.
Такой метод осаждения, как известно, приводит к образованию гораздо более чистых и менее дисперсных осадков сульфидов металлов, по сравнению с таковыми, получаемыми действием сероводорода или сульфида аммония.
Эта особенность ТАА до сих пор никем не использовалась для разработки прямых методов титрования катионов, потому что в водном растворе реакция образования тиоацетамидатного комплекса, как правило, всегда сопровождается побочной реакцией образования сульфидов металлов.
Можно однако, предположить, что если полностью исключить или хотя бы сильно замедлить процесс гидролиза ТАА путем замены воды подходящим органическим растворителем или смесью растворителей, то прямое титрование катионов раствором этого реагента на основе реакции комплексообразования станет вполне возможным.
В протолитических и инертных растворах ТАА находится в двух таутомерных формах:
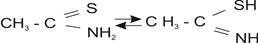
Для титриметрического определения ионов различных металлов в амперометрическом варианте в неводных и смешанных средах ТАА до сих пор не нашел применения, несмотря на достаточно высокую прочность и постоянство состава многих его комплексов с благородными и некоторыми тяжелыми металлами. Хотя уже было отмечено ранее, что аналитические возможности ТАА успешно могут быть расширены и улучшены при переходе от водных растворов к неводным и смешанным средам, из-за исключения процесса гидролиза, являющегося одним из факторов, препятствующих использованию максимальных возможностей органических хелатообразующих тиолов в аналитической практике. В связи с этим в аналитических целях также необходимо было оценить возможности и выявить особенности использования ТАА в качестве подходящего титранта на ноны различных металлов в неводной амперометрии [3].
Результаты и их обсуждение: Для решения поставленной задачи и достижения намеченной цели были проведены предварительные опыты по амперометрическому титрованию ионов металлов растворами серосодержащих реагентов и ММГО в слелдуюших протолитических средах: уксусной кислоте, н-пропоноле, ДМФА и ДМСО. Титрование ионов металлов осуществляли с учетом специфических условий образования комплексов металлов и их стехиометрии с этими реагентами.
Как известно, серосодержащие соединения специфичны к ионам различных металлов, поэтому важно получение новых органических комплексообразующих веществ на основе доступных, импортзамещяющих и дешевых компонентов, обладающих рядом ценных аналитических свойств, с целью их использования в качестве подходящих и селективных реагентов на ионы различных металлов, в особенности благородных элементов.
Применение платиновых индикаторных электродов позволяет использовать возникающий анодный ток окисления титранта для индикации конечной точки титрования, что значительно расширяет число катионов, титруемых амперометрическим способом.
Нами было установлено, используемые нами сероcодержащие реагенты в любой из вышеприведенных сред на платиновом дисковом аноде легко окисляются и при этом обнаруживают появление соответствующего анодного тока, благодаря чему эти реагенты с аналитической точки зрения весьма интересны и ценны как подходящие и специфичные титранты для амперометрического титрования различных катионов в водных, неводных и смешанных средах.
Учитывая все преимущества и достоинства меди, палладия, платины, золота, серебра и их соединений, а также важность этих металлов в народном хозяйстве возникла необходимость установления их макро-, микро- и следовых концентраций в природных объектах и промышленных материалах, поскольку их микроколичества порою играют важную и определяющую роль в решении различных аналитических, медицинских, социальных, экологических, технических, народнохозяйственных и других задач.
Как известно, амперометрическое титрование представляет собой объемный метод анализа, в котором для индикации конечной точки титрования используется диффузионный ток, наблюдаемый на ртутно — капающем, вращающемся платиновом или другом твердом электроде. Благодаря экспрессности выполнения анализа, дешевизне, доступности и простоте аппаратурного оформления разработанные методики титрования вполне могут быть использованы для определения благородных металлов в различных по природе объектах окружающей среды, производственных и промышленных материалах в стационарных и полевых условиях.
Поэтому, определение этих металлов в различных по природе объектах окружающей среды; стоматологии, изделиях радио- и электронной техники, минералах, рудах и производственных отходах является необходимой и актуальной задачей современной электроаналитической химии, медицины и экологии. Важное место в этом аспекте занимает амперометрия, отличающаяся высокими точностью, экспрессностью и нижними границами определяемых содержаний компонентов, основанная на законах полярографии и вольтамперометрии, где конечную точку титрования устанавливают по зависимости предельного анодного и катодного токов от объёма (концентрации) прибавленного титранта (в данном случае тиоацетамида) при постоянной разности потенциалов (ΔЕ) на твердом индикаторном — рабочем электроде.
Нами установлены возможности и подбор оптимальных условий амперометрического титрования палладия, платины и золота раствором тиоацетамида с двумя платиновыми индикаторными электродами в водных, смешанных, неводных средах и экстрактах по току анодного окисления реагента и катодного восстановления ионов титруемых металлов, а также улучшение метрологических характеристик (воспроизводимость, правильность, расширение диапазона определяемых содержаний, чувствительность, селективность и другие аналитические параметры), увеличение областей использования амперометрического титрования благородных металлов в индивидуальных растворах и их модельных бинарных, тройных и более сложных смесях с целью последующего его применения для контроля составов природных объектов, промышленных материалов, материалов стоматологии, стандартные образцы сталей, сплавы, концентраты, хвосты промышленных предприятий и другие изделия зубопротезной, радио- и электронной промышленности.
Априори, гипотетически не проводя экспериментов на основе выполненных исследований вполне реально можно предсказать возможность амперометрического титрования других благородных металлов с помощью тиоацетамида и других серосодержащих реагентов аналогичного класса (тионалид, диэтилдитиокарбаминаты натрия и свинца, рубеановодородная кислота, дитизон и другие) на использованных при выполнении исследования фоновых электролитах и буферных смесях.
В тоже время немаловажно установление вероятности электрохимического окисления других неисследованных серосодержащих органических деполяризаторов на платиновом дисковом микроаноде с целью их использования для выполнения амперометрических исследований, поскольку как нами было установлено, все они окисляются по одному и тому же механизму электрохимической схемы, являющейся основой проведения амперометрических определений.
Проведено вольтамперометрическое исследование электроокисления тиоацетамида и его металлокомплексов с палладием, платиной и золотом на вращающемся платиновом микродисковом аноде на различных по кислотно-основным свойствам фоновых электролитах и буферных смесях с идентификацией природы регистрируемых анодных и катодных токов с установлением числа электронов, участвующих при электроокислении одной молекулы деполяризатора, для установления возможности последующего его использования в качестве специфичного аналитического титранта на исследованные благородные металлы.
Для оптимизации условий амперометрического титрования палладия, платины и золота раствором тиоацетамида изучено влияние напряжения, подаваемого на индикаторные электроды, природы и концентрации фоновых электролитов и буферных смесей, инертных растворителей, посторонних сопутствующих катионов, мешающих анионов и комплексующих соединений, а также других факторов на условия, форму кривых и результаты титрования. Показано, что во всех случаях образуется комплекс состава Металл: Реагент=1:2 для палладия и платины, 1:3-золота; при этом различными химическими и электрохимическими методами установлено предполагаемое строение полученных комплексов и соотношение в них компонентов, что полностью соответствует теоретическим данным.
Оптимизированы условия титрования палладия, платины и золота раствором тиоацетамида в их индивидуальных растворах, бинарных, тройных и более сложных сочетаниях, что в значительной степени способствовало упрощению и ускорению анализа ряда реальных объектов и промышленных материалов с улучшенными метрологическими характеристиками и аналитическими параметрами. Стандартные и рабочие растворы ТАА, палладия(II), платины (IV), золота(III) и других металлов меньших концентраций (0,0002–0,001 М) готовили непосредственно перед титрованием разбавлением их исходных крепких растворов водой или неводным растворителем, но поскольку все применяемые неводные растворители, а, следовательно и приготовленные на них стандартные растворы ионов металлов, титранта и других веществ характеризуются относительно высоким коэффициентом теплового расширения, то во избежание ошибок, связанных с непостоянством комнатной температуры, в установленные при определенной температуре значения молярных концентраций вводилась температурная поправка по уравнению: M = Mo (I-aDt),
где М–молярная концентрация раствора при температуре t оС;
Мо–установленная молярная концентрация при температуре t1 оС;
a–коэффициент теплового расширения данного растворителя;
Dt–разность между температурами во время титрования и при стандартизации раствора титранта.
Заключение: Разработанные амперометрические методики позволили практически реализовать определение меди, палладия, платины, серебра, никеля и золота в неорганических материалах (руды, сплавы, шламы, хвосты, ювелирные изделия, стандартные образцы и другие) с нижней границей определяемых содержаний (Сн) 5 мкг например: для Pd, 8- Pt и 11 –Au в 10 мл анализируемого раствора, характеризующиеся высокой точностью, селективностью и экспрессностью выполнения анализа.
Таким образом, поиск и разработка новых современных электрохимических, в особенности амперометрических методик определения благородных элементов в объектах окружающей среды является одной из важных, актуальных и необходимых проблем электрохимии, экологии, аналитической и физической химии, медицины, имеющее в жизни людей (населения) как народнохозяйственную важность, необходимость и актуальность, так и социальную и прикладную значимость.
Литература:
1. Janosova V., Sykorova M., Stroffekova O., Havranek E. Determination of selected elements by x-ray fluorescence. Spectrometry in liquid drug samples after the proconcentration with thioacetamide/ Anal. Chim. Acta. 2010. V 65. № 1. P. 59–65.
2. Stock J. T. Amperometric titration.// New York. 1991. 730 p.
3. Геворгян А. М., Яхшиева З. З., Султонов М. М., Даминов Г. Н. Тиоацетамид — аналитический реагент на благородные металлы. Джизак-2010. 122 с.







