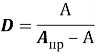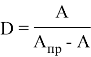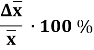В результате исследования разработан высокоизбирательный, чувствительный и экспрессный метод экстракционно-спектрофотометрического определения меди (II) с ПАН в органической фазе.
Разработанный новый метод проверен на анализе пылей, кеков и сточных вод Чимкентского свинцового завода без отделения сопутствующих элементов.
Разработанный новый метод рекомендуется для анализа руд, концентратов, производственных растворов сточных вод, пылей, кеков и других сложных по химическому составу материалов без отделения сопутствующих элементов.
Ключевые слова: экстракция, избирательность, чувствительность, экстракционно-спектрофотометрический метод, комплексообразование, экотоксикант.
Развитие науки, промышленности и внедрение новых технологических процессов приводит ко все возрастающему загрязнению окружающей среды. Возрастающие требования к охране окружающей среды в Республике выдвигают перед химиками эко аналитиками задачу — разработке в аппаратурном оформлении простых экспрессных, чувствительных и избирательных методов определения микроколичеств токсичных веществ, называемых экотоксикантами. Как известно, многие химические соединения и токсичные металлы в результате работы предприятий, заводов и фабрик с атмосферными осадками, растворяясь в капельках влаги в качестве загрязнителей, попадают в почву и воды. Среды загрязнений тяжелые токсичные металлы и их соединения образуют значительную группу экотоксикантов, во многом определяющую антропогенные воздействия на экологическую структуру окружающей нас среды и на самого человека.
Учитывая все возрастающие масштабы производства и применения тяжелых токсичных металлов, высокую токсичность и концерогенность, способность накапливаться в организме человека, оказывает вредное влияние даже в низких концентрациях. Эти химически загрязнители отнесены к числу приоритетных. К таким экотоксикантам также относится медь, кадмий, никель и другие. Поэтому актуальность представленной работы очевидна и современна.
Поиск селективных экоаналических методов определения экотоксикантов в сложных по химическому составу материалах является актуальной задачей.
Современные экоаналитические методы анализа такие, как хромато-спектрометрия, хромато-массспектрометрия, атомно-абсорбционная плазменная, рентгенофлуоресцентная и другие, не всегда позволяют решить эту задачу из-за сложности и малодоступности аппаратуры.
Существующие фотометрические и экстракционно-фотометрические методы определения меди с использованием азореагентов не достаточно избирательны [1, 2], так как комплексообразование меди (II) с азореагентами проводится в водном растворе. При этом многие сопутсвующие ионы образуют соединения с указанными выше реагентами и экстрагируются совместно с медью, следовательно, мешают определению.
Селективность определения ионов меди (II) пиридиновыми оксиазосоединениями повышается с помощью предварительной экстракции ионов меди (II) салицилальдоксимом для отделения их от сопутствующих элементов [3]. Эта методика также недостаточно избирательна, кроме того длительна и не точна, так как, по этой методике после предварительной экстракции проводят операцию реэкстракции, затем опять экстрагируют, которой неизбежны потери.
В последнее время для повышения селективности методов определения элементов применяют новый прием — экстракция бесцветных комплексов элементов инертными органическими растворителями, с последующими добавлением к экстракту органических красителей и определении его непосредственно в органической фазе [4–6].
Результаты иобсуждение. Внастоящей работе обсуждается новый, селективный и простой метод, основанный на экстракции ионидного комплекса меди (II) инертными органическими растворителями и комплексообразование его с ПАН непосредственно в органической фазе.
Исходный раствор меди (II) готовили из CuSO4·5H2O марки “xr” по навеске Титр раствора устанавливали потенциометрически [6]. Спектры экстрактов комплекса меди с ПАН и реагента снимали на спектрофотометре СФ-26. Оптические плотности комплексов измеряли на фотоэлектроколориметре КФК-2.
Таблица 1
Определение молярных соотношений меди иводород— ионов, йодид— ионов, ДМФА методом сдвига равновесия при экстракции хлороформом Апр=0,70, CCu=3,14·10–5 м
|
|
|
|
|
|
|
0,25 |
0,04 |
0,06 |
-1,22 |
0,6989 |
|
0,50 |
0,19 |
0,37 |
-0,43 |
0,3010 |
|
0,75 |
0,27 |
0,62 |
-0,21 |
0,1249 |
|
1,00 |
0,35 |
1,00 |
0,00 |
0,0000 |
|
1,50 |
0,50 |
2,50 |
0,39 |
-0,1760 |
|
2,00 |
0,60 |
6,00 |
0,78 |
-0,3010 |
|
2,50 |
0,70 |
- |
- |
- |
|
|
|
|
|
|
|
0,02 |
0,04 |
0,06 |
-1,22 |
1,699 |
|
0,03 |
0,22 |
0,46 |
-0,24 |
1,523 |
|
0,04 |
0,42 |
1,50 |
0,18 |
1,390 |
|
0,05 |
0,65 |
13,00 |
1,11 |
1,300 |
|
0,06 |
0,67 |
22,33 |
1,35 |
1,220 |
|
0,07 |
0,69 |
69,00 |
1,83 |
1,150 |
|
0,08 |
0,70 |
- |
- |
- |
|
|
|
|
|
|
|
0,3897 |
0,05 |
0,077 |
-1,12 |
0,4092 |
|
0,6495 |
0,18 |
0,346 |
-0,46 |
0,1874 |
|
0,9093 |
0,40 |
1,330 |
0,12 |
0,0413 |
|
1,2990 |
0,59 |
5,360 |
0,73 |
-0,1136 |
|
1,9485 |
0,65 |
13,000 |
1,11 |
-0,2897 |
|
2,5980 |
0,68 |
3400 |
1,53 |
-0,4146 |
|
3,2475 |
0,70 |
- |
- |
- |
Опыты показали, что медь (II) из раствора содержащего H2SO4, йодид-ионов и диметилформамида (ДМФА) избирательно экстрагируется хлороформом. По данным экстракции меди (II) хлороформом в зависимости от концентрации H2SO4, йодид — ионов и ДМФА, оптимальным условием является: 2–4 м по H2SO4, 0,08–0,2 м по йодид ионов и 25–40 об % по ДМФА (по объему). Продолжительность встряхивания фаз 10–15 секунд. При равных объемах водной и органической фаз медь (II) извлекается на 94 % без изменений до соотношения объемов фаз 3 %.
Состав экстрагирующегося йодидного комплекса меди (II) определяли методом сдвига равновесия [7]. Для этого изучены зависимость коэффициента распределения меди(II) от концентрации H2SO4 (0,50–2,0), при постоянных концентрациях ДМФА (30 об %), NaJ(0,1м) и ионной силе (µ=1,3), создаваемой добавлением необходимого количества раствора NaJ; йодид-ионов (0,01–0,08 м), при постоянных концентрациях H2SO4(2,5м), ДМФА (30об %) и ионной силе (µ=1,3); ДМФА (0,13–0,92 м), при постоянных концентрациях H2SO4 (2,5 м), NaJ (0,1м) и ионной силе (µ=1,3). Концентрацию ионов меди (II) в экстракте определяли фотометрическим методом с ПАН.
Результаты полученных данных показали, что в билогарифмических координатах
![]() и
и ![]()
(где D — коэффициент распределения, С- равновесная концентрация) наблюдается прямолинейная зависимость с тангенсами угла наклона прямых равными 2,4,2 (таб.1, рис1).
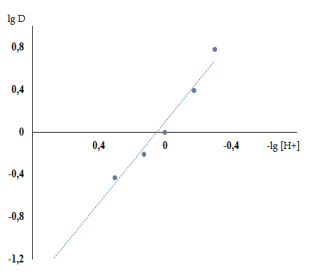
Рисунок 1. Определение молярное соотношение меди водород ионов в хлороформе методом сдвига равновесия;
![]()
![]()
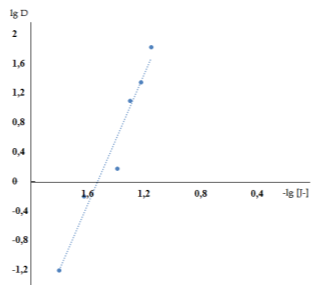
Рисунок 2. Определение молярное соотношение меди йодид ионов в хлороформе методом сдвига равновесия;
![]()
![]()
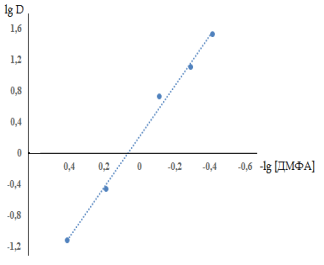
Рис. 3. Определение состава комплекса меди с ДМФА в хлороформе методом сдвига равновесия;
![]()
![]()
Следовательно, медь (II) извлекается хлороформом в виде H2 [CuJ4]; сольватное число H2 [CuJ4] в экстракте равно 2.
Число молекул воды, связанное с H2 [CuJ4] в хлороформе, определенное методом Фишера равно 4 [8].
Исходя из экспериментальных данных, по — видимому йодидный комплекс меди (II) из кислых растворов в присутствии ДМФА экстрагируется хлороформом по гидратно — сольватному механизму [9]:
![]()
Где L0 — хлороформ.
После экстракции меди(II) в оптимальных условиях, отделения водной фазы, добавления к экстракту хлороформного раствора ПАН, буферного раствора и встряхивания фаз в течении 30 секунд медь(II) взаимодействует с ПАН. Установлено, что полное комплексообразование меди (II) происходит в интервалах рН=8,5–11. Методом сдвига равновесия [10] установлено, что медь (II) с ПАН в органической фазе взаимодействует в молярном соотношении 1:2 в низких концентрациях, и в больших концентрациях 1:4 (таб.2 и рис.2).
Таблица 2
Определение состава йодидного комплекса меди сПАН вхлороформе методом сдвига равновесия СCu=3,14 ·10–5м; Апр=0,70
|
СПАН, М·105 |
А |
D |
lgD |
[компл], М·105 |
[ПАН], М·105 |
-lg [ПАН] |
|
5,92 |
0,03 |
0,044 |
-1,356 |
0,134 |
5,786 |
4,24 |
|
11,84 |
0,13 |
0,228 |
-0,642 |
0,580 |
11,260 |
3,95 |
|
17,71 |
0,30 |
0,750 |
-0,124 |
1,340 |
16,420 |
3,79 |
|
23,68 |
0,45 |
1,800 |
0,255 |
1,880 |
21,800 |
3,66 |
|
29,60 |
0,56 |
4,00 |
0,602 |
2,510 |
27,090 |
3,57 |
|
35,52 |
0,67 |
22,333 |
1,348 |
3,00 |
32,520 |
3,49 |
|
41,44 |
0,70 |
- |
- |
- |
- |
- |
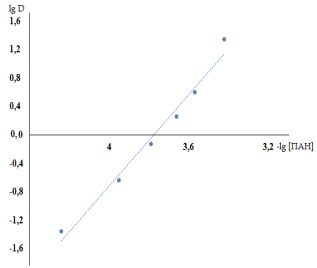
Рис. 4. Определение состава комплекса меди с ПАН в хлороформе методом сдвига равновесия:
![]()
![]()
Следовательно, реакция комплексообразования меди (II) с ПАН в органической фазе сокращенно может быть предоставлена схемой:
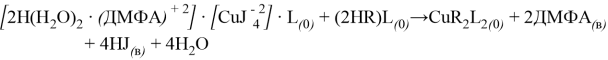
Комплекс меди(II) с ПАН в хлороформе устойчив более трое суток. Кажущийся молярный коэффициент погашения комплекса меди с ПАН при λмакс=560 нм равен 2,8·104. Комплекс меди с ПАН подчиняется закону Бера в интервале 1–160 мкг меди в 10 мл экстракта. Воспроизводимость определения в пределах 1–5 %
Методика определения меди вчистых растворах
В мерный цилиндр емкостью 25 мл притертой пробкой вносят анализируемый раствор содержащий 1–160 мкг меди(II), приливают 3 мл 5м H2SO4, разбавляют водой до 6 мл, добавляют 1 мл 1 м NaJ, содержащий 2 % ной аскорбиновой кислоты (для предотвращения окисления йодид — ионов), 3 мл ДМФА, 5 мл хлороформа и встряхивают 10–15 секунд. Экстракт отделяют делительной воронкой, к экстракту приливают 0,05 % — ного хлороформного раствора ПАН, 5 мл аммиачного буферного раствора с рН=10 и встряхивают 30–40 сек. образовавшийся окрашенный комплекс в экстракте фильтруют относительно раствора холостого опыта.
В условиях экстракции меди частично экстрагируются ионы висмута, ртути, кадмия, палладия, платины и цинка. Однако в условиях комплексообразования меди с ПАН в органической фазе ионы висмута, палладия, кадмия и платины не образуют комплексы с ПАН в органической фазе и не мешают определению. Мешающее влияние ионов цинка устраняют однократным промыванием экстракта 10 мл смесью, содержащих 2 м H2SO, 0,5 м роданид — ионов и 30 об % ДМФА. Изучено также влияние многих посторонних ионов, в которых большие кратные количества не мешали определению приведены в таблице 3.
Таблица 3
Определение меди(II) вприсутствии посторонних ионов (взято 20 мкг Cu+2)
|
M |
M/Cu |
M |
M/Cu |
M |
M/Cu |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Ag(I) |
2500 |
Au(III) |
10002 |
U(VI) |
500 |
|
Tl(I) |
5000 |
Rh(III) |
150 |
W(VI) |
200 |
|
Zn(II) |
100003 |
Ju(III) |
500 |
W(VI) |
20004 |
|
Pb(II) |
10000 |
Ju(III) |
100002 |
Vo(VI) |
200 |
|
Mn(II) |
20000 |
Ga(III) |
1003 |
Vn(VII) |
1000 |
|
Cd(II) |
20000 |
Cr(III) |
5000 |
Os(VIII) |
100 |
|
Hg(II) |
10000 |
Ag(III) |
500 |
Os(VIII) |
10002 |
|
Ca(II) |
20000 |
La(III) |
5000 |
F- |
10000 |
|
Ba(II) |
20000 |
Sn(IV) |
5000 |
Cl- |
20000 |
|
Mg(II) |
20000 |
Ti(IV) |
2500 |
NO3- |
25000 |
|
Pd(II) |
1000 |
Zr(IV) |
500 |
PO4–3 |
10000 |
|
Be(II) |
1500 |
Zr(IV) |
50003 |
C2O4–2 |
Не мешает |
|
Co(II) |
50003 |
Se9IV) |
5000 |
CH3COO- |
10000 |
|
Ni(II) |
1000 |
Th(IV) |
1000 |
S2O3–2 |
10000 |
|
Al(III) |
20000 |
Pt(IV) |
2500 |
ЭДТА |
Не мешает |
|
Fe(III) |
500 |
As(V) |
1000 |
Винная к-та |
Не мешает |
|
Bi(III) |
5000 |
V(V) |
2003 |
Аскорбиновая к-та |
Не мешает |
|
Au(III) |
200 |
Nb(V) |
2500 |
Лимонная к-та |
Не мешает |
М — ион или соединение; M/Cu — допустимые отношение к меди по массе; 1- в присутствии 100 мг NaF в буфере; 2- в присутствии 100 мг аскорбиновой кислоты; 3- после однократного промывания экстракта 10мл раствора содержащего 1,75 м H2SO4, 0,7 м KCNS и 35 % ДМФА (по объему); 4- в присутствии 200 мг винной кислоты.
Разработанный новый метод экстракционно-спектрофотометрического определения меди(II) с ПАН проверен на анализе пылей кеков (таб.4) и сточных вод Алмалыкского горно-металлургического комбината (таб.5).
Таблица 4
Результаты опыта меди сПАН впылях икеках Алмалыкского горно-металлургического комбината (u=4; P=0,95)
|
Номер образца% |
Химический состав образца,% |
Найдено меди,% |
Sr |
Δx · 104 |
%=Δ |
|
Пыль 19763 |
Pb-51,52; Zn-0,28; Zn-12,00; Cd-1,17; Au-0,20; Cu-0,026 |
0,0267 |
0,013 |
±5,52 |
2,07 |
|
Пыль 17979 |
Pb-46,60; Zn-1,38; Zn-18,10; Cd-1,04; Au-0,20; Cu-0,026 |
0,0266 |
0,014 |
±5,81 |
2,18 |
|
Кек 19969 |
Pb-60,85; Zn-0,26; Zn-1,75; Cd-0,27; Tl-0,038; Cu-0,010 |
0,0102 |
0,024 |
±3,82 |
3,74 |
|
Кек 19770 |
Pb-52,50; Zn-0,18; Re-0,0097; Cd-1,22; Tl-0,012; Cu-0,027 |
0,0271 |
0,015 |
±6,49 |
2,30 |
|
Кек 17983 |
Pb-50,55; Zn-1,28; Zn-11,47; Cd-1,19; Tl-0,011; Cu-0,022 |
0,0216 |
0,018 |
±6,22 |
2,87 |
|
Кек 17984 |
Pb-51,55; Zn-1,28; Zn-11,47; Cd-0,33; Tl-0,043; Cu-0,011 |
0,0119 |
0,029 |
±3,89 |
3,26 |
Таблица 5
Результаты определения меди сПАН всточных водах Алмалыкского горно-металлургического комбината (u = 4; P=0,95)
|
Содержание меди всточных водах мг/л |
Найдено меди
(Δ |
Sr · 102 |
|
|
5,00 |
5,5 ± 0,281 |
3,39 |
± 5,4 |
|
12,00 |
13 ± 0,585 |
2,83 |
±4,5 |
|
17,00 |
18 ± 0,738 |
2,57 |
± 4,1 |
|
27,00 |
25 ± 0,875 |
2,20 |
± 3,5 |
|
51,00 |
53 ± 1,325 |
1,57 |
± 2,5 |
Для определения меди в пылях и кеках навеску образца (1г) помещали в колбу на 250 мл, приливали 20 мл HCl(пл=1,19), нагревали на песчаной бане 10 минут, добавляли 10 мл азотной кислоты (пл=1,40), смесь выпаривали до влажных солей, добавляли 10 мл 0,5 м раствора серной кислоты. Выпавший осадок после охлаждения отфильтровали в мерные колбы на 100 мл и разбавляли до метки 0,5 м раствором серной кислоты. Из аликвотной части (1–3мл) раствора определяли медь как при анализе меди из чистых растворов включая однократного промывания экстракта (10 мл) промывочным раствором, содержащего 2 м серной кислоты, 0,5 м роданид — ионов и об 30 % ДМФА. При определении меди в сточных водах также отбирали 2 -3 мл аликвотной части раствора в мерный цилиндр ёмкостью 25 мл с притертой пробкой, дальнейшие операции выполняли по методике определения меди в чистых растворах, также включая однократного промывания экстракта промывочным раствором.
Выводы
Таким образом разработан новый высокоизбирательный, чувствительный и экспрессный метод определения меди с азореагентом ПАН.
1) Исследованы и найдены условия избирательной экстракции меди (II) инертными органическими растворителями в присутствии ДМФА.
2) Исследованы и найдены условия комплексообразования меди (II) с ПАН непосредственно в органической фазе.
3) Имеется возможность увеличения чувствительности методики с использованием более чувствительных азореагентов, которые не нашли распространения в практике из –за их малоизбирательности.
4) Изучено влияние посторонних ионов на результаты определения меди (II) с азореагентом ПАН. Показана возможность определения меди в присутствии больших количеств посторонних ионов.
5) Разработанный метод проверен на анализе пылей, кеков и сточных вод Алмалыкского горно-металлургического комбината.
6) Разработанный метод отличается простотой выполнения, высокой избирательностью, чувствительностью, экспрессностью и рекомендуется для анализа руд, концентратов, производственных растворов, сточных вод и других сложных по химическому составу материалов без отделения сопутствующих элементов.
Литература:
- Тураханова Н. Т., Талипов Ш. Т., новый реагент на основе хинолина (ХАФ) и некоторые свойств его.// Узбекский химический журнал. 1982, № 3. Стр. 21–25.
- Stoynova R. S., Nonova D. экстракционно — спетрофотометрическое определение меди в алюминиевых сплавах с помощью 2-(5-бром-2-пиридилазо)-5-диэтиламинофнола. Докл. Бал.АН., 1985, Т.38.№ 3, Стр. 329–332.
- Dihl J. the application of salicylaldoxume insolvent extraction. Part II. Spectrophotometric determination of copper with 2-(5-nitro-2-pyridazo)-1-naftal afte separation with salicylaldoxime — Anal.Chem.Acta., 1972,V/62, № 1.P.145–152.
- С. М. Турабджанов, Т. В. Понамарева, Д. А. Юсупова, З. Ш. Назиров, Л. С. Рахимова. Исследование сорбции ионов меди из сточных вод фосфорнокислым катионитом // Химическая безопасность. 2018.Т. 2. № 2, С. 173–182. DOI: 10.25514/CHS.2018.2.14115.
- Рахматуллаев К., Гиясов А. Ш. экстракция таллия (III) в присутствии хлорид-ионов и диметилформамида и его комплексообразования с 1-(2-пирилазо)-2_нафтолом в органической фазе. Изв.Вузов. Химия и химическая технология. 1984, Таш.27, № 9, Стр. 1028–1031.
- Турабджанов С. М., Гиясов Ш. А., Рахимова Л. С., Бекназарова И. К. Современный экоаналитический экстракционно-спектрофотометрический метод определения меди с 1- (2-пиридилазо) — 2- нафталом (ПАН) // Журнал Химическая технология. Москва 2018. Т.19. № 11.С.523–530.
- Петрухин О. М. Практикум по физико — химическими методам анализа. М.: Химия, 1987, Стр.134.
- Золотов Ю. А. Методы определения состава экстрагирующихся внутрикомплексных соединений. –М.: Наука, 1968. Стр. 125–152.
- Денеш И. Очистка растворителей // Титрование в неводных средах. –М.: Мир, 1971. Стр. 131.
- Золотов Ю. А., Иофа Б. З., Чучалин Л. К. Экстракционно — фотометрические методы. Экстракция галогенидных комплексов металлов. –М.: Наука, 1974. Стр. 314–320.
- Булатов М. И., Калинкин И.// Определение состава комплексных соединений// Практическое руководство по фотоколориметрическим методам анализа. Л.: Химия, 1986. Стр. 244–251.