Проведены сравнительные исследования коррозионных, поверхностно- энергетических и кислотно-основных свойств образцов из гидрида титана различного технологического происхождения: гидридного титана, полученного методом печного нагрева металла в атмосфере водорода (500 о С, 2 час) и методом самораспространяющегося высокотемпературного синтеза (СВС). Установлено, что эти свойства исследуемых образцов во многом зависят от способа их получения.
Ключевые слова: гидрид титана , поверхностно- энергетические характеристики, кислотно- основные свойства, тестовые жидкости, метод смачивания.
На сегодняшний день гидрид титана имеет довольно широкое практическое применение, среди которых и такие важные направления, как машиностроение и металлургия. Он практически незаменим в космической, авиационной, химической сферах промышленности и в ядерной энергетике [1,2].
Особый интерес представляют материалы на основе гидрида титана, обладающие высокими нейтронозащитными свойствами, что обусловлено характерным для него сечением рассеяния нейтронов и высоким содержанием водорода (4,04 %) [3].
В лаборатории технологии СВС процессов ИХФ им. А. Б. Налбандяна НАН РА гидрид титана получают методом СВС [4], используя при этом тепло собственной экзотермической реакции соединения металла с водородом, что является большим его преимуществом по сравнению с традиционным методом насыщения титана водородом в стационарных условиях печного нагрева [5].
Однако, как известно, свойства веществ во многом зависят не только от качественного и количественного его состава, но также и от способа их получения [6].
В соответствии с этим, в данной работе нами приведены результаты исследования по влиянию способа получения этих образцов на их коррозионные, поверхностно-энергетические и кислотно-основные свойства, играющие определяющую роль в процессах смачивания, адсорбции, хемосорбции и адгезии.
В качестве объекта исследования были использованы образцы из гидрида титана, синтезированные соответственно печным методом и методом СВС.
Некоторые характеристики этих образцов приведены соответственно в работах [4] и [5].
Процесс гидрирования титана печным способом занимает несколько часов и требует значительных энтергетических затрат. Напротив, по методике СВС, гидрид титана можно получить за очень короткое время. Следовательно, формирование поверхностных слоев этих образцов происходит совершенно в различных условиях. Это обусловливает их различные энергетические состояния и реакционную способность. Об этом, в частности, свидетельствуют данные, приведенные на рис. 1 и 2, на которых представлены результаты коррозионных измерений этих образцов в серной и соляной кислотах. Видно, что в обоих этих случаях химическая устойчивость образцов СВС — гидрида титана заметно ниже, чем стойкость образцов печного синтеза.
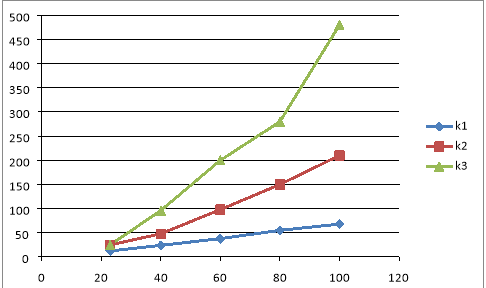
Рис. 1. Коррозия титана и гидрида титана различного технологического происхождения в 40 % H 2 SO 4 , t= 30 0 C: К 1 -Ti; К 2 - TiH 2 (печ); К 3 -TiH 2 (СВС).
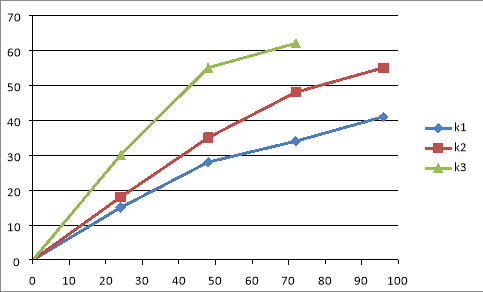
Рис. 2. Коррозия титана и гидрида титана различного технологического происхождения в 30 % HCl, t= 20 0 C: К 1 -Ti; К 2 - TiH 2 (печ); К 3 -TiH 2 (СВС)
На это указывают также поверхностные энергетические и кислотно-основные характеристики этих образцов, которые могут быть оценены методом смачивания этих поверхностей с тестовыми жидкостями с определенными энергетическими свойствами.
Согласно современным представлениям, свободную поверхностную энергию (СПЭ) любого тела можно представить в виде трех составляющих: неполярной Лившица-Ван-дер-Ваальсовой (





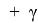



где:
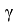
Свободная поверхностная энергия образцов и ее составляющие определялись решением системы уравнений, предложенным Ван Оссом, Чадхри и Гудом [2], по найденным краевым углам смачивания каждой тестовой жидкостью исследуемых материалов:

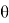



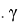



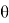



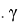



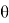



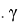


Где:



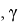
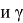
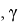
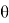

Энергетические характеристики используемых тестовых жидкостей приведены в таблице 1.
Таблица 1
Энергетические характеристики тестовых жидкостей
|
Тестовые жидкости |
Энергетические характеристики, мДжоуль/см 2 | ||||
|
|
|
|
|
| |
|
Вода |
72,8 |
21,8 |
51,0 |
25,5 |
25,5 |
|
Глицерин |
64,0 |
34,0 |
30,0 |
3,92 |
57,4 |
|
Формамид |
58,0 |
39,0 |
19,0 |
2,28 |
39,6 |
|
Дийодметан |
50,8 |
50,8 |
0 |
0 |
0 |
|
Этиленгликоль |
48,3 |
29,3 |
19,0 |
1,92 |
47,0 |
Таким образом, определение поверхностных энергий и кислотно-основных составляющих исследуемых образцов, сводится к измерению краевых углов смачивания этих образцов соответствующими жидкостями.
В данной работе краевые углы смачивания определялись гониометрически, нанесением тестовых жидкостей на поверхность соответствующих образцов. Перед нанесением капли жидкости поверхности образцов обезжиривались ацетоном и просушивались в течение не более 20–30 сек. Краевые углы смачивания исследуемых образцов тестовыми жидкостями приведены в табл.2.
Таблица 2
Краевые углы смачивания исследуемых образцов тестовыми жидкостями
|
Время, мин |
Тестовые жидкости | |||||||
|
Вода |
Глицерин |
Формамид |
Дийодметан | |||||
|
Печ. |
СВС |
Печ. |
СВС |
Печ. |
СВС |
Печ. |
СВС | |
|
1 |
84 |
76 |
105 |
94 |
86 |
82 |
67 |
64 |
|
5 |
86 |
78 |
112 |
98 |
88 |
80 |
72 |
70 |
|
10 |
82 |
74 |
98 |
100 |
86 |
80 |
68 |
70 |
|
15 |
84 |
75 |
98 |
90 |
89 |
82 |
68 |
64 |
|
20 |
82 |
74 |
105 |
92 |
89 |
80 |
70 |
64 |
Как видно из табл. 2, равновесные значения краевых углов смачивания устанавливаются довольно быстро.
Однако, их значения изменяются от опыта к опыту, что, по-видимому, связано с окислением поверхностей образцов кислородом воздуха.
На основании полученных данных нами были определены значения свободной поверхностной энергии и ее компонентов для исследуемых субстратов.
Данные представлены в таблице 3.
Таблица 3
Поверхностно-энергетические и кислотно-основные характеристики исследуемых материалов, мДж/м
|
Материал |
|
|
|
|
|
|
Ti ВТ1–0 |
50,6 |
36,4 |
14,2 |
28,2 |
11,7 |
|
Ti H 2 (СВ) |
44,2 |
28,6 |
15,6 |
20,4 |
10,2 |
|
Ti H 2 (печ.) |
38,4 |
23,6 |
14,8 |
16,6 |
4,2 |
Как видно из приведенных данных, поверхностная свободная энергия металлического титана намного выше, чем поверхностная свободная энергия гидрида СВС- титана и значительно выше, чем поверхностная свободная энергия гидрида титана печного производства. Причем, можно заметить, что дисперсная составляющая поверхностной свободной энергии гидрида титана практически не зависит от способа их синтеза, в то время как полярная составляющая поверхностной свободной энергии существенно зависит от способа получения этих образцов. Полярная составляющая гидрида СВС-титана заметно больше, чем аналогичная составляющая гидрида титана печного производства, причем это обусловлено кислотной составляющей поверхностной свободной энергии. Вероятно, поверхностные кислотные центры СВС-титана более активные, чем кислотные центры гидрида титана печного производства. Этот факт необходимо учитывать при выборе соответствующего связующего при создании нейтронозащитных полимерных композиционных материалов, поскольку известно, что межфазнoe адгезивное соединение тем прочнее, чем больше разница кислотно-основных свойств компонентов системы
Литература:
- Лучинский Г. П. Химия титана.-Химия, 1971.-с.164–166.-472с.
- Под ред. В. Мюллера. Гидриды металлов.-Атомиздат.1973.-с. 432.
- Черкашина Н. И., Павленко А. Б. Расчет нетроннозащитных характеристик полимерного композиционного материала. Известия вузов. Ядерная энергетика.-2018. № 2, с. 291–296.
- Долуханян С. К., Алексанян А. Г., Шехтман В. Ш., Манташян А. А., Маилян Д. Г., Тер-Галстян О. П. Новый метод получения сплавов на основе переходных металлов. Химический журнал Армении. 2007, т. 60. № 4. с. 545–547.
- Ливанов В. А., Буханова А. А., Колачев Б. А. Водород в титане. Москва.- Государственное научно-техническое издательство литературы по черной и цветной металлургии. 1962.- Металлургиздат,с.246.
- Хачатрян Э. А., Казарян А. Г. Влияние способа получения металлического титана на его коррозионное поведение в 40 %-ом растворе серной кислоты.-Известия НАН Армении и Гос. Инж.Университета Армении,-Ереван,-серия тех. наук.-2010, т.63, с. 49–54.