В статье описывается изучение нуклеации и роста гидрата метана в присутствии ультрафиолетового излучения и синтезированного покрытия наноструктурированного анодным оксидированием диоксида титана. В экспериментах с применением ультрафиолетового излучения получен больший на 11,03 % объем поглощения метана и большая на 16,66 % скорость плавления гидрата.
Введение (актуальность)
Газогидратные технологии утилизации, хранения и транспортировки природного, попутного нефтяного (ПНГ) и техногенных газов [1, 2, 3, 4, 5, 6], а также разделение газовых смесей [7, 8] представляют собой актуальную научно-инженерную задачу. При образовании газового гидрата из жидкой воды и газа, нуклеация гидрата чаще всего происходит вблизи границы раздела фаз жидкость–газ благодаря максимальному пресыщению жидкости растворенным газом, которое достигается в этой области [9]. Согласно классической теории нуклеации, различают два механизма нуклеации — гомогенную, и гетерогенную — образование первичного зародыша на присутствующих в жидкости мельчайших твердых частицах, активных точках на стенках сосуда и т. д., обычно называемыми центрами гетерогенной нуклеации. В настоящее время интенсивно исследуется влияние на нуклеацию гидратов порошков различных веществ, искусственно вносимых в воду, частицы которых являются центрами гетерогенной нуклеации [10]. В работах [11, 12] показано, что гидрофобизирование поверхности позволяет ускорять процесс нуклеации гидратов метана, тетрагидрофурана и циклопропана. Для увеличения скорости роста гидрата и степени превращения воды в гидрат чаще всего используют небольшие добавки некоторых поверхностно-активных веществ к воде. Описываемое явление было обнаружено в работе [13]. Интересны результаты, полученные исследователями при изучении дисперсий углеродных нанотрубок в диапазоне концентраций. Установлено, что при добавлении многостенных углеродных нанотрубок (МУНТ) в чистую воду процесс гидратообразования требует меньше времени. Исследователями выдвинуто предположение о том, что упорядоченная поверхность МУНТ в этом случае является промотором гидратообразования [14]. Нелинейный характер зависимости объема поглощенного метана от концентрации МУНТ ставит вопрос установления более полного механизма гидратообразования в присутствии пористых упорядоченных поверхностей. Добавление в воду нанопорошка графита способно уменьшить индукционный период образования гидрата углекислого газа в 5–10 раз (в зависимости от давления), а также несколько ускоряет процесс роста гидратных частиц [15]. Нанотрубки из анодного оксида титана [35, 36] представляет наибольший интерес из-за его уникальной самоорганизующейся структуры и размерных параметров [29, 30]. Он обеспечивает широкий спектр применения в газовых сенсорах, солнечных элементах [30], водородной энергетике, в качестве носителей катализаторов [31], а также в фотокаталитических системах [32] и биосовместимых покрытиях. Системы на основе диоксида титана представляют интерес в качестве электродов для электролиза и для электроаналитических целей благодаря химической инертности, коррозионной стойкости [33]. Являясь условно нерасходным активатором гидратообразования, применение покрытий из нано структурированного оксида титана способствует снижению экологической нагрузки промысловых районов. Таким образом, тема исследования является актуальной отраслевой задачей и соответствует современным мировым тенденциям в области экологии, физической химии и технологии газовых гидратов. Из них наиболее важными видятся процессы формирования гидратов, и связанные с этим проблемы низкой скорости зародышеобразования (нуклеации) и роста гидратной фазы.
Оборудование
Для изучения формирования и разложения газогидратной фазы в присутствии ультрафиолетового излучения и образца TiO2 использовалась ячейка высокого давления объемом 250 мл, изготовленная из аустенитной стали 316L (GHA, Vinci Technologies, Франция), с толщиной стенок 20 мм.
В качестве источника ультрафиолетового излучения использовался комплект электроники с УФ светодиодом 270 нм на 100 мВт от компании Азимут Фотоникс.
В экспериментах использовался вкладыш в ячейку, изготовленный из политетрафторэтилена (ПТФЭ) Фторопласт-4/Teflon 7® (ГОСТ 10007- 80/ASTM D 1710) с толщиной стенок 2,0 мм. Масса вкладыша 62,54 г., объем 28,43 мл (объем ПТФЭ используется в расчете объема газа).
Все эксперименты проводились без перемешивания жидкой фазы. Таким образом, обеспечивалось разделение периодов роста гидратов на первичный (линейно-радиальный), образуя пленку толщиной 10–70 мкм [] и вторичный (диффузионный).
Циклы охлаждения-нагрева ячейки проводились термостатом Huber 45 (Huber GmBH, Германия) с микропроцессорным управлением. Объем теплоносителя 26 литров. Точность поддержания заданной температуры в диапазоне от +- 0,1С до +60С.
Температура регистрировалась термометром резистивного типа Pt100. Датчик помещен в депрессорную гильзу, погруженную в жидкую фазу образца. Для улучшения теплового контакта депрессорная гильза была заполнена глицерином. Преобразователь позволяет регистрировать температуру с точностью +- 0,1С. Давление измерялось датчиком давления пьезоэлектрического типа с цифровым преобразователем LEX1 (Keller AG, Швейцария); в диапазоне 0–450 бар, относительная погрешность <=0,05 % ВПИ (FS), абсолютная погрешность <= 0,025 ВПИ (FS).
Для определения состава газа использовался поверенный колоночный газовый хроматограф GC-2014 (Shimadzu Inc., Япония), на линиях измерения и сравнения колонки 1,5х3000 мм, на сорбентах Porapack® и NaX по методике ГОСТ 31371.3–2008 (ISO 6974–3:2000).
Измерения объемов газовой фазы проводились газометром MG series (Vinci Technologies, Франция) в диапазоне 0–4000+-0,1 см3 с диапазоном и точностью измерения давлений 0–1,38 бар +-0,2 ВПИ (FS) при измерении температуры в дтапазоне 25–40+-0,1С датчиком резистивного типа Pt100.
Методика эксперимента
Измерения проводились в изохорном режиме. Каждый из типов экспериментов проводился в ячейке с вкладышем из политетрафторэтилена (ПТФЭ).
Образец насыщался метаном до достижения давления в ячейке 15 мПа при 20С. Далее система выдерживалась для установления равновесия. После выдерживания реактор охлаждался до температуры со скоростью 5С /мин. По достижении установленной температуры, начинался медленный прогрев со скоростью 2С/мин. Регистрация давления и температуры идет параллельно изменению состояния системы с дискретностью 4сек.
Измерения проводятся сериями по 10 циклов формирования и плавления газогидратной фазы. Первый цикл приводит к некоторому пресыщению жидкой фазы с возможным формированием микро- и нанопузырьков.
В дальнейших циклах формирование гидрата проходит в аналогичных условиях. В формировании статистической выборки использованы последующие девять измерений.
План исследования состоит из 3 серий экспериментов. Первая часть измерений проведена с образцами детонизированной воды, метана и чистой титановой пластины на держателе. Вторая часть измерений проведена с деионизированной водой, метаном и титановой пластинкой с TiO2 HT. Третья часть измерений проведена с деионизированной водой, метаном, титановой пластиной на держателе и включенным УФ излучателем. Измерение объема метана в изохорных экспериментах проводится после проведения всех циклов серии.
Включение УФ излучателя в 3 серии экспериментов проводилось поэтапно каждые 5 минут на протяжении 5 минут. Начало включения УФ излучателя является момент приближения к точке нуклеации гидрата метана согласно равновесной формирования и составляет ~17С. Выключение происходит при приближении к 0С.
Характеризация образцов
Образец получен на титановой фольге марки ВТ 1–0, размером 2х3см предварительную подготовку которой проводили путем травления в смеси HF: HNO 3 в соотношении 1:3 при температуре 90С в течение 1–2 с, затем тщательно промывали дистиллированной водой, сушили на воздухе и перед процессом формирования нанотрубок обезжиривали этиловым спиртом.
Получение проводили методом электрохимического окисления титана с использованием источника постоянного стабилизированного напряжения Потенциостат-гальваностат PGU200В-500 мА (Германия). В качестве катода использовали платиновый электрод площадью 4 см 2 .
Состав электролита:
— Этиленгликоль (C 6 H 5 O 2 ) — 97,7 %
— Фторид аммония (NH 4 F) — 0,3 %
— Вода — 2 %
Проведено исследование морфологии поверхности образца с помощью сканирующей электронной микроскопии. Сканирующий электронный микроскоп.
На поверхности образца сформировано нанотрубчатое покрытие из TiO 2 , трубки расположены несколько хаотично, имеют средний диаметр около 90 нм (от 80 до 100 нм) и предполагаемую длину от 800 до 1000 нм (рис. 1).

Рис. 1. СЭМ-изображение поверхности образца 2 с нанотрубками
Большая часть трубок покрыта пористым слоем диоксида титана с диаметром пор 50 нм (рис. 2).

Рис. 2. СЭМ-изображение поверхности образца 2 с нанопорами
Небольшая часть поверхности образца (порядка 10 %) покрывается вторичным плотным слоем диоксида титана и не имеет пор (рис. 3).
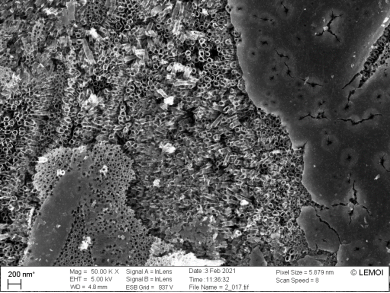
Рис. 3. СЭМ-изображение поверхности образца
Результаты экспериментов и обсуждения
Ход эксперимента показан на диаграмме (Рис.4). Функция снижения давления от температуры имеет первый экстремум в точке 3,8 o C, 130,67 bar демонстрирующий быстрое падение экстенсивного параметра (P). Идет стадия образования гидратной пленки, которая завершается изоляцией границ разделов фаз. Скорость линейного роста гидрата в этой стадии намного выше, чем в последующей стадии диффузионного роста, когда образование гидратов продолжается в условно гомогенной среде (из растворенного метана) с диффузионной компенсацией убыли метана в жидкой фазе. В этот момент регистрируется ярко выраженный температурный эффект, вызывающий локальное повышение температуры на 0,3 o C в точке 4,1 o C/130,58 bar.
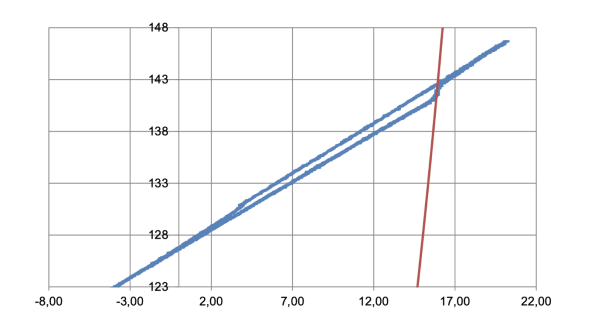
Рис. 4. P/t diagram
Дальнейшее снижение температуры сопровождается уменьшением скорости поглощения и соответствующим спадом экзотермического температурного эффекта (площадь поверхности раздела фаз исчерпана).
Окончание стадии охлаждения системы протекает с достаточно высокой скоростью 5,0 o C/h и график функции давления по температуре приобретает линейный характер.
Нагрев системы происходит достаточно медленно 2,0 o C/h, что позволяет приблизиться к теоретической равновесной гидратообразования в этих условиях.
В окрестностях теоретической равновесной кривой начинается ускорение повышения давления в точке 15,8 o C/141,44 bar, что означает начало плавления твердой гидратной.
Дальнейший нагрев продолжает процесс конгруэнтного плавления гидрата, однако, гистерезис системы (энтальпия разложения гидрата CH4 437,020 kJ/kg) удерживает температуру компонентов в окрестностях фигуративной точки проходящей вдоль теоретической равновесной кривой.
Окончание фазового перехода регистрируется последним экстремумом функции давления по температуре на отметке 15,9 o C/142,68 bar. Далее происходит равномерный нагрев двухфазной системы за пределами условий реакции, до достижения установленной температуры 20 o C.
В ходе измерений зарегистрирована разница в кинетике гидратообразования между контрольным образцом (Ti) и образцом с покрытием (TiO 2 ). Индукция гидратообразования заканчивается позже на 15 минут и начинается стадия линейного роста гидратов, после изоляции границы раздела фаз переходящая с диффузионный рост.
Стадия плавления гидрата в системах с обоими образцами наступает почти одновременно. Различия касаются скорости плавления и объемов выделенного газа. Графики демонстрируют, что в экспериментах с образцом покрытия (TiO 2 ) получен больший̆ на 11,03 % объем поглощения и большую на 16,66 % скорость плавления гидрата.
Заключение
В результате проведенных измерений установлено положительное воздействие наноструктурированного покрытия из диоксида титана на скорость и глубину гидратообразования.
Получена общая характеристика покрытия из TiO 2 — активатор гидратообразования с мезопористой структурой, комплементарной кристаллической структуре гидрата метана КС-I. Получен больший на 11,03 % объем поглощения и большая на 16,66 % скорость плавления гидрата. Кроме того, задержка фаз образования и плавления гидратных структур предположительно связана с гидрофобным характером покрытия (повышением энтальпии образования кристаллических гидратных структур).
Следует отметить, что покрытия из нано структурированного анодным оксидированием диоксида титана обладают фото каталитическими свойствами. Поиск возможности преодоления энергетического барьера индукции с помощью фото активации процесса станет предметом дальнейшей работы.
Литература:
- Gudmundsson, J. S. Method for production of gas hydrates for transportation and storage. U. S. Patent 5,536,893, 16 July (1996)
- Larsen R. Hydrates in petroleum production, 2002, Larsen R., Lund A., Argo C. B. Cold flow — a practical solution, Proc. of the 11th International Conference on Multiphase Flow. San Remo. (2003)
- Nakai S. Development of Natural Gas Hydrate Supply Chain. Gastech 2011, Niktar H. Flow assurance and multiphase pumping. A Thesis. Texas A&M University. (2006)
- Rehder G., Eckl R., Elfgen M. Methane Hydrate Pellet Transport Using the Self-Preservation Effect: A Techno-Economic Analysis. Germany. (2012)
- Kanda H., Nakamura K., Suzuki Т., Uchida K. Economics and energy requirements on natural gas ocean transport in form of natural gas hydrate (NGH) pellets. / Proc. 5th Gas Hydrate Conference. 13–16 June (2005)
- Norway. Vol.4. P.1275–1282, E. D. Sloan, C. A. Koh, A. K. Sum, A. L. Ballard, G. J. Shoup, N.McMullen, J. L. Creek, and T.Palermo. Hydrates: State of the Art Inside and Outside Flowlines. JPT • DECEMBER. (2009).
- Jia Liu1, Yajuan Wei1, Wei Meng, Pei-Zhou Li, Yanli Zhao, and Ruqiang Zou Understanding the Pathway of Gas Hydrate Formation with Porous Materials for Enhanced Gas Separation Research Vol. (2019), Article ID: 3206024 pp. 1–10, DOI: 10.34133/2019/3206024, https://doi.org/10.34133/2019/3206024
- Ponnivalavan BabuPraveen LingaRajnish KumarPeter Englezos A review of the hydrate based gas separation (HBGS) processfor carbon dioxide pre-combustion capture, Energy Vol. 85 (2015) pp. 261–279.
- Sloan, Koh, Clathrate hydrates of natural gases. 3d ed. Boca Rator — London — New-York: CRC Press; (2008).
- Manakov, A. Y., Penkov, N. V., Rodionova, T. V., Nesterov, A. N., & Fesenko Jr, E. E. Kinetics of formation and dissociation of gas hydrates. Russian Chemical Reviews, 86(9), 845 (2017).
- Li, H., & Wang, L. Hydrophobized particles can accelerate nucleation of clathrate hydrates. Fuel, 140, 440–445 (2015).
- Filarsky, F., Schmuck, C. and Schultz, H.J., Development of a Surface‐ Active Coating for Promoted Gas Hydrate Formation. Chemie Ingenieur Technik, 91(1–2), pp.85–91 (2019).
- А. Н. Нестеров. Дис. д-ра хим. наук. ИКЗ СО РАН. Тюмень. 2006; О. Б. Кутергин, В. П. Мельников, А. Н. Нестеров. ДАН, 323, 549 (1992).
- Park, S. S., Lee, S. B., & Kim, N. J., Effect of multi-walled carbon nanotubes on methane hydrate formation. Journal of Industrial and Engineering Chemistry, 16(4), 551–555 (2010).
- Zhou, S. D., Yu, Y. S., Zhao, M. M., Wang, S. L., & Zhang, G. Z., Effect of graphite nanoparticles on promoting CO2 hydrate formation. Energy & Fuels, 28(7), 4694–4698 (2014)
- Tsutomu Uchida, Kenji Yamazaki, and Kazutoshi Gohara, Gas Nanobubbles as Nucleation Acceleration in the Gas-Hydrate Memory Effect, J.Phys. Chem. C (2016), vol. 120, pp. 26620−26629, DOI: 10.1021/acs.jpcc.6b07995;
- Tsutomu Uchida, Kenji Yamazaki, and Kazutoshi Gohara, Generation of micro- and nano-bubbles in water by dissociation of gas hydrates, Korean J. Chem. Eng.(2016), pp. 1–7, DOI: 10.1007/s11814–016–0032–7;
- Holzammer, C., Schicks, J.M., Will, S. and Braeuer, A.S., Influence of sodium chloride on the formation and dissociation behavior of CO2 gas hydrates. The Journal of physical chemistry B, 121(35), pp.8330- 8337(2017).
- Pitzer, K. S., D. Z. Lippmann, R. F. Curl, Jr., C. M. Huggins,and D. E. Peterson, “The Volumetric and Thermodynamic Properties of Fluids. 11. Compressibility Factor, Vapor Pres- sure and Entropy of Vaporization,” ibid., 77, 3433 (1955).
- Iu.M. Em, A. M. Zakharenko, D.Yu. Kosyanov, A. S. Stoporev and A. N. Gulkov1 Enhancement of Gas Hydrates Synthesis with CNT Surfaces, Conference: Proceedings of the International Conference on Advanced Materials with Hierarchical Structure for New Technologies and Reliable Structures (2018), AIP Publishing, DOI: 10.17223/9785946217408/407; https://aip.scitation.org/doi/10.1063/1.5083315
- Z. Li; J. Wang; M. Li; C. J. Chen; W. Ge; Z. Fu; R. Peng; X. Zhai; y. Lu, Core-shelled mesoporous CoFe2O4 — SiO2 material with good adsorption and high- temperature magnetic reciling capabilities. J. Phis. and Chem. Solids. (2018) No9. 1–26. Doi 1016/i.jpcs 2017.12.056.
- S. Nappini, E. Magnano, F. Bondino, J. Pis.A. Barla, E. Fantechi, F. Paineider, C. Sangregorio, L. Vaccari, L. Venturelli, P. Baglioni // J. Phes. Chem. (2015) 119.25529–25541.
- V. Daboin, S. Brice__o, J. Suarez, G. Gonzalez. Effect of dispsing agent on the structural and materials. (2017) No8 Doi http//dxdoi.org/10.1016 2017.08.043i.immm
- Ю. Ф. Макогон, Дж. С. Хольсти, Вискерные кристаллы гидратов, Рос.Хим.Ж. (Ж.Рос.хим. об-ва им. Д. И. Менделеева), (2003), т. XLVII, No3
- Y. F. MAKOGON, T. Y. MAKOGON, AND S. A. HOLDITCH, Kinetics and Mechanisms of Gas Hydrate Formation and Dissociation with Inhibitors, ANNALS NEW YORK ACADEMY OF SCIENCES pp. 777- 796 (2000);
- J. M. Macak, Wachstum anodischer selbst-organisierter Titandioxid Nanoröhren Schichten, Ph.D. thesis, University of Erlangen-Nurnberg, (2008).
- A. N. Belov, The formation of nanostructures based on porous anodic metal oxides, Ph.D. thesis, Moscow State University, (2011).
- D. I. Petukhov, I. V. Kolesnik, A. A. Eliseev, A. V. Lukashin, and Yu.D. Tretyakov, Al’ternativnaya energetika i ekologiya 45 (2007) 65–69.
- J. M. Macak, H. Tsuchiya, A. Ghicov, K. Yasuda, R. Hahn, S. Bauer, and P. Schmuki, TiO2 nanotubes: Self-organized electrochemical formation, properties and applications, Current Opinion in Solid State and Materials Sci. 11 (2007) 3–18.
- A. N. Belov, I. M. Gavrilin, S. A. Gavrilov, A. A. Dronov, and A. S. Shulyatyev, Highly ordered arrays of TiO2 nanotubes in flexible photovoltaic cells, Izvestiya Vuzov. Elektronika 88 (2011) 39–40.
- J. M. Macak, P. J. Barczuk, H. Tsuchiya, M. Z. Novakovska, A. Ghicov, M. Chojak, S. Bauer, S. Virtanen, P. J. Kulesza, and P. Schmuki, Self- organized nanotubular TiO2 matrix as support for dispersed Pt/Ru nanoparticles: Enhancement of the electrocatalytic oxidation of methanol, Electrochem. Comm. 7 (2005) 1417–1422.
- D. Fang, Z. Lio, K. Huang, and D. C. Lagoudas, Effect of heat treatment on morphology, crystalline structure and photocatalysis properties of TiO2 nanotubes on Ti substrate and freestanding membrane, App. Surface S. 257 (2011) 6451–6461.
- A. Fujishima and K. Honda, Electrochemical Photolysis of Water at a Semi-conductor Electrode, Nature 238 (1972) 37–38.

