В работе представлен анализ возможных химических процессов, протекающих в растворах кислородсодержащих соединений хлора. Рассмотрены возможные формы существования хлорсодержащих соединений в зависимости от кислотности среды растворов.Проанализирована окислительная активность растворов хлорной извести и гипохлорита натрия.
Ключевые слова: соединения хлора, окислительная активность, активный хлор, факторы, параметры процесса
Хлор и хлорсодержащие соединения по механизму своего действия относятся к классу сильных окислителей. В данном качестве их часто используют для очистки сточных вод от поливалентных металлов (марганца, железа, хрома и др.), сероводорода, цианидов и др. [2, 3, 5]. А также данные соединения находят широкое применение как дезинфицирующие средства, обладающие самым широким спектром противомикробной активности, сравнительно быстрым действием и дешевизной [1].
Благодаря разнообразию форм выпуска и широкому спектру активности в отношении различных микроорганизмов хлорсодержащие дезинфицирующие средства применяют для, дезинфекции поверхностей, мебели, оборудования, посуды, инвентаря, белья, игрушек в медицинских организациях, организациях общественного питания, объектах коммунально-бытового обслуживания, детских дошкольных и образовательных учреждениях, культурно-оздоровительных и спортивных комплексах, учреждениях социального обеспечения, пенитенциарной системе и т. д. Данная группа препаратов активно применяется для дезинфекции сточных вод, вод плавательных бассейнов, питьевой воды [1, 4, 7].
Следует отметить, что во всех случаях эффективность применения хлорсодержащих реагентов (окислителей) в различных областях промышленности и медицины напрямую зависит от окислительной активности используемого соединения.
Таким образом, изучение особенностей окислительно-восстановительных свойства хлорсодержащих окислителей, а также факторов, влияющих на их окислительную активность, является в настоящее время актуальной задачей.
Хлор и различные хлорпроизводные широко применяются для производства: красителей, растворителей, отбелке целлюлозы, а также в производстве синтетических полимерных материалов [4]. Эффективность применения хлорсодержащих реагентов в различных областях промышленности и медицины напрямую зависит от окислительной активности используемого соединения.
Наиболее полно свойства растворов хлора и его кислородных соединений изучены группами ученых под руководством профессоров Флиса И. Е. и Тумановой Т. А. [4]. В этих работах установлено, что участниками окислительных процессов могут быть все компоненты растворов кислородных соединений хлора. Доля же участия этих компонентов в окислительных процессах зависит от рН и присутствия в растворах восстановителя. Максимум скорости окисления в нейтральных растворах гипохлоритов обусловлен только свойствами окислительной системы. Показано, что реакции, протекающие в растворах «активного хлора», относятся к типу реакций, катализируемых в слабокислой и нейтральной средах ионами Н+ и ОН-. Ионы Н+ и ОН- в окислительно-восстановительных реакциях могут быть и участниками процесса, и катализаторами его.
В своих исследованиях Флис И. Е. и Туманова Т. А. пришли к выводу, что в растворах кислородных соединений хлора окислительные процессы обусловлены действием атомарного кислорода, образующимся в результате разложения «активного хлора» при взаимодействии с восстановителями (в качестве восстановителей могут выступать катионы металлов — Mn2+, Fe2+ и др.):
Mn2+
НСlО → НСl + О٠
Процесс образования кислорода в результате разложения хлорноватистой кислоты НСlО более вероятен, чем такой же процесс разложения гипохлорит-ионов СlО¯.
При совместном присутствии в растворе хлорноватистой кислоты и гипохлорит-иона разложение их с образованием атомарного кислорода более вероятно, чем процесс образования кислорода в результате разложения одного из компонентов [2–4].
В чистых растворах гипохлорит-ионы наиболее устойчивы в щелочной среде при рН до 10, а в нейтральной, кислой и слабощелочной средах разлагается с образованием кислорода, хлорида и хлората.
В нейтральной и слабокислой средах разложение «активного хлора» происходит по следующим схемам: НСlО + СlО¯ → О2 + 2Сl¯ + H+
НСlО + 2СlО¯ → СlО3¯ + 2Сl¯ + H+
В кислой среде разложение идет по следующим реакциям:
НСlО → О2 + 2Сl- + 2H+
3НСlО → СlО3− + 2Сl- + H+
На скорость кислородного разложения «активного хлора» значительно влияет присутствие катализаторов [4]. Ряд авторов указывают [4, 5], что в качестве катализаторов могут выступать ионы металлов переменной валентности. По данным работ [7,11] активность металлов в качестве катализатора уменьшается в ряду Со2+ > Ni2+ > Сu2+ > Fе2+. В отличие от этих ионов соединения марганца значительно повышают степень окисления в сильнокислой и слабощелочной средах [2, 3].
В присутствии катализаторов, восстановления «активного хлора», до хлорида могут восстанавливаться даже хлораты, и, вероятно, участвовать в окислительном процессе [7]. Поэтому можно предположить, что атомарный кислород можно получить каталитическим разложением «активного хлора» во всем диапазоне рН, в котором хлор находится в растворе в виде кислородных соединений (рис.1).
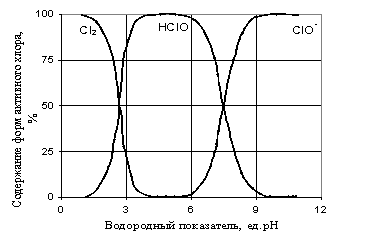
Рис. 1. Содержание форм «активного хлора» в растворе при различных диапазонах рН [1]
Таким образом, проведенный литературный анализ исследуемой проблемы показал, что окислительно-восстановительный процесс с участием хлорсодержащих окислителей (молекулярного хлора, кислородных соединений хлора и др.) преимущественно протекает с разложением «активного хлора» на атомарный кислород и хлорид-ионы. Именно атомарный кислород выступает как активный реагент-окислитель в окислительно-восстановительных процессах. Причем, присутствие катионов поливалентных металлов (Mn2+, Fe2+ и др.), оказывает катализирующее действие на процесс восстановления «активного хлора», что значительно ускоряет время протекания процесса. Следовательно, окислительную активность хлорсодержащих окислителей можно оценивать по содержанию в них «активного хлора».
В экспериментальной части работы были проанализированы на содержание «активного хлора» растворы хлорсодержащих окислителей: 1 % раствора хлорной извести и гипохлорита натрия. Кроме того, экспериментальным путем установлено влияние рН растворов на окислительную активность хлорсодержащих соединений (исследования проводились с использованием растворов гипохлорита натрия). Обоснованность и достоверность полученных результатов подтверждается представительностью и надежностью исходных данных; сходимостью результатов теоретического анализа и аналитического исследования с результатами экспериментальных исследований [6].
Полученные результаты экспериментальных исследований представлены в таблице 1.
Таблица 1
Содержание «активного хлора» врастворах хлорсодержащих окислителей
|
Объем тиосульфата натрия, пошедшего на титрование, см3 |
Содержание «активного хлора», мг | |
|
Раствор хлорной извести | ||
|
13,8 |
2,46 |
2,46 |
|
14,0 |
2,49 | |
|
13,7 |
2,44 | |
|
Раствор гипохлорита натрия | ||
|
23,6 |
4,20 |
4,15 |
|
23,8 |
4,24 | |
|
23,7 |
4,22 | |
Анализируя полученные данные о содержании «активного хлора» в исследуемых хлорсодержащих растворах можно сделать вывод о том, что наиболее эффективным реагентом в качестве окислителя является раствор гипохлорита натрия. Следовательно, далее в исследованиях в качестве хлорсодержащего окислителя рассматривали только растворы гипохлорита натрия.
Для исследования влияния рН раствора на полноту окислительного осаждения ионов марганца (II) растворами гипохлорита натрия была приготовлена серия стандартных модельных растворов с разными значениями рН (от 4,0 до 10,0) и постоянным содержанием ионов Мn2+ — 100 мг/дм3. Методика проведения эксперимента заключалась в следующем: в семь мерных колб вместимостью 100 см3 вносили 10 см3 стандартного раствора сульфата марганца с концентрацией ионов Мn (II) — 1,00 мг/см3 и доводили дистиллированной водой до метки. Концентрация ионов Мn2+ в полученном модельном растворе составляла 100 мг/дм3. Затем полученные модельные растворы количественно переносили в конические колбы для титрования объемом 250 см3. Далее в каждую колбу вносили 2 см3 реагента-окислителя 1 % раствор гипохлорита натрия. Далее колбу закрывали притертой пробкой, тщательно перемешивали и оставляли на 10 минут. Образовавшийся в ходе реакции осадок диоксида марганца (МnО2) отфильтровывали в другую коническую колбу на 250 см3 через фильтр «синяя лента». Далее в полученном фильтрате определяли остаточное содержание ионов Мn2+ фотометрическим методом с использованием персульфата аммония.
Полученные результаты исследований показали, что при равных концентрация катионов осаждаемого марганца (Мn2+) и реагента-окислителя (раствора гипохлорита натрия — NaClO) в растворе максимальные показатели извлечения металла наблюдаются в интервале рН от 4,0 до 6,5, т.е в диапазоне с преимущественным образованием молекулНОСl.
Литература:
1. Бахир В. М., Леонов Б. И., Паничева С. А., Прилуцкий В. И., Шомовская Н. Ю. Химический состав и функциональные свойства хлорсодержащих дезинфицирующих растворов. Вестник новых медицинских технологий, № 4, 2003г.
2. Мишурина О. А. Электрофлотационное извлечение марганца из гидротехногенных ресурсов горных предприятий // Вестник Магнитогорского государственного технического университета им. Г. И. Носова. 2009. № 3. С. 72–74.
3. Мишурина О. А., Чупрова Л. В., Муллина Э. Р. Особенности химических способов извлечения марганца из технических растворов // молодой ученый. 2013. № 5. С. 84–86.
4. Туманова Т. А., Флис И. Е. Физико-химические основы отбелки целлюлозы: Химические и физико-химические свойства хлора и его кислородных соединений / Под ред. Мищенко К. П. — М.: Лесная промышленность, 1972. — 262 с.
5. Чантурия В. А., Шадрунова И. В., Медяник Н. Л., Мишурина О. А. Технология электрофлотационного извлечения марганца из техногенного гидроминерального сырья медноколчеданных месторождений Южного Урала // Физико-технические проблемы разработки полезных ископаемых. 2010. № 3. С. 89–96.
6. Чупрова Л. В., Ершова Л. В., Муллина Э. Р., Мишурина О. А. Инновационный образовательный процесс как основа подготовки современного специалиста // Современные проблемы науки и образования. 2014, № 6, С.864.
7. Яковлев С. В., Краснобородько И. Г., Рогов В. М. Технология электрохимической очистки воды. — Л.: Стройиздат, Ленинградское Отделение, 1987. — 312 с.

