Актуальность.
Переломы длинных трубчатых костей конечностей одна из самых распространённых и тяжелых патологий, требующей детального изучения и повышения эффективности хирургического лечения. Это связано прежде всего с современной тенденцией утяжеления травм (Илизаров Г. А., Макушкин В. Д., 1977; Карлов A. B., 2003; Барков A. B., Барков A. A., Алещенко И. Е., 2010; Дьячков А. Н., Ручкина И. В., Осипова Е. В., 2010). Последствиями сочетанных и множественных травм является нарушение консолидации переломов, как вследствие недостаточности ресурсов организма, так и местных тканевых повреждений.
Ведущими факторами в патогенезе замедленной консолидации являются ухудшение кровоснабжения и выраженные гемоциркуляторные нарушения в повреждённом сегменте (Решетников А. Н. и соавт., 2009). Сложность проблемы заключается в разнообразии патологических состояний, в ограниченном количестве методов лечения способных в короткие сроки полноценно восстановить повреждённую кость. А главное, в недостаточной потенции естественной репаративной регенерации (Виноградова Т. П., Лаврищева Г. И., 1974; Склянчук Е. Д. и соавт., 2009; Барабаш А. П., Барабаш Ю. А., Норкин И. А., 2010).
Применение хирургических методов стимуляции остеогенеза, в том числе ауто- и аллопластики, использование металлоконструкций с гидроксиапатитным покрытием, керамических и углеродных имплантатов, полимерных штифтов при данной патологии всегда сопряжено с дополнительной травмой сосудистого русла в зоне травматизации конечности. А так же с длительной перестройкой трансплантатов и риском развития осложнений в 10–54,5 % случаев (Попков A. B. и соавт., 2004; Лунева С. Н., Ковинька М. А., Гребнева О. Л., 2006; Щепкина Е. А. и соавт., 2007; Погорелый Д. К. и соавт., 2010; Германов В. Г. и соавт., 2010; Варганов В. Е., 2010; Kujala S. et al., 2008). Наиболее частыми осложнениями является формирование ложных суставов, лечение которых значительно отягощает течение лечебного процесса и увеличивает сроки реабилитации. Поэтому разработку и использование эффективных, в тоже время щадящих методов регуляции репаративной остеорегенерации, особенно на начальных этапах её нарушения, следует признать оправданными и перспективными.
Улучшить условия для репаративной регенерации костной ткани, которая является сложным многостадийным процессом, можно путём местного воздействия в область перелома кости путем применения стимуляторов. К которым относится группа факторов роста, постоянно присутствующих в костной ткани и участвующих в физиологической и репаративной регенерации (Пустовойт М. И., Коцкович И. М., Струтинский Я. И., 1993; Морозов В. П. и соавт., 2008; Барабаш А. П. и соавт., 2010). Повышенное их содержание в костной ткани позволяет с успехом использовать её в качестве стимулятора репаративной регенерации кости (Малахов O. A. и соавт., 2003; Самодай В. Г., 2008; Барабаш A. A., Барабаш А. П., Барабаш Ю. А., 2010). В клинической практике успешно применяется метод PRP (Platelet-rich Plasma). Это метод лечения различного вида заболеваний путем инъекционного введения аутологичной обогащенной тромбоцитарной плазмы выделенной из цельной крови пациента.
Такой пристальный интерес к факторам роста и аутоплазме, служащей источником для их получения, прежде всего, обусловлен тем, что в тромбоцитах содержатся многочисленные факторы роста и цитокины, способствующие регенерации поврежденных тканей. В альфа-гранулах тромбоцитов выявлено свыше 30 ростовых факторов, которые способны влиять на процессы восстановления всех тканей сустава одновременно: кости, хряща, связочного аппарата и мышц. Из них наиболее важное значение имеют: тромбоцитарный фактор роста (PDGF) — стимулирует хемотаксис, митогенез фибробластов, синтез коллагена; фактор роста эндотелия сосудов (PDEGF) — оказывает стимулирующее действие на эндотелиальные клетки; трансформирующий фактор роста (TGF-ß). Последний представляет собой большую группу белков, некоторые из них и морфогенные белки модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты, увеличивают синтез внеклеточного матрикса кости и ингибируют его деградацию и др. факторы роста.
Материалы и методы.
Работа выполнена в экспериментальной лаборатории ВГМА им. Н. Н. Бурденко на базе кафедры травматологии и ортопедии в период в 2013–2014 годах. В исследование включены 32 кролика домашних пород 4–5 месячного возраста. Распределение животных по сериям представлено в таблице 1.
В рамках проведённой экспериментальной работы было выполнено оперативное вмешательство у 5 групп кроликов. Во 4-х группах (опытная серия) оперативное вмешательство проводили с использованием пластины, аккумулирующей комплекс аутогенных лиофилизированых тромбоцитарных факторов роста (КАЛТФР).
1 группа — оценка остеогенеза на 7 сутки (4 кролика),
2 группа — на 14 сутки (4 кролика),
3 группа — на 21 сутки (4 кролика),
4 группа — на 28 сутки (4 кролика).
5 группа — контрольная (16 кроликов), содержащая подгруппы по 4 животных (соответственно по аналогичным срокам в опытных групп). Техника МОС идентичная для всех, за исключением отсутствия у контрольной группы КАЛТФР помещаемого в зоне перелома.
Таблица 1
Характеристика экспериментальных групп животных
|
Номер группы |
Характеристика группы |
Кол-во животных |
|
1 группа- экспериментальная |
Модель перелома бедра, накостный остеоситез пластиной с винтами с использованием КАЛТФР 7 сутки |
4 |
|
2 группа- экспериментальная |
Модель перелома бедра, накостный остеоситез пластиной с винтами с использованием КАЛТФР 14 сутки |
4 |
|
3 группа- экспериментальная |
Модель перелома бедра, накостным остеоситез пластиной с винтами с использованием КАЛТФР 21 сутки |
4 |
|
4 группа- экспериментальная |
Модель перелома бедра, накостный остеоситез пластиной с винтами с использованием КАЛТФР 28 сутки |
7 |
|
5 группа-сравнения |
Модель перелома бедра, накостный остеоситез пластиной с винтами |
16 |
Техника моделирования перелома бедра: под в/м наркозом раствором Золетила после обработки операционного поля спиртовым раствором хлоргексидина трехкратно по переднемедиальной поверхности бедра животным производили разрез кожи длиной 6 см. Мышцы разводили и фиксировали ранорасширителями. В области средней трети диафиза бедра выполняли остеотомию фрезой диаметром 1 мм. На поврежденную кость после репозиции укладывали модифицированную реконструктивную пластину, которую фиксировали 4–6 винтами. Модификация пластины заключалась в формировании на прилегающей к кости поверхности неполных отверстий для механического депонирования комплекса аутогенных лиофилизированых тромбоцитарных факторов роста. Рану послойно ушивали кетгутом, и закрывали асептической лейкопластырной повязкой «Круподерм» со спиртовой салфеткой. Послеоперационный период протекал гладко. Испытуемые в тот же день начинали есть. Инфекционных осложнений отмечено не было, все раны заживали первичным натяжением. Но, к сожалению, из-за активизации животных в условиях отсутствия иммобилизаци произошло 2 случая миграции металлоконструкции (6,25 %). После истечения обозначенных сроков выполняли УЗИ исследование, рентген-контроль, после чего животных повторно оперировали (может быть выводили из опыта?)
Рентгенологическое исследование оперированных конечностей животных выполняли на рентгенологическом аппарате РУМ-20 в режиме 44 mA 0.1 kB с экспозицией в 1 сек. Проводили сравнительный анализ рентгенографических данных на 7-е, 14-е, 21-е, 28-е сутки после металлоостеосинтеза. С помощью УЗИ исследования оценивали размеры костного регенерата, его форму, плотность структуры, состояние надкостницы, кортикальной пластины.
Выведение животных из эксперимента и забор материала осуществлялся на 7-е, 14-е, 21-е, 28-е сутки наблюдения. На аутопсии оценивали состояние окружающих мягких тканей, состояние надкостницы, кортикального слоя и костномозгового канала. Забор материала для гистологического исследования проводили путем тщательного сепарирования мышц от костей, выделения сегментов костей длиной 2,5–3 см с областью костного регенерата. Костный материал фиксировали в 10 % забуференном растворе цинк-формалина в течение трех суток, подвергали декальцинации в растворе «Трилон-В» в течение 3недель, обезвоживали в спиртах возрастающей концентрации и заливали в парафин. Срезы толщиной 4,0 мкм окрашивали гематоксилин-эозином, по Ван-Гизон. Микроскопическое исследование проводили на светооптическом микроскопе (Leica MDE, Германия) с применением увеличения х5, х10, х20.
Результаты и обсуждения.
Проведен сравнительный анализ лечения переломов костей традиционным способом и с применением КАЛТФР путем изучения рентгенологических снимков, УЗИ исследования, гистологической картины препаратов зон регенерации. В ходе проведенного экспериментального исследования выявлено значительное усиление интенсивности репаративного остеогенеза переломов исследуемых групп в сравнении с контрольными. На тех же сроках сращения определяется более выраженное формирование костной мозоли, что ярко представлено на рентгенограммах, особенно у группы исследуемых особей в сроках 21 и 28 день (Рис. 1).
На более ранних этапах формирования костной мозоли мы можем детально проследить ход формирования очагов окостенения в зоне перелома при помощи ультрозвукового исследования. При сравнении результатов, определяется выраженное усиление эхогенности соединительнотканных структур в параосальной зоне в испытуемой группе на сроке в 14 дней, что указывает на раннюю реструктуризацию (оссификацию) хрящевых тканей по сравнению с контрольной группой.
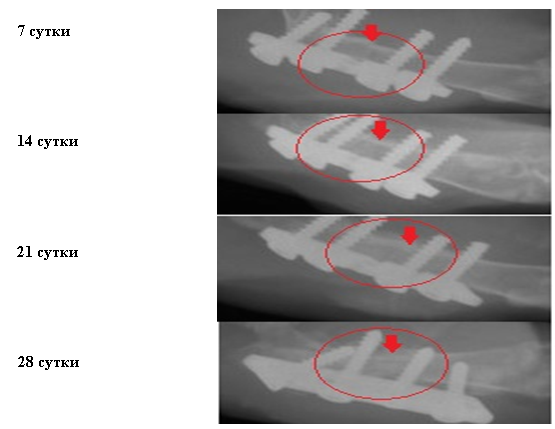
Рис. 1 Результаты рентгенографического исследования
Выводы.
Выполненное нами экспериментальное исследование доказывает результативность использования комплекса аутогенных тромбоцитарных факторов роста, как стимулятора процесса репаративного остеогенеза. Изложенные выше материалы разносторонних методов исследования указывают на значительное ускорение консолидации переломов, что послужило активирующим механизмом раннего остеогенеза, тем самым снижая сроки сращения переломов. Зная, что в КЛАТФР работает VEGF (Саблина Ю. А., Какпакова Е. С., Карамышева А. Ф.,2003), мы предполагаем, что ангиогенез, спровоцированный тромбоцитарными факторами послужил опорным механизмом позволившим организму восстановить нормальное кровоснабжение, что нивелирует послеоперационную травматизацию окружающих мягких тканей и надкостницы. Необходимо также подчеркнуть, что благодаря модифициорованой структуре пластин достигнуто направленное действий КЛАТФР, путем прицельного его помещения на надкостницу над зоной перелома, помимо этого, исключена миграция лиофилизата вместе с гематомой. При этом сохраняется высокая концентрация факторов роста, что стимулирует остеоиндукцию в требуемом для нас участке кости. Опираясь на результаты гистохимического исследования тканей области перелома, установлено ускорение роста и деления клеток хондроцитов и остеобластов.
Выполненное нами экспериментальное исследование позволяет констатировать, что использование аутогенных тромбоцитарных факторов роста может ускорить восстановление больных с переломами, снизив сроки заживления. Мы уверены, что предложенный нами метод хирургического лечения переломов актуален для внедрения в широкую практику и может быть использован на людях без каких-либо рисков, ввиду аутогенности биологического материала. А предложенная модификация металлоконструкций поможет снизить затратность ресурсов организма, т. к. для производства КАЛТФР лечения требуется значительно меньший аутозабор крови, по сравнению с ранее известными методами по использованию аутоплазмы крови человека.
Литература:
1. Болезнь Пертеса. Эндотелий сосудов тазобедренного сустава при электронно-микроскопическом исследовании. // Оптимальные технологии диагностики и лечения в детской травматологии и ортопедии, ошибки и осложнения. — Материалы симпозиума детских травматологов-ортопедов России. — Волгоград, 17–19 сентября 2003г. — с. 295–296 — соавт. Малахов О. А., Чучков В. М..
2. Кроветворная функция костного мозга и ее связь с активностью остеогенеза при репаративной регенерации в условиях удлинения голени у собак / Г. А. Илизаров [и др.] // Онтогенез. — 1984. — Т. 15, № 2.
3. Виноградова Т. П. К вопросу о механизмах рассасывания костного вещества. Организация травматологической и ортопедической помощи / Т. П. Виноградова // Пластическая хирургия. — М., 1959. — С. 285–292.
4. Виноградова Т. П. Пересадка хряща у человека / Т. П. Виноградова. — М., 1950.
5. Виноградова Т. П. Регенерация и пересадка костей / Т. П. Виноградова, Г. И. Лаврищева. — М.: Медицина, 1974.
6. Безуглов Э. Н., Глущенко А. Л., Ачкасов Е. Е., Ярдошвили А. Э., Каркищенко Н. Н. Первый опыт применения тромбоцитарных факторов роста при лечении повреждений опорно-двигательного аппарата спортсменов высокой квалификации.
7. Саблина Ю. А., Какпакова Е. С., Карамышева А. Ф. Регуляция экспрессии гена фактора роста эндотелия сосудов VEGF-C -межклеточными взаимодействиями // Цитология.- 2003.- Т.45, № 9.- С.921–922.
8. Самодай В. Г., Брехов В. Л., Гайдуков В. Е. / Использование факторов роста тромбоцитов для стимуляции репаративного остеогенеза — 7-ая Международная конференция «Высокие медицинские технологии XXI века», Испания, Бенидорм.
9. Ekstrand J. Soccer injuries and their prevention.// Linkoping University Medical Dissertations.1982.- N.130.
10. Kasemkijwattana C., Menetrey J., Bosch P., Somogyi G., Moreland M., Fu F., Buranapanitkit B., Watkins S., Huard J., Use of growth factors to improve muscle healing after strain Injury//. Clin Orthop Relat Res.2000.- P.272–285.
11. Kon E., Filardo G., Di Martino M., Marcacci M. Platelet-rich plasma (PRP) to treat sports injuries:evidence to support its use Knee// Surg Sports Traumatol Arthrosc.2007/-N.10.- DOI 10.1007/s00167–010–1306-y
12. Langer H. (2010) Platelets in regeneration.// Semin Thromb Hemost.2010.- N. 36.-P.175–184.
13. Molloy T., Wang Y., Murrell G. (2003) The roles of growth factors in tendon and ligament healing// Sports Med.2003.- N. 33.-P.381–394.
14. Nagumo A., Yasuda K., Numazaki H., Azuma H., Tanabe Y.,Kikuchi S., Harata S., Tohyama H. Effects of separate application of three growth factors (TGF-beta1, EGF, and PDGF-BB) on mechanical properties of the in situ frozenthawed anterior cruciate ligament// Clin Biomech.2005.-N. 20.- P.283–290
15. P. Renstrom. Persistently painful sprained ancle// J Am Acad Orthop Surg. 1994.-N.2.-P.270.15. Sampson S., Gerhardt M., Mandelbaum B. Platelet rich plasma injection grafts for musculoskeletal injuries// A review. Curr Rev Musculoskelet Med.2008.- N. 1-P.-165–174.
16. Stellos K., Kopf S., Paul A., Marquardt J., Gawaz M., Huard J.,Foster T., Puskas B., Mandelbaum B., Gerhardt M., Rodeo S. Platelet-rich plasma: from basic science to clinical applications// Am J Sports Med.2009.- N.-37.- P.-59–72.

