Повышение ПОЛ при отравлении гелиотрином и ССl4 может служить фактором, дестабилизирующим митохондриальные, цитоплазматические, лизосомальные и другие клеточные мембраны (И. Г. Савин с соав. 1981).
Первым доказательством нарушения целостности мембран цитоплазмы при интоксикации ксенобиотиками, было повышение в сыворотке крови активности ферментов цитоплазмы (Ф-1–6 ФА, ЛДГ, АЛаТ, АСаТ).
Повышение проницаемости цитоплазматических мембран приводит к нарушению, в первую очередь, углеводного обмена и переаминированию аминокислот, ибо гликолиз и обеспечение его отдельными субстратами осуществляется ферментами цитозоля.
Углеводы имеют исключительно важное значение как энергетический материал, для синтеза различных фосфорсодержащих макроэргических соединений, обеспечивающих процессы биосинтеза всех компонентов клеток и нуклеиновых кислот. Обмен углеводов теснейшим образом переплетается с обменом нуклеиновых кислот, белков и жиров. При интоксикации гепатотропными ксенобиотиками ингибируются процессы синтеза глюкозы и ее эфиров из молочной и пировиноградной кислот [1, 2].
Для покрытия потребностей организма в энергии (АТФ) при нарушении гликолиза в процесс включается гексозомонофосфатный путь, т. е. прямое окисление глюкозы (пентозофосфатный путь).
Один из промежуточных продуктов пентозного пути фруктозо-6-фосфат под действием печеночно-специфического фермента фруктозо-1-фосфат альдолазы (Ф-1-ФА, КФ. 4.1.2.7) включается в гликолиз. При обеднении печени гликогеном процессе гликолиза может поддерживаться за счет превращения фруктозо-1-фосфата. Поэтому активности этих ферментов придается большое значение при изучении углеводного обмена [3]. Рядом авторов отмечено, что степень повышения активности фермента находилась в непосредственной зависимости от течения патологического процесса и от тяжести отравления ксенобиотиками экспериментальных животных.
В связи с этим для определения степени проницаемости мембран клеток и состояния углеводного обмена нами была изучена активность Ф-1-ФА в сыворотке крови, цитозоле печени, тимусе и селезенке. Результаты этих исследовании представлены в таблице 1.
Таблица 1
Показатели активности Ф-1-ФА (Е/ч ткани влиян.) ворганах крыс, получавших гепатотропные ксенобиотики (M+m) n=8–10
|
Исследуемые органы |
Контроль |
Дни исследования | |
|
50-й |
70-й | ||
|
Печень |
86,5±4,3 |
46,6±1,8* 30,5±0,9 |
46,8±2,04* 22,5±1,3 |
|
Сыворотка крови |
58,8±2,94 |
296±9,6* 500,1±51,6* |
145,0±9,7* 430,0±45,0* |
Примечание: в числителе показатели активности фермента крыс, получавших ССl4, в знаменателе гелиотрин. *р <0,05–0,001 рассчитано сравнительно с контролем.
Как видно из таблицы при введении ксенобиотиков у экспериментальных животных наблюдается понижение активности Ф-1-ФА в исследуемых органах и значительное повышение в сыворотке крови. Идентичные изменения наблюдаются и на 70-й день опыта. Так в печени крыс получавших ССl4 на 50-й день активность данного фермента понижается в 1,84 раза, а на 70-й день в 1,86 раза в тимусе в 1,56 раза и в 1,86 раза, в селезенке в 1,27 раза и в 1,1 раза соответственно. А сыворотке крови активность данного фермента увеличивается на 50-й день в 5 раз, а на 70-й день в 2,5 раза.
В процессе интоксикации гелиотрином эти показатели более яркие. Так в печени крыс на 50-й день активность Ф-1-ФА в печени понижается в 2,83 раза, а на 70-й день в 3,84 раза, в тимусе в 1,44 и в 2,6 раза, а в селезенке в 1,97 и в 2,2 раза соответственно. В сыворотке крови активность данного фермента повышалась в 8,5 раза на 50-й день и в 7,3 раза на 70-й день.
Анализ результатов исследования активности Ф-1-ФА в органах экспериментальных животных показал, что на 50-й и 70-й день опыта активность фермента падает во всех исследуемых органах, и они более выражены в печени и тимусе крыс, получавших гелиотрин.
Следующий, весьма важный для организма путь превращения углеводов — это путь превращения триоз (пировиноградной и молочной кислот). Обратимое превращение молочной кислоты в пировиноградную (ПВК) катализируется лактатдегидрогеназой (ЛДГ)- лактат; НАД оксидоредуктазой (КФ.1.1.1.27). Необходимо отметить, что в ПВК кроме глюкозы может превращаться и в ряд аминокислот (ала, цис, тре и т. д.), а также глицерин. Следовательно, этот фермент занимает ключевое место в цепи обмена веществ.
Результаты исследований различных авторов свидетельствуют о том, что при интоксикации гепатотропными ксенобиотиками (CCl4, тиоацетамид, гелиотрин и др.) происходит накопление в печени ПВК и молочной кислоты, повышение активности лактатдегидрогеназы в сыворотке крови и снижение ее уровня в ткани печени [3]. Однако, при интоксикации крыс гелиотрином и CCl4 исследование активности ключевых ферментов углеводного обмена в иммунокомпетентных органах не проводилось. Имеются лишь отдельные сообщения об изучении активности некоторых ферментов, катализирующих реакции, относящиеся к различным видам и этапам обмена веществ в гепатоцитах. Недостаточно работ о взаимосвязи органов и напряженностью иммунных реакций. В единичных работах изучены изменения в печени и иммунокомпетентных органах при интоксикации гепатотропными ксенобиотиками [4,5,6,7].
В связи с вышеизложенным, нами изучены ключевые ферменты гликолиза и глюконеогенеза. С целью установления состояния мембран цитоплазмы и митохондрий исследовали активность митохондриальной аэробной фракции ЛДГ1–2 и цитоплазматической ЛДГ4–5, где инкубационная смесь содержала 10 мл 0,5 м раствора фосфатного буфера рН-7,0; 0,8 мл 0,5 м раствора лактата натрия рН-7,4; 0,8 мл 2· 10–2 м НАД фирмы “Reanal”. Мышечную анаэробную фракцию ЛДГ исследовали в инкубационной смеси, которая содержала 10 мл 0,1м, трис-HCl буферной смеси рН-7,5 фирмы “Reanal” 0,8 мл 2· 10–2 м НАДН, 0,8 мл пируват натрия 1,92 мМ.
Результаты этих исследований представлены на рисунке 1.
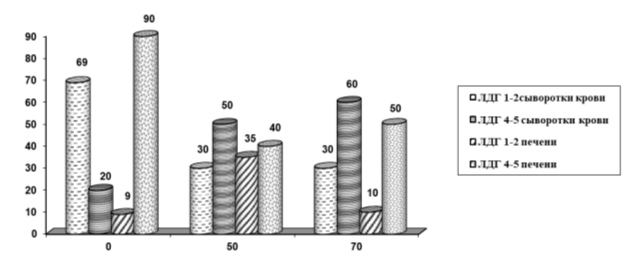
Рис. 1. Изменение фракций ЛДГ в динамике отравления ССl4
Так при интоксикации ССl4 в крови наблюдается повышение аэробной фракции ЛДГ4–5 в 2,5 раза на 50-й день и в 3 раза на 70-й день, параллельно в крови наблюдается понижение анаэробной фракции ЛДГ1–2 в 2,3 раза.
В печени ЛДГ4–5 на 50-й день понижается в 2,25 раза, а на 70-й день в 1,8 раза. А фракция ЛДГ1–2 повышается в 3,9 раза на 50-й день, но на 70-й день эти показатели восстанавливаются и почти достигают нормы.
Анализ динамики изменения активности ЛДГ у отдельных групп животных получавших CCl4 и гелиотрин выявил определенные закономерности, имеющие значение в понимании механизма развития патологического процесса и их взаимосвязи со структурой и функцией ФЛ и гликолипидов.
У животных получавших гелиотрин (рис. 2) наиболее высокая активность ЛДГ4–5 в сыворотке крови (в 3,3–3,7 раза) выявлена на 50-й и на 70-й день опыта. В печени на протяжении всего опыта активность ЛДГ4–5 понижена (в 1,6- 1,78 раза) по сравнению с контролем.
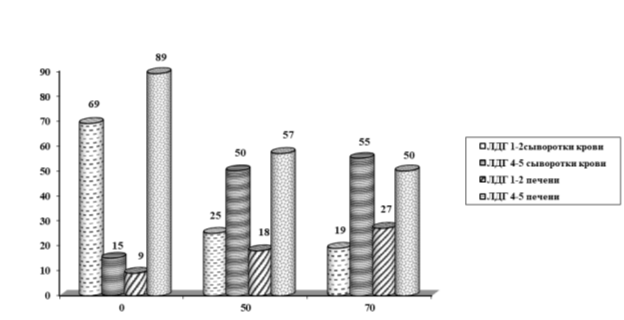
Рис. 2. Изменение фракций ЛДГ в динамике отравления гелиотрином
На 50-й и 70-й день в сыворотке крови в 2,8–3,6 раза снижается уровень аэробных фракций ЛДГ1–2 — фермента. В ткани печени их содержание понижается в 2–3 раза. Указанные сдвиги, видимо, являются следствием повреждения мембран цитоплазмы и митохондрий гепатоцитов за счет структурных и функциональных изменений их ФЛ и ГЛ компонентов, приводящих в дальнейшем к выходу ферментов из митохондрий в цитоплазму и сыворотку крови.
Повышение доли анаэробной фракции в сыворотке крови и снижение в ткани печени связано с увеличением проницаемости мембран цитоплазмы с последующим нарушением глюконеогенеза из молочной кислоты. Снижение доли аэробной фракции ЛДГ1–2 в сыворотке крови и увеличение в ткани печени можно рассматривать как обстоятельство, способствующее смешению равновесия в сторону образования пирувата, из молочной кислоты. Повышение содержания ЛДГ1–2 в печени за счет снижения ЛДГ4–5 вполне согласуется с необходимостью более интенсивного вовлечения ПВК в цикл трикарбоновых кислот для покрытия потребности организма в АТФ.
В результате изучения характера изменений ЛДГ в сыворотке крови, ткани печени, установлена тесная взаимосвязь между активностью ЛДГ в сыворотке крови и в ткани печени, а также между ЛДГ1–2 и ЛДГ 4–5.
Определение их активностей имеет важное значение в решении кардинальных вопросов метаболизма углеводов и общебиологической проблемы — проблемы гипоксии в процессе интоксикации ксенобиотиками.
Все изложенное по определению активности ключевых ферментов гликолиза — Ф-1-ФА, ЛДГ1–2, ЛДГ4–5 в сыворотке крови довольно специфично отражает биохимические изменения, происходящие в цитоплазме гепатоцитов экспериментальных животных. В ранний период болезни значительно повышается активность фермента в сыворотке крови, тогда как в цитозоле уровень их понижается. В отдаленные сроки исследования наблюдается обратная картина у крыс, получавших CCl4, а у крыс, получавших гелиотрин, эти показатели остаются почти жизненными.
Таким образом, факт последовательного повышения активности ферментов цитоплазмы в сыворотке крови экспериментальных животных с одновременным снижением их уровня в печени позволяет предположить, что нарушение ферментативных реакции в клетках происходит по этапу: вначале эти процессы более выражены в цитоплазме (Ф-1-ФА, ЛДГ4–5), а затем распространяется и на другие ультраструктуры клетки, например, митохондрии (ЛДГ1–2).
Изучение активности Ф-1-ФА и ЛДГ показало, что при интоксикации крыс гепатотропными ксенобиотиками указанные гликолитические ферменты претерпевают значительные изменения и приводят к нарушению углеводного и энергетического обмена, нарушению метаболизма и структурно-функционального состояния мембран. Главным фактором, определяющим структурную организацию и функциональное состояние мембран, является их фосфолипидный состав.
Известно, что каждая фракция ФЛ входящая в состав биологических мембран, выполняет определенную функцию: способствует связыванию и транспортировке ионов, определяет активность мембраносвязанных ферментов, играет важную роль в сопряжении электронотранспортных процессов, активации лизосомальных ферментов и т. д. [7,8,9,10].
Результаты исследования состава ФЛ в печени, тимусе и селезенке крыс при введении гепатотропных ксенобиотиков, показали существенные сдвиги в их количественном содержании.
В связи с этим изучение состава ФЛ основного компонента мембран клеток представляет значение для раскрытия механизма действия гепатотропных ксенобиотиков, чему посвящены наши следующие исследования.
Литература:
- Исмагилова Е. Ю. Влияние различной обеспеченности крыс витамином Е и полиненасышенными жирными кислотами на антителообразуюшую функцию спленоцитов. //Матер. Ш. Всесоюзн.конф. — М.: — 1989. — Т. 2. — С.42–43.
- Селютина С. Н., Селютин А. Ю., Паль А. И. Модификация определения концентраций ТБК — активных продуктов сыворотки крови. //Ж. Клиническая и лабораторная диагностика. — 2000, № 2. — С.8.
- Сомова О. П. и др Ганглиозиды /GД3/ в сыворотке крови раковых больных.//Ж. Вопр. мед. химии. — 1991. — № 2 (37). — с.21–23.
- Турсунов Э. О. Ут йулларининг токсик гепатитлардаги морфологик узгаришлари. //Ж.Узб. тиб. журн. — 1999, № 5. — С.110.
- Тухтаева Н. К. Сурункали гелиотринли гепатитда иммуномодулиннинг иммун система аъзоларининг морфологиясига таъсири. //Ж.Узб. тиб. журн. — 1997 № V. — С.76–78.
- Успарвова Ж. К., Мурзахметова М. К., Азимуратова Р. Ж. Транспортные и рецепторные функции биологических мембран. Биологические мембраны и использование принципов их функционирования в практике. //Ж.Изв.Ан Каз.ССР серия биологии. — 1988. — № 6. — С.87–89.
- Хмельницкий О. К., Зайчик А. Ш., Зубжицкий Ю. Н. Эндокринная система и иммунитет. //7-й Всесоюзн.съезд патологоанатомов: Тез.докл. — Ташкент, 1993. — С.47–49.
- Алматов К. Т., Мирталипов Д. Т., Касымова Г. М., Абидов А. Изменение фосфолипидного состава и окислительного фосфорилирования в митохондриях при гепатите /Вопр. мед. химии. — 1986. Т. 32. — № 3. — С.27–30.
- Владимиров Ю. А., Арчаков А. И. Перекисное окисление липидов в биологических мембранах /М.: Изд-во Наука. — 1972. — С.43.
- Джанджагава Г. Г., Шакаришвилли Р. Р. Влияние α-токоферола и селена на активность антиоксидантных ферментов и содержание продуктов перекисного окисления липидов в эритроцитах больных ишемической болезнью мозга //Ж.Вопр. мед. химии. — 1991. — № 5. — С.79–81.
- Акиншина Н. Г., Гутникова А. Р. Действие пиретроидного препарата «Bulldock» на функциональное состояние митохондрий печени крыс // Материалы междунар. конф. «Митохондрии, клетки и активные формы кислорода.-Пущино, 6–9 июня, 2000.-Пущино 2000.
- Ваградян А. Г. Обогащенный пролином пептид (галармин)нейропротекторный модулятор окислительного повреждения при хронической алюминиевой интоксикации // Нейрохимия.-2003.-20, № 2.-С.139–142.
- B. А. Система глутатиона как перспективное направление изучения цитотоксических эффектов действия ксенобиотиков // 2 съезд токсикологов России, Москва 10–13 нояб., 2003: Тез. докл.-М., 2003.-С. 77–78.

