В статье рассмотрена кинетика процесса сернокислотного автоклавного выщелачивания в раствор золота, цинка, меди, свинца, железа и марганца в присутствии MnO2. Определена зависимость и оптимальная продолжительность процесса выщелачивания для каждого элемента.
Для исследований были использованы упорные золотосодержащие руды территории Жартас, «упорность» которых связана с наличием углистых, глинисто-шламистых [1] и тонкозернистых частиц; ассоциациями тонкодисперсного золота с сульфидами и оксидами металлов. Эти особенности руд затрудняют извлечение из них золота.
Ранее в работе [2] были проведены исследования по предварительному (до гравитационного обогащения) безавтоклавному вскрытию руд серной кислотой в присутствии пиролюзита. Результаты этих исследований позволили извлечь золото в гравиоконцентрат до 75 %. В гравиоконцентрат извлекается свободное золото, а тонкодисперсное золото, ассоциированное с минералами, остается в хвостах гравитации.
В целях разработки уменьшения капитальных затрат на переработку золотосодержащих руд нами были проведены исследования по прямому их безавтоклавному выщелачиванию [3]. Результаты этих исследований показали эффективность способа сернокислотного выщелачивания при использовании окислителей.
Для повышения степени извлечения золота и сопутствующих металлов из этих руд нами был выбран способ автоклавного сернокислотного выщелачивания руд в присутствии пиролюзита, представленного в исследуемых рудах высоким содержанием.
Известные работы по автоклавному сернокислотному выщелачиванию моносульфидов (пирита, халькозина, халькопирита, борнита и сфалерита) проведены в присутствии кислорода [4, 5].
Отличием наших исследований является изучение процесса автоклавного сернокислотного выщелачивания упорных золотосодержащих руд в присутствии пиролюзита.
В данной работе представлены результаты изучения процесса окислительного выщелачивания Au, Zn, Cu, Pb, Fe и Mn из упорных золотосодержащих руд коры выветривания территории Жартас в серной кислоте в присутствии диоксида марганца (MnO2) в зависимости от продолжительности.
Химический состав упорных золотосодержащих руд коры выветривания территории Жартас был следующим: Au–1,22 г/т; Zn–0,41 %; Cu–0,03 %; Pb–0,095 %; Fe–1,12 %; Mn–0,06 %.
В экспериментах продолжительность составляла – 1, 2, 3, 4, 5 часов при постоянных значениях: t=130 0С, концентрация H2SO4 – 50 %, MnO2 – 50 % от массы руды, Ж:Т=8:1, навеска руды – 50 г.
Результаты химического анализа Au, Zn, Cu, Pb, Fe и Mn в продуктах от окислительного выщелачивания руд приведены в таблице 1.
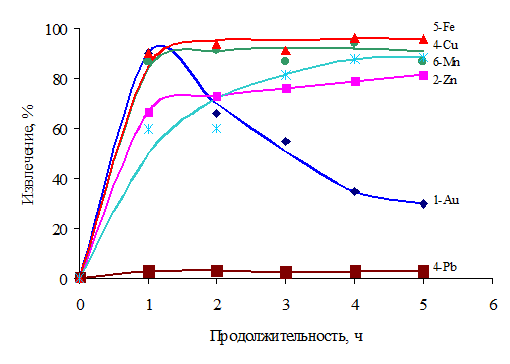
Зависимость степени и скорости извлечения Au, Zn, Cu, Pb, Fe и Mn из руд в продукты представлены в таблицах 2 и 3 и на рисунке 1.
По данным таблиц 2-3 и рисунка 1 видно, что извлечение золота в раствор резко увеличивается до 90,01 % при увеличении продолжительности процесса до 1 часа, затем резко понижается в промежутке от 1 до 5-ти часов. Последнее связано с образованием комплексных соединений золота – гидросульфатов золота (H[Au(SO4)2], H[Au(SO4)]), что было подтверждено результатами рентгеноспектрального анализа. Степень извлечения цинка с увеличением продолжительности процесса до 2 часов поднимается до 72,9 %. Степень извлечения меди в раствор высока и максимальна 93,93 % при 4 часах продолжительности процесса. Свинец характеризуются низкими значениями 3,46-2,58%, так как, в основном концентрируется в кеке, что связано с образованием нерастворимой соли – сульфата свинца. Степень извлечения железа в раствор достаточно высока и находится в диапазоне 90,11-96,04 %. Степень извлечения марганца с увеличением продолжительности процесса до 3 часов резко поднимается до 81,57 % Mn, а далее отмечается незначительное увеличение 88,59%.
Кинетика процесса автоклавного выщелачивания Au, Zn, Cu, Pb, Fe и Mn в серной кислоте в присутствии окислителя – MnO2 из упорных золотосодержащих руд коры выветривания
Значения скорости извлечения Au, Zn, Cu, Pb, Fe и Mn (при постоянной навеске руды, равной 100 г) в раствор в зависимости от продолжительности процесса (при постоянных условиях: t = 130 0С, концентрация H2SO4 –50 %, MnO2 – 50 г, Ж:Т=8:1) приведены в таблице 3.
Рис.1 – Извлечения золота, цинка, меди, свинца, железа и марганца из предварительно обработанных упорных золотосодержащих руд коры выветривания в раствор в зависимости от продолжительности процесса автоклавного выщелачивания (const: t=130 0С, концентрация H2SO4 – 50 %, MnO2 – 50 % от массы руды, Ж:Т=8:1, навеска руды – 50 г)
Из данных таблицы 3 видно, что абсолютные значения скорости процесса для золота высокие, а цинк характеризуется низкими значениями. Самые высокие абсолютные значения скорости процесса характерны для марганца, затем для железа. Максимальная скорость процесса извлечения золота, цинка, меди, железа и марганца из руды в раствор достигается при продолжительности процесса 1 час или 3600 с, при продолжительности более, чем 1 час, наблюдается снижение скорости процесса, что свидетельствует о наличии диффузионных факторов.
Для определения лимитирующей стадии процессов растворения и окисления золота, цинка, меди, свинца, железа и марганца в серной кислоте в присутствии диоксида марганца результаты экспериментальных данных по зависимостям степени извлечения металлов из руд в раствор от продолжительности процесса при определенном расходе диоксида марганца (50 % от массы руды) обработаны нами в программе «Excel» по уравнениям формальной кинетики (таблица 4).
Таблица 1
Результаты химического анализа Au, Zn, Cu, Pb, Fe и Mn в продуктах автоклавного сернокислотного выщелачивания кеков при определении зависимости их извлечения от продолжительности процесса (const: t=130 0С, H2SO4 – 50 %, MnO2 – 50 % от массы руды, Ж:Т=8:1, навеска кека – 50 г)
|
Проба |
τ, час |
Масса кека, г
|
Объем продуктивного раствора, дм3 |
Результаты определения | |||||||||||
|
Au в кеке, г/т |
Au в р-ре, мг/дм3 |
Zn в кеке, % |
Zn в р-ре, мг/дм3 |
Cu в кеке, % |
Cu в р-ре, мг/дм3 |
Pb в кеке, % |
Pb в р-ре, мг/дм3 |
Fe в кеке, % |
Fe в р-ре, г/дм3 |
Mn в кеке, % |
Mn в р-ре, г/дм3 | ||||
|
35 |
1 ч |
49,95 |
0,55 |
0,11 |
0,0998 |
0,124 |
248,61 |
0,0036 |
23,67 |
0,093 |
2,60 |
0,088 |
0,92 |
19,46 |
27,07 |
|
36 |
2 ч |
27,5 |
0,55 |
0,75 |
0,073 |
0,187 |
271,72 |
0,0036 |
24,87 |
0,169 |
2,74 |
0,094 |
0,95 |
33,98 |
27,36 |
|
37 |
3 ч |
50,31 |
0,55 |
0,53 |
0,061 |
0,087 |
283,27 |
0,0032 |
23,61 |
0,093 |
2,25 |
0,084 |
0,93 |
8,16 |
37,12 |
|
38 |
4 ч |
21,78 |
0,575 |
1,77 |
0,037 |
0,173 |
284,33 |
0,0030 |
24,50 |
0,214 |
2,41 |
0,054 |
0,93 |
12,53 |
31,19 |
|
39 |
5 ч. |
20,75 |
0,56 |
1,99 |
0,033 |
0,165 |
297,65 |
0,0029 |
25,07 |
0,223 |
2,97 |
0,054 |
0,96 |
12,50 |
39,60 |
Таблица 2
Извлечения Au, Zn, Cu, Pb, Fe и Mn из кеков от безавтоклавного сернокислотного выщелачивания руд в продукты в зависимости от продолжительности процесса (const: t=130 0С, H2SO4 – 50 %, MnO2 – 25 г, Ж:Т=8:1, навеска кека – 50 г)
|
Проба |
τ, час |
Масса кека, г
|
Объем продуктивного раствора, дм3 |
Степень извлечения, % | |||||||||||
|
Au |
Zn |
Cu |
Pb |
Fe |
Mn | ||||||||||
|
в кек |
в раст-вор |
в кек |
в раст-вор |
в кек |
в раствор |
в кек |
в раствор |
в кек |
в раствор |
в кек |
в раст-вор | ||||
|
35 |
1 ч |
49,95 |
0,55 |
9,09 |
90,01 |
30,26 |
66,70 |
11,98 |
86,80 |
97,02 |
2,98 |
7,89 |
90,11 |
38,84 |
59,49 |
|
36 |
2 ч |
27,5 |
0,55 |
33,91 |
65,80 |
25,06 |
72,90 |
6,65 |
91,21 |
96,86 |
3,14 |
4,63 |
93,79 |
37,33 |
60,12 |
|
37 |
3 ч |
50,31 |
0,55 |
43,33 |
54,80 |
21,45 |
76,00 |
10,88 |
86,58 |
97,42 |
2,58 |
7,57 |
91,40 |
16,40 |
81,57 |
|
38 |
4 ч |
21,78 |
0,575 |
63,19 |
34,80 |
18,38 |
78,91 |
4,38 |
93,93 |
97,11 |
2,89 |
2,12 |
96,04 |
10,90 |
87,73 |
|
39 |
5 ч. |
20,75 |
0,56 |
67,97 |
29,95 |
16,71 |
81,31 |
3,98 |
93,58 |
96,54 |
3,46 |
2,02 |
95,87 |
10,36 |
88,59 |
Таблица 3
Степень и скорость извлечения Au, Zn, Cu, Pb, Fe и Mn в раствор из руды в зависимости от продолжительности процесса автоклавного выщелачивания кеков при следующих постоянных условиях: t – 130 0С, концентрация H2SO4 – 50 %, MnO2 – 25 г, Ж:Т=8:1 (навеска кека – 100 г)
|
Продолжи-тельность |
Масса |
Cтепень
металла в раствор, |
Скорость
металла в раствор, |
|
Au | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
3,150 |
90,01 |
12,351 |
|
7,2 |
2,303 |
65,8 |
4,515 |
|
10,8 |
1,918 |
54,8 |
2,507 |
|
14,4 |
1,218 |
34,8 |
1,194 |
|
18 |
1,048 |
29,95 |
0,822 |
|
Zn | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
0,507 |
66,7 |
1,987 |
|
7,2 |
0,554 |
72,9 |
1,086 |
|
10,8 |
0,578 |
76 |
0,755 |
|
14,4 |
0,600 |
78,91 |
0,588 |
|
18 |
0,618 |
81,31 |
0,485 |
|
Cu | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
0,0599 |
86,8 |
0,235 |
|
7,2 |
0,0629 |
91,21 |
0,123 |
|
10,8 |
0,0597 |
86,58 |
0,078 |
|
14,4 |
0,0648 |
93,93 |
0,064 |
|
18 |
0,0646 |
93,58 |
0,051 |
|
Pb | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
0,00292 |
2,98 |
0,011 |
|
7,2 |
0,00308 |
3,14 |
0,006 |
|
10,8 |
0,00253 |
2,58 |
0,003 |
|
14,4 |
0,00283 |
2,89 |
0,003 |
|
18 |
0,00339 |
3,46 |
0,003 |
|
Fe | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
3,109 |
90,11 |
12,188 |
|
7,2 |
3,236 |
93,79 |
6,343 |
|
10,8 |
3,153 |
91,4 |
4,121 |
|
14,4 |
3,313 |
96,04 |
3,248 |
|
18 |
3,308 |
95,87 |
2,594 |
|
Mn | |||
|
0 |
0 |
0 |
0 |
|
3,6 |
29,818 |
59,49 |
116,904 |
|
7,2 |
30,133 |
60,12 |
59,071 |
|
10,8 |
40,885 |
81,57 |
53,431 |
|
14,4 |
43,972 |
87,73 |
43,100 |
|
18 |
44,403 |
88,59 |
34,818 |
|
| |||
Результаты математической обработки по уравнениям формальной кинетики приведены в таблице 5.
Таблица 4
Уравнения формальной кинетики
|
№ уравнения |
Вид уравнения |
Вид преобразованного уравнения |
Название уравнения |
|
1 |
α=aebτ |
y=aebx, где y= α, x=τ |
уравнение 1-го порядка |
|
2 |
α=aτb |
y=axb, где y= α, x=τ |
уравнение 1-го порядка |
|
3 |
α=aτ+b |
y=ax+b, где y= α, x=τ |
уравнение 1-го порядка |
|
4 |
1–(1–α)1/3=aτ+b |
y=ax+b, где y= 1–(1–α)1/3, x=τ |
уравнение Яндера |
|
5 |
1–(1–α)1/3=aτ1/2+b |
y=ax+b, где y= [1–(1–α)1/3], x= τ1/2 |
уравнение Рогинского |
|
6 |
ln[1/(1–α)]=aτ+b |
y=ax+b, где y= ln[1/(1–α)], x= τ |
уравнение |
|
7 |
α/(1–α)=aτ+b |
y=ax+b, где y= [α/(1–α)], x= τ |
уравнение |
|
8 |
1–(2α/3)–(1–α)2/3=aτ+b |
y=ax+b, где y= [1–(2α/3)–(1–α)2/3], x= τ |
уравнение
Кранка- |
Таблица 5
Значения коэффициентов уравнений и корреляции для зависимости степени извлечения Au, Zn, Cu, Pb, Fe и Mn из руд в раствор от продолжительности процесса при следующих постоянных условиях автоклавного выщелачивания предварительно обработанных руд при const: t – 130 0С, концентрация H2SO4 – 50 %, MnO2 – 50 % от массы руды, Ж:Т=8:1 (навеска руды – 50 г)
|
№ уравнения |
Au |
Zn |
Cu | ||||||
|
a |
b |
R2 |
a |
b |
R2 |
a |
b |
R2 | |
|
1 |
0,0001 |
0,2058 |
0,51 |
0,00004 |
0,3076 |
0,5882 |
0,00004 |
0,4073 |
0,4889 |
|
2 |
0,0001 |
0,2058 |
0,51 |
0,00004 |
0,3076 |
0,5882 |
0,00004 |
0,4073 |
0,4889 |
|
3 |
0,0001 |
0,2058 |
0,51 |
0,00004 |
0,3076 |
0,5882 |
0,00004 |
0,4073 |
0,4889 |
|
4 |
0,00004 |
0,7353 |
0,51 |
0,00001 |
0,7692 |
0,5882 |
0,00001 |
0,8024 |
0,4889 |
|
5 |
0,0069 |
0,6771 |
0,8948 |
0,0063 |
0,6725 |
0,9778 |
0,006 |
0,6726 |
0,9734 |
|
6 |
0,0002 |
0,6193 |
0,3287 |
0,00008 |
0,4721 |
0,7476 |
0,0001 |
0,8852 |
0,6485 |
|
7 |
0,0003 |
2,7115 |
0,2229 |
0,0002 |
0,6983 |
0,9125 |
0,0008 |
2,0768 |
0,7769 |
|
8 |
- 0,00002 |
0,5953 |
0,4117 |
-0,00001 |
0,6015 |
0,7269 |
-0,00001 |
0,5508 |
0,5449 |
Продолжение таблицы 5
|
№ урав-нения |
Pb |
Fe |
Mn | ||||||
|
a |
b |
R2 |
a |
b |
R2 |
a |
b |
R2 | |
|
1 |
0,000001 |
0,0133 |
0,4862 |
0,00004 |
0,4253 |
0,4787 |
0,00004 |
0,2369 |
0,7691 |
|
2 |
0,000001 |
0,0133 |
0,4862 |
0,00004 |
0,4253 |
0,4787 |
0,00004 |
0,2369 |
0,7691 |
|
3 |
0,000001 |
0,0133 |
0,4862 |
0,00004 |
0,4253 |
0,4787 |
0,00004 |
0,2369 |
0,7691 |
|
4 |
0,0000004 |
0,6711 |
0,4862 |
0,00001 |
0,8084 |
0,4787 |
0,00001 |
0,7456 |
0,7691 |
|
5 |
0,00007 |
0,6688 |
0,7319 |
0,0063 |
0,6725 |
0,9778 |
0,0022 |
0,6896 |
0,9452 |
|
6 |
0,000001 |
0,0135 |
0,487 |
0,0001 |
1,0159 |
0,6695 |
0,0001 |
0,2108 |
0,9334 |
|
7 |
0,000001 |
0,0137 |
0,4877 |
0,0012 |
2,5027 |
0,8346 |
0,0005 |
0,4795 |
0,9417 |
|
8 |
-0,00000001 |
0,6665 |
0,5093 |
-0,00001 |
0,5402 |
0,5273 |
-0,00001 |
0,634 |
0,9092 |
Из таблицы 5 видно, что при температуре процесса 130 0С, концентрация H2SO4 – 50 %, MnO2 – 50 % от массы руды, Ж:Т=8:1 коэффициент корреляции имеет высокие значения для зависимости степени извлечения металлов из руд в раствор от продолжительности процесса по уравнению Рогинского:
1–(1–α)1/3=aτ1/2+b или y=ax+b,
где y= [1–(1–α)1/3], x= τ1/2.
Из таблицы 5 видно, что при температуре процесса 130 0С, концентрации H2SO4 – 50 %, MnO2 – 25 г, Ж:Т=8:1 коэффициент корреляции имеет высокие значения для зависимости степени извлечения Fe и Mn из руд в раствор в зависимости от продолжительности процесса по уравнению Рогинского.
Следовательно, извлечение золота, цинка, меди, свинца, железа и марганца из исследуемого материала является гетерогенным процессом, протекающим в диффузионной области на границе раздела фаз: «твердое – жидкость» и скорость протекания данного процесса лимитируется толщиной образующегося продукта в процессе окислительного выщелачивания, при этом скорость процесса извлечения данных металлов из руд в раствор обратно пропорциональна толщине образующегося продукта реакции, через который диффундирует реагирующее вещество.
Таким образом, процессы извлечения данных металлов из руд в раствор протекают в диффузионной области, лимитируются толщиной образующихся продуктов.
-
- Литература:
- Жунусова Г.Ж. Микроскопическое исследование структуры глинис-тых золотосодержащих руд коры выветривания // Труды Международной конференции «Форсированное индустриально-инновационное развитие в металлургии», посвященной выдающимся ученым, внесшим вклад в теорию и практику развития прокатного производства академику НАН РК Полухину П.И. и академику высшей школы МАН Давильбекову Н.Х. – 11-13 ноября 2010г.-С.228-229.
- Байысбеков Ш. Комбинированная бесцианидная технология переработки упорных золотосодержащих руд коры выветривания // Диссертация на соискание ученой степени доктора технических наук. – Алматы, 2008. – 260 с.
- Жунусова Г.Ж. Комбинированная бесцианидная технология переработки глинистых золотосодержащих руд коры выветривания // Диссертация на соискание ученой степени доктора технических наук. – Алматы, 2010. – 255 с.
- Набойченко С.С., Ни Л.П., Шнеерсон, Я.М., Чугаев, Л.В. Автоклавная гидрометаллургия цветных металлов. Под ред. члена-корр. РАН С.С. Набойченко. – Екатеринбург, 2002. – 940 с.
- Bjorling G. //Metall. – 1954. – Bd.8. – S.781-784.
- Краткий справочник физико-химических величин / Под редакцией А.А. Равделя и А.М. Пономаревой. Изд. 10 (исправл. и доп.). – СПб.: «Иван Федоров», 2003. – 240 с.
- О.Кубашевский, С.Б.Олкокк. Металлургическая термохимия.– М.: Металлургия,1982. – 392 с.