Описан механизм восстановления CO2 с использованием фотокатализатора на основе диоксида титана, рассчитан стандартный окислительно-восстановительный потенциал, по величине которого установлена возможность протекания реакций получения метана и его гомологов на поверхности TiO2.
Ключевые слова: фотокатализ, диоксид титана, углекислый газ, метан, спектр поглощения
Проблема загрязнения окружающей среды углекислым газом. За последние десятилетия деятельность человека достигла значительного прогресса: идет активное использование природных ресурсов; стремительное развитие промышленности, что порождает немало экологических проблем, и необоснованно высокий выброс углекислого газа в атмосферу является одной из них.
О защите озонового слоя Земли серьезно задумались лишь в 1987 году, а через 10 лет был подписан Киотский протокол, являющийся первым международным документом об охране окружающей среды. Он был основан на рыночном механизме регулирования промышленных выбросов парниковых газов в атмосферу, большую долю из которых составляет углекислый газ (CO2).
Основными источниками выбросов CO2 в атмосферу являются: тепловые и электростанции — 27 %, промышленность — 20 %, отопление и малая энергетика — 20 %, автотранспорт — 17 %. Все это усиливает парниковый эффект — способность атмосферы улавливать и накапливать тепло. Вследствие этого тепло не отводится от нашей планеты, происходит увеличение средней температуры на поверхности Земли, а это приводит к жаре, засухам, таяниям ледников, наводнениям [1].
Суммарный выброс углекислого газа составляет от 130 до 1100 млрд. т/год. Большая часть из этого обусловлена природными явлениями и на антропогенный фактор приходится не более 10 %, но именно эта доля нарушает равновесие в атмосфере.
Существует несколько методом очистки воздуха от диоксида углерода. Перспективным представляется переход к возобновляемым источникам энергии, таким как энергия воды, ветра, солнца. Использование автотранспорта, который работает не на классическом топливе, а на электричестве, вероятно, поможет уменьшить число выбросов диоксида углерода в атмосферу, но проблема нехватки электроэнергии приведет к строительству новых, преимущественно тепловых, электростанций, которые являются более существенными источниками выброса CO2 в атмосферу, нежели автомобили [2].
Из анализа литературных данных следует, что основными методами очистки воздуха от диоксида углерода являются — абсорбция жидкостями, адсорбция твердыми цеолитами, а также фотокаталитическая очистка [3]. Фотокаталитические методы — это самые современные и универсальные методы, основанные на явлении фотокатализа. Фотокатализ — это возбуждение химических реакций или изменение их скорости под действием света в присутствие фотокатализатора — вещества поглощающего кванты света, участвующего в химических реакциях и восстанавливающего свой химических состав после всех взаимодействий. Самый известный пример фотокаталитической реакции в природе — это процесс растительного фотосинтеза (рисунок 1):
Рис. 1. Процесс растительного фотосинтеза
Процесс переработки углекислого газа под действием солнечного света в присутствии фотокатализатора решает сразу как экологическую проблему, так и энергетическую, потому, что продуктом реакции является метан — высокоэнергетическое топливо [4].
Методика фотокаталитического восстановления диоксида углерода. Для процесса фотокаталитического восстановления CO2 используется диоксид титана со структурой анатаза и размерами частиц около 40–45 нм [5]. Методом синтеза является золь-гель технология [6], позволяющая варьировать размеры, структуру и морфологию частиц диоксида титана путем гибкого изменения условий синтеза [7]. Данный метод не является энергозатратным и трудоемким.
Чистый диоксид титана поглощает излучение лишь в УФ области солнечного излучения и имеет ширину запрещенной зоны в пределах 3,2–3,6 эВ. Для использования видимого солнечного света в процессе фотокатализа диоксид титана допируется азотом. Это сдвигает область поглощения излучения в диапазон 400–440 нм, а также сужает ширину запрещенной зоны до значений 2,8–3,1 эВ. Для повышения скорости фотокаталитических реакций и более эффективного разделения пар носителей заряда поверхность допированного азотом диоксида титана рекомендуется дополнительно декорировать частицами металла, например золота. Процессы допирования и декорирования можно проводить непосредственного в процессе золь-гель синтеза фотокаталитического материала [8].
Основная химическая реакция, характеризующая процесс фотовосстановления CO2:
![]() (1)
(1)
При комнатной температуре и атмосферном давлении данная реакция не протекает, так как константа равновесия её Kp равна 10–150. Однако на поверхности частиц TiO2 при облучении солнечным светом процесс восстановления молекул углекислого газа возможен:
![]() (2)
(2)
Процесс восстановления протекает на поверхности частиц диоксида титана и на поверхности частиц металла. Схема процесса представлена на рисунке 2:
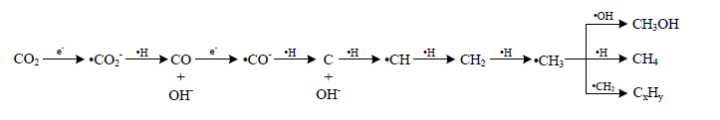
Рис. 2. Схема восстановления диоксида углерода в парах воды
Поглощая квант света, в объеме частицы фотокатализатора генерируются пары носителей заряда. Частицы металла на поверхности захватывают электроны:
![]() (3)
(3)
![]() (4)
(4)
На поверхности электроны и дырки реагируют с адсорбированными молекулами углекислого газа. Дырки влияют на процесс разложения воды:
![]() (5)
(5)
Из катионов водорода образуются водородные радикалы:
![]() (6)
(6)
Водородные радикалы вместе с электронами восстанавливают адсорбированные молекулы CO2.
Положение зоны проводимости TiO2 относительно стандартного водородного электрода (с.в.э) равно -0,5 В, поэтому на поверхности диоксида титана не смогут протекать реакции с потенциалом меньше данного [9].
Можно рассчитать вероятность протекания реакций на поверхности фотокатализатора. С помощью данных из литературы [10] рассчитаем по уравнению Нернста потенциалы нескольких реакций:
![]() , (7)
, (7)
где p — концентрация катионов водорода (примем её как в воде равной 1∙10–7 моль), E0 — стандартный окислительно-восстановительный потенциал, который рассчитывается по формуле:
![]() , (8)
, (8)
где N — количество электронов в реакции, F — постоянная Фарадея, ΔG — изменение энергии Гиббса (данные для расчета берутся из [10]).
Результаты расчетов представлены в таблице 1.
Таблица 1
Реакции, их потенциал ипродукты
|
Реакция |
Потенциал реакции, В |
Продукт реакции |
|
|
-0,091 |
Метан |
|
|
-0,389 |
Этан |
|
|
-0,126 |
Метанол |
|
|
-0,314 |
Ацетон |
|
|
-0,347 |
Этанол |
|
|
-0,512 |
Монооксид углерода |
|
|
-0,582 |
Муравьиная кислота |
Из анализа таблицы следует, что потенциал реакций получения CO и HCOOH меньше потенциала зоны проводимости диоксида титана относительно с. в.э. Поэтому данные соединения в качестве продуктов реакции получить на поверхности TiO2 нельзя.
Литература:
- Дрябжинский О. Е. Негативное влияние автотранспорта. Проблема усиления парникового эффекта. // Современные тенденции развития науки и технологий. — 2015. — № 8. — часть 4. — Белгород. — С. 88–91.
- Ермолаев В. С., Иночкин М. В., Пузык И. П., Пузык М. В. Парниковый эффект: диоксид углерода и антропогенный фактор. // Общество, среда, развитие (Terra Humana). — 2007. — № 2. — С. 77–82.
- Аверин И. А., Пронин И. А., Мошников В. А., Димитров Д. Ц., Якушова Н. Д., Карманов А. А., Кузнецова М. В. Анализ каталитических и адсорбционных свойств d-металлов-модификаторов диоксида олова // Нано — и микросистемная техника. 2014. — № 7. — С. 47–51.
- Балашев К. П. Фотокаталитическое преобразование солнечной энергии. // Соровский образовательный журнал. — 1998. — № 8. — С. 58–64.
- Патент РФ № 2012129467/28, 11.07.2012 // Аверин И. А., Игошина С. Е., Пронин И. А., Карманов А. А., Печерская Р. М. Способ определения концентрации и среднего размера наночастиц в золе. — Патент России № 2502980. — 2013.
- Аверин И. А., Игошина С. Е., Мошников В. А., Карманов А. А., Пронин И. А., Теруков Е. И. Чувствительные элементы датчиков вакуума на основе пористых наноструктурированных пленок SiO2-SnO2, полученных золь-гель методом // Журнал технической физики. 2015. — Т. 85. — № 6. — С. 143–147.
- Пронин И. А., Якушова Н. Д., Карманов А. А., Аверин И. А., Мошников В. А. Модель сборки нанокомпозитных и иерархических наноструктур в золь-гель процессах // Нано — и микросистемная техника. 2016. — Т. 18. — № 8. — С. 472–478.
- Глазкова Н. И., Никитин К. В., Катаева Г. В. Сенсибилизация диоксида титана к видимому свету, допирование и со-допирование металлами и неметаллами. // Фундаментальные исследования. — 2013. — № 10. — С. 1955–1958.
- Roy S. C., Varghese O. K., Paulose M., Grimes C. A. Toward Solar Fuels: Photocatalytic Conversion of Carbon Dioxide to Hydrocarbons // Nano Letters. — 2010. — V.4. — № 3. — P. 1259–1278.
- Рабинович В. А. Краткий химический справочник. // Л.: Издательство «Химия». — 1997. — 376 с.

