В динамике обследованы и изучены цитологический состав и микробиологические показатели слизистой оболочки верхних дыхательных путей (ВДП) в ходе лечения пациентов с реккурентными респираторными инфекциями (ПРРИ) и с бронхиальной астмой (БА). Обследовано 165 пациентов, которые были разделены на 3 группы: 48 здоровых (1 группа — контрольная), 54 пациента (группа 2) — ПРРИ, 63 пациента (группа 3) — с БА. Группам 2 и 3 проводили базисную терапию, которую дополняли иммунокорригирующей терапией. У больных с БА выявлены повышенные уровни нейтрофилов и эозинофилов при анализе цитологической картины отделяемого слизистой оболочки носа, у ПРРИ значения этих показателей были увеличены в меньшей степени.
Адекватное лечение привело к снижению частоты жалоб и симптомов заболеваний: двукратное уменьшение обострений бронхиальной астмой и частоты острых респираторных вирусных инфекций у ПРРИ, что сопровождались изменениями цитологических и микробиологический показателей слизистой носоглотки. Исследование динамики цитологических показателей показало значительное снижение частоты обнаружения эозинофилов в отделяемом слизистой оболочки носа обследуемых пациентов обеих групп и существенное снижение высеваемости различной микрофлоры. Сделан вывод о необходимости совершенствования диагностики состояния слизистой оболочки верхних дыхательных путей у ПРРИ и с БА с использованием данных цитологических и микробиологических исследований.
Ключевые слова: бронхиальная астма, пациенты с рекуррентными респираторными инфекциями, микрофлора.
The dynamics examined and studied the cytological composition and microbiological indicators of the mucous membrane of the upper respiratory tract (VDP) in the treatment of patients with recurrent respiratory infections (PRRI) and with bronchial asthma (BA). The study involved 165 patients who were divided into 3 groups: 48 healthy (1 group — control), 54 patients (group 2) — PRRI, 63 patients (group 3) — with BA. Groups 2 and 3 were given basic therapy, which was supplemented with immunocorrective therapy. In patients with asthma, elevated levels of neutrophils and eosinophils were detected when analyzing the cytological picture of the discharge of the nasal mucosa, in RRRI, the values of these parameters were increased to a lesser extent.
Adequate treatment led to a decrease in the frequency of complaints and symptoms of diseases: a twofold decrease in exacerbations of bronchial asthma and the frequency of acute respiratory viral infections in PRRI, which were accompanied by changes in the cytological and microbiological indicators of the nasopharyngeal mucosa. The study of the dynamics of cytological indicators showed a significant decrease in the frequency of eosinophil detection in the discharge of the nasal mucosa of the examined patients of both groups and a significant decrease in the germination rate of various microflora. It was concluded that it is necessary to improve the diagnosis of the condition of the mucous membrane of the upper respiratory tract in PRRI and with BA using data from cytological and microbiological studies.
Key words: bronchial asthma, patients with recurrent respiratory infections, microflora.
Введение. Внастоящее время острые респираторные заболевания, в первую очередь вирусные инфекции являются «бичом» педиатрии, а аллергия на бактериальные антигены и и вирусы представляет собой не редкое явление [1, 8]. Понятие пациенты с реккурентными респираторными инфекциями широко распространено. Все это позволяет считать актуальным параллельное обследование детей, уже больных бронхиальной астмой (БА) и пациенты с реккурентными респираторными инфекциями (ПРРИ) в аспекте изучения иммунопатологических механизмов возникновения бронхиальной астмы у пациентов с реккурентными респираторными инфекциями.
Достоверно ясно, что о нарушениях механизмов защиты организма в значительной мере свидетельствует бессимптомное носительство условно-патогенной и патогенной флоры, выступающее в качестве маркера вторичной иммунной недостаточности. Одним из важнейших показателей состояния механизмов локальной защиты верхних дыхательных путей (ВДП) является их колонизационная резистентность, которая зависит от характеристик нормофлоры биотопа и состояния неспецифической резистентности организма [4, 12]. Развивающиеся при этом негативные изменения состояния эубиоза и нарушения иммунного статуса приводят к сдвигам в эндоэкологии макроорганизма, являясь базисом для формирования целого ряда донозологических изменений, которые со временем могут трансформироваться в клинически выраженную патологию, что, как правило, и наблюдается с БА и у контингентов ПРРИ [6]. Однако эти вопросы остаются недостаточно изученными, в доступной литературе практически отсутствуют данные о цитологических и микробиологических характеристиках отделяемого носоглотки у таких детей, не описана динамика показателей состояния слизистой оболочки ВДП в процессе лечения, в том числе с применением иммунотропных лекарственных средств.
Цель работы — изучение динамики клеточного состава и микробиологических показателей слизистой оболочки носоглотки в ходе лечения ПРРИ и с бронхиальной астмой.
Материалы иметоды лечения. На базе терапевтического отделения Кызыл-кийской территориальной больницы проведено обследование 165 пациентов, которые были разделены на 3 группы:
‒ 48 здоровых пациентов (1 группа — контрольная);
‒ 54 пациента (группа 2) — ПРРИ;
‒ 63 пациента (группа 3) — с БА.
Распределение пациентов по возрасту, полу, средней длительности заболевания приведено в табл.1.
Таблица 1
Распределение пациентов по возрасту иполу идлительности заболевания
|
Параметр |
Группа 1 (контрольная) (n=48) |
Группа 2 (ПРРИ) (n=54) |
Группа 3 (с БА) (n=63) | |
|
Возраст |
20,2±1,9 |
18,8±1,5 |
18,2±2,3 | |
|
Пол |
Мужчины |
22 (45,8 %) |
24 (44,4 %) |
29 (46 %) |
|
Женщины |
26 (54,2 %) |
30 (55,6 %) |
34 (54 %) | |
|
Длительность заболевания (лет) |
- |
11.2±1,5 |
7,6±3,1 | |
У пациентов, включенных в исследование, было выполнено клиническое обследование больных с оценкой общего состояния, уровня контроля БА по АСТ в зависимости от степени тяжести заболевания и лабораторные исследования.
Все пациенты были опрошены с помощью теста контроля астмы — Asthma Control Test (АСТ). АСТ был разработан в 2002 году компанией Quality Metric Incorporated, в 2003 г. представлен на Международном конгрессе по аллергологии и иммунологии, а в 2004 г. появилась валидизированная русскоязычная версия [1].
Оценивали цитологическую картину отделяемого слизистой оболочки носоглотки у обследуемых пациентов — содержание нейтрофилов в мазках. Исследование проводили до начала лечения, спустя 3 и 6 месяцев.
Также выполняли посевы мазков из слизистой носоглотки, оценивали состав микрофлоры у обследуемых пациентов — до лечения и через 3 месяца.
Лечение больных осуществляли в соответствии с консенсусом «Глобальная инициатива по бронхиальной астме, 2014 (GINA 2014) [5].
Оценку клинической эффективности терапии осуществляли по частоте обострений БА и количеству случаев ОРВИ в течение года после проведенного лечения, лабораторные показатели оценивали до лечения и через 3 и 6 месяцев после его окончания.
Статистическую обработку данных проводили с помощью пакета программ STATISTICA 8.0. Для определения статистически значимых различий показателей в группах обследуемых пациентов U-критерий Манна-Уитни (тест Колмогорова-Смирнова показал, что распределение значений параметров существенно отличалось от нормального). При уровне p<0.05 результаты оценивались как статистически значимые.
Результаты. Оценка частоты различных жалоб у обследуемых пациентов показала, что у них выявлялись затруднение дыхания, одышка и удушье (в первую очередь с БА). Частота кашля была выше у пациентов с БА и составила 71,4 %, тогда как в группе ПРРИ — 56,2 %. Заложенность носа у больных группы 2 отмечалась в 39,6 % случаев, тогда как у пациентов с БА — в 32,4 % случаях. Свистящее дыхание выявлялось только у пациентов с БА, частота этого признака составила 24,6 %.
Анализ цитологической картины отделяемого слизистой оболочки носа у обследуемых пациентов показал, что доля нейтрофилов среди всех клеток у пациентов контрольной группы 1 составила 21,3±2,1 % (рис.1). У пациентов группы 2 (ПРРИ) — значение этого показателя было несколько выше, но достоверно не отличалось от такового в контроле — 22,4±2,8 %. В то же время в группе 3 (с бронхиальной астмой) уровень этого показателя был максимальным и составил 37,4±3,6 %, значимо превышая (p<0,05) соответствующие значения в остальных группах.
Оценка количества эозинофилов также показала их минимальное значение у детей контрольной группы 1–6,7±1,1 %, в то время как в группах 2 и 3 уровни данного параметра было значимо выше (p<0,05), составив соответственно 15,9±2,8 и 26,8±5,1 %.
Анализ микрофлоры, высеваемой со слизистых оболочек полости носа и зева у обследуемых выявил, что если у пациентов контрольной группы St.Aureus был выявлен только в 6,3 % случаях, то у ПРРИ и с БА значение этого показателя было выше более чем в 10 раз (p<0,05) и составило соответственно 51,8 и 63,5 % (табл.2). Данные высеваемости Str. Pyogenes, Enterococcus faeс., Klebsiella pneum., Candida albicans, представлены в таблице № 2
Не было выявлено микрофлоры при посевах отделяемого слизистых оболочек полости носа и зева у большинства пациентов контрольной группы (60,4 %), тогда как в группах 2 и 3 — не было таких пациентов.
Таблица 2
Характеристика микрофлоры по результатам микробиологического исследования полости носа изева упациентов срекуррентными респираторными инфекциями ис бронхиальной астмой (M±m)
|
Виды микроорганизмов |
Группа 1 (контрольная) (n=48) |
Группа 2 (ПРРИ) (n=54) |
Группа 3 (с бронхиальной астмой) (n=63) | |||
|
Абс. |
% |
Абс. |
% |
Абс. |
% | |
|
St. Aureus |
3 |
6,3 |
28 |
51,8* |
40 |
63,5* |
|
Str. Pyogenes |
5 |
10,4 |
7 |
13,0 |
11 |
17,5 |
|
Enterococcus faec. |
7 |
14,6 |
6 |
11,1 |
6 |
9,5 |
|
Klebsiella pneum. |
3 |
6,3 |
7 |
13,0 |
4 |
6,4 |
|
Candida albicans |
1 |
2,1 |
6 |
11,1 |
2 |
3,2 |
|
Не выявлено |
29 |
60,4 |
- |
- |
- |
- |
Примечание:
* — различия достоверны (p<0,05) относительно соответствующих значений группы 1 по критерию χ2
Оценка частоты жалоб больных БА после окончания лечения после начала лечения показала, что у этих пациентов уменьшилась частота затруднений дыхания, удушья и одышки — до 45,7 %, а спустя 3 месяцев — до 25,4 %. В группе ПРРИ в эти сроки таких жалоб отмечено не было. В обеих группах уменьшилась и частота кашля, соответственно до 39,8 % и 38,7 % в группах ПРРИ и БА после проведенного лечения, спустя 3 месяца значения этих показателей продолжили тенденцию к снижению соответственно до 39,1 и 20,2 %.
Сравнение количества обострений показало, что если до лечения у пациентов с бронхиальной астмой наблюдалось в среднем по 4,8 обострения в течение года, то после проведения курса терапии отмечалось почти двукратное снижение данного показателя (рис.1).
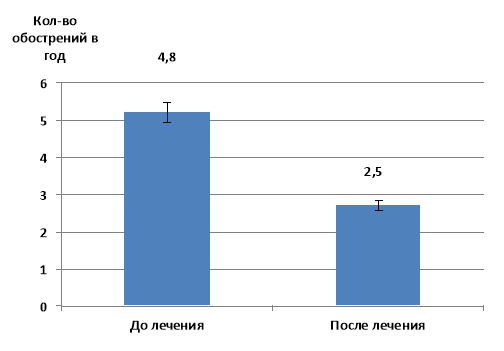
Рис.1 Частота обострений бронхиальной астмы у обследуемых пациентов в течении года
Анализ частоты ОРВИ, у ПРРИ выявила, что уровень этого показателя был значимо ниже (p<0,05) после проведенного лечения, чем до его начала (рис.2).
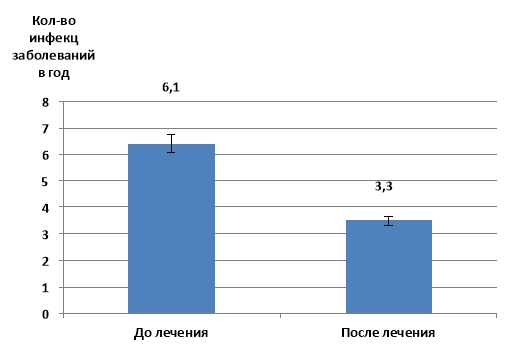
Рис. 2. Частота инфекционных заболеваний у обследуемых больных в течение года
Исследование динамики относительного количества нейтрофилов в отделяемом слизистой оболочки носа показало, что до лечения его значение в группе 2 (ПРРИ) было значимо ниже (p<0,05), чем с БА. После окончания лечения у ПРРИ значение этого показателя осталось практически на прежнем уровне и составило 21,1±2,4 %, а в группе с бронхиальной астмой снизилось до 29,8±3,1 %, при этом было значимо выше (p<0,05), чем во второй группе.
Через 3 месяца у группы ПРРИ количество нейтрофилов повысилось, а с БА незначительно снизилось, значения этого показателя не различались и составили в группах 2 и 3 соответственно 26,1±3,1 и 28,7±2,8 %. Спустя 6 месяцев от начала лечения уровень данного показателя уменьшился у пациентов обеих групп, соответственно в группе 2 — до 24,1±2,4 %, у пациентов с бронхиальной астмой — до 24,9±1,4 %, последнее значение было достоверно ниже исходного уровня в этой группе.
Оценка состояния слизистой оболочки полости носа и зева у ПРРИ и с бронхиальной астмой через 3 месяца после проведенного лечения была выполнена также по высеваемости различной микрофлоры. Было установлено снижение частоты высеваемости St.Aureus в группе 2 до 13,0 %, в группе 3 до 20,6 %, хотя значения этих показателей достоверно превышали соответствующий уровень в контрольной группе (табл.3).
Данные высеваемости Str. Pyogenes, Enterococcus faeс., Klebsiella pneum., Candida albicans, представлены в таблице № 3
Таблица 3
Характеристика микрофлоры по результатам микробиологического исследования полости носа изева уПРРИ ис бронхиальной астмой через 3 месяца после проведенного лечения (M±m)
|
Виды микроорганизмов |
Группа 1 (контрольная) (n=48) |
Группа 2 (ПРРИ) (n=54) |
Группа 3 (дети сбронхиальной астмой) (n=63) | |||
|
Абс. |
% |
Абс. |
% |
Абс. |
% | |
|
St. Aureus |
3 |
6,3 |
7 |
13,0* |
13 |
20,6* |
|
Str. Pyogenes |
5 |
10,4 |
2 |
3,7 |
6 |
9,5 |
|
Enterococcus faec. |
7 |
14,6 |
2 |
3,7 |
2 |
3,2 |
|
Klebsiella pneum. |
3 |
6,3 |
1 |
1,9 |
1 |
1,6 |
|
Candida albicans |
1 |
2,1 |
1 |
1,9 |
1 |
1,6 |
|
Не выявлено |
29 |
60,4 |
41 |
75,8* |
40 |
63,5* |
Примечание:
* — различия достоверны (p<0,05) относительно соответствующих значений группы 1 по критерию χ2
Заключение. Достоверно ясно, чтоключевым звеном патогенеза БА является обратимая обструкция дыхательных путей, обусловленная хроническим воспалением и гиперреактивностью, которые возникают в результате контакта с провоцирующим агентом [3, 9, 10, 12]. К настоящему времени установлено, что изменения в организме больного БА в значительной мере обусловлены локальной аккумуляцией клеток воспаления, в первую очередь эозинофилов, а также гиперплазией бокаловидных клеток с преобладанием фенотипа, продуцирующего вязкий секрет [11, 13].
С этими положениями согласуются полученные данные, полученные в ходе нашего исследования. Так, у пациентов с БА выявлены повышенные уровни нейтрофилов при анализе цитологической картины отделяемого слизистой оболочки носа. У ПРРИ значения этих показателей были увеличены в меньшей степени. Анализ микрофлоры слизистых оболочек полости носа и зева у обследуемых больных показал высокую частоту высеваемости St.Aureus, Str. Pyogenes.
Ряд исследователей подчеркивают, что чем чаще пациент с бронхиальной астмой болеет ОРВИ, тем в большей степени у него отмечается персистенция различных возбудителей, что в свою очередь определяет частоту заболеваемости острыми респираторными инфекциями. Все это сказывается на цитокиновом статусе ПРРИ и детей с аллергическими заболеваниями, у них отмечается недостаточность интерферона-гамма, сопровождающая увеличением уровней медиаторов фагоцитарных реакций — интерлейкинов, в частности 8, и фактора некроза опухоли — альфа [2, 6]. Однако в отличие от здоровых людей интенсивность продукции и, соответственно, функционирования этих цитокинов у этих групп детей нельзя признать полноценной.
В целом полученные данные свидетельствуют о том, что для ранней диагностики нарушений функции иммунной системы у рассматриваемых контингентов пациентов и повышения эффективности их лечения необходимо совершенствовать подходы с учетом современных представлений о молекулярно-клеточных основах патологии верхних дыхательных путей, для чего следует применять на практике методы оценки состояния слизистой оболочки верхних дыхательных путей у ПРРИ и пациентов с БА с использованием данных цитологических и микробиологических исследований.
Литература:
- Белевский А. С. Тест контроля астмы — «новая игрушка» или важный инструмент? // Пульмонология и аллергология. — 2005. — № 1 (16). — С. 1–2.
- Дугаров И. Д., Анаев Э. Х., Чучалин А. Г. О роли цитокинов при бронхиальной астме // Пульмонология. — 2009. — № 4. — С.96–102.
- Латышева Т. В., Варфоломеева М. И., Удалова В. А. и др. Взаимосвязь дисбаланса Тh1- и Th2- лимфоцитов и формы бронхиальной астмы // Иммунология. — 2005. — № 3. — С.164–167.
- Метельская В. А. Характеристика колонизационной резистентности слизистых оболочек дыхательного тракта при бронхитах у детей: автореф. дис. … канд. биол. наук. — М., 2013. — 24 с.
- Ненашева Н. М. GINA 2014: обзор некоторых основных изменений // Практическая пульмонология. — 2014. — № 3. — С.2–14.
- Рамазанова З. К., Бляхер М. С., Капустин И. В. и др. Состояние иммунной системы и продукция цитокинов у часто болеющих детей и у детей с бронхиальной астмой // Медицинская иммунология. — 2005.- Т.7, № 2–3. — С. 135–138.
- Чучалин А. Г., Колганова Н. А., Гайчиева З. Н. Оценка эффективности и безопасности препарата рузам при лечении атопического дерматита // Вестник дерматологии и венерологии. — 2005. — № 4. — С.33–37.
- Чучалин А. Г. Бронхиальная астма: новые перспективы в терапии // Казанский медицинский журнал. — 2011. — Т.92 (5). — С.676–684.
- Anderson G. P. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease // The Lancet. — 2008. — Vol. 372 (9643). — P.1107–1119.
- Hambly N., Nair P. Monoclonal antibodies for the treatment of refractory asthma // Curr. Opin. Pulm. Med. — 2014. — Vol.20 (1). — P.87–94.
- Li Y., Hua S. Mechanisms of pathogenesis in allergic asthma: Role of interleukin-23 // Respirology. — 2014. — Vol. 19 (5). — P.663–669.
- Magrone T., Simone M., Altamura M., Munno I. Characterization of the Immune Inflammatory Profile in Obese Asthmatic Children // Endocr. Metab. Immune Disord. Drug. Targets. — 2014. — Vol.14 (3). — P.187–195.
- Spann K. M., Baturcam E., Schagen J. et al. Viral and host factors determine innate immune responses in airway epithelial cells from children with wheeze and atopy // Thorax. — 2014. — Vol. 69 (10). — P.918–925.

