Целью исследования было оценить клинико-лабораторную эффективность алоглиптина с метформином. Изучались параметры углеводного обмена, уровень инсулина, лептина, ФНО-α, адипонектина до и спустя 3 мес от начала терапии. Значение инсулина снижалось на 77 %, лептина — на 65 %, ФНО-α — на 67,4 %, адипонектина повышалось на 250,5 % (W, p<0,01).
Ключевые слова: адипокины, метаболический синдром, ожирение, аллоглиптин.
Избыточный вес и ожирение, являясь компонентами метаболического синдрома (МС), выявляются с неуклонно возрастающей частотой и носят эпидемический характер [2]. Также к компонентам МС относят нарушенную гликемию натощак (НГН), нарушение толерантности к глюкозе (НТГ), липидного обмена (комбинированная и изолированная дислипидемия — гипертриглицеридемия, гиперлипидемия холестерина ЛПНП), гиперинсулинемия (ГИ) и инсулинорезистентность (ИР) [7]. В исследованиях, посвященных изучению роли адипо- и цитокинов, существенно расширен патогенез МС: место ИР и адипокинорезистентности [1,2].
К рекомендованным критериям МС относят (ВНОК, 2009 г.) [1]:
основной признак — центральный (абдоминальный) тип ожирения — окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин
дополнительные критерии: АГ (АД≥130/85 мм рт. ст.), повышение уровня ТГ (≥1,7 мМ/л), снижение уровня ХС ЛПВП (<1,0 мМ/л у мужчин; <1,2 мМ/л у женщин), повышение уровня ХС ЛПНП (>3,0 мМ/л), НГН (глюкоза в плазме крови натощак 6,1 мМ/л и более), НТГ (глюкоза в плазме крови через 2 ч после нагрузки глюкозой в пределах 7,8 и более и 11,1 мМ/л и менее).
Наличие у пациента центрального ожирения и 2-х дополнительных критериев достаточно для диагностирования МС. Жировой ткани (ЖТ) принадлежит существенное значение в формировании МС [7]. Цитокины, продуцируемые ЖТ, способны модифицировать инсулинопродукцию, изменять трансдукцию инсулинового сигнала, активность рецепторов к инсулину, скорость липогенеза [1,2,16]. Адипокины бивалентно воздействуют на ГИ и ИР. Так накопление в крови фактора некроза опухоли альфа (ФНО-α) проявляет ингибиторную активность при ГИ и потенцирующую — при ИР [8,9,13]. Существенное значение в модификации ИР принадлежит адипонектину (АН) и лептину, также влияющему на изменение пищевого поведения [13]. АН ингибирует дифференцировку преадипоцитов. Уровень АН в плазме крови обратно пропорционален массе ЖТ и индексу талия-бедро (ИТБ) [1]. АН регулирует энергетический гомеостаз и обладает противовоспалительным и антиатерогенным действием [1,17]. Снижение экспрессии АН коррелирует с ИР [1,16], АН выполняет протективную антигипергликемическую функцию, препятствует ИР, частично ингибируя активность ФНО-α [17], повышенный уровень которого при ожирении ассоциирован с развитием гипергликемии и ИР, подавляя экспрессию гена АН [16,17]. АН угнетает системную воспалительную реакцию, способствует активации репарации клеток [8]. Концентрация лептина увеличена у пациентов, страдающих избыточным весом и ожирением [1,8,12]. У лептина выявлено ингибирующее действие на секрецию инсулина, ассоциированное с повышением гликемии [12]. Уровень лептина зависит от эндокринного гендерного статуса: концентрация лептина выше у женщин в сравнении с мужчинами. Гиперпродукция ФНО-α играет ключевую роль в патогенезе синдрома ИР, воздействуя на пути передачи инсулинового сигнала и активность инсулиновых рецепторов [1,8,13,16]. Гиперпродукция лептина у тучных пациентов индуцирует синтез мРНК ФНО-α и потенцируют его высвобождение макрофагальной системой [8]. Контринсулярное действие ФНО-α опосредовано ингибированием экспрессии ГЛЮТ-4 и тирозинкиназы инсулиновых рецепторов в клетках-мишенях. Как оказалось, нарушение адипокинового баланса с превалированием ФНО-α, лептина и дефицитом АН на фоне ГИ и ИР модифицирует липидный обмен с увеличением холестерина ЛПНП и ТГ, компонентов «диабетической триады», существенно ускоряет атеросклеротический процесс [7,8,16]. Исследования показывают, что ЖТ обладает способностью продуцировать не только адипокины (лептин, резистин, висфатин, АН) [3,4], но и ряд биологически активных молекул, регулирующих центр нейроэндокринной модификации пищевого поведения. ЖТ интегрируется в систему пищевого поведения как звено регуляции, включающее в себя желудочно-кишечный тракт и головной мозг. Нейропептид Y, пептид YY, холецистокинин, эндогенный анорексиген обестатин и ингибирующие аутоантитела (орекси-, анорексигенными ингибирующие аутоантитела) замыкают сложную цепь пищевого поведения [15]. Выявлено, что продукция нейропептида Y (центрального орексигена) существенно выше абдоминальными адипоцитами, ассоциирована с понижающей регуляцией секреции лептина [14]. В то же время некоторые авторы отмечают потенцирующее действие ингибиторов дипептидилпептидазы 4 типа (ДПП4) на нейропептид Y-опосредованное антилиполитическое действие [6], что позволяет предполагать инициацию иных модификаторов липогенеза и липолиза. В ряде экспериментальных исследований показано, что воздействие модифицированных полипептидов на культуру ИР клеток ЖТ сопровождалось изменением продукции как адипокинов, так и ДПП4, а также оментина и химерина преимущественно в культуре висцеральных адипоцитов [3]. Выявлено, что концентрация ДПП4 коррелировала с размером адипоцитов висцеральной ЖТ, при снижении объема которой количество адипогенной ДПП4 падало вдвое [5]. Современная концепция патогенеза МС рассматривает гиперпродукцию цитокинов, адипокинов в качестве фактора индукции инсулино-, лептинорезистентности [4], а также триггеров прогрессии связанных состояний. Применение ингибиторов ДПП4 позволяет выделять в популяции пациентов, неодинаково реагирующих на введение препаратов: низко- и высокочувствительных, — что может определяться особенностями как инактивации ингибитора ДПП4, так и индивидуальной активностью ДПП4 у пациента [11]. Анализ эффективности применения ингибиторов ДПП4 говорит о гетерогенности индивидуальной чувствительности в зависимости от вводимого препарата [11]. Назначение 12,5 мг алоглиптина в сутки у пациентов, нестрадающих сахарным диабетом 2 типа с избыточной массой тела, не сопровождалось формированием гипогликемических реакций, потенцируя увеличение концентрации глюкагоноподобного пептида 1 типа и нивелируя пре- и постпрандиальные колебания гликемии [8]. Дальнейшие исследования продемонстрировали существенную эффективность длительного введения ингибиторов ДПП4 в условиях следования высокожировой диете: отмечено ингибирование формирования и прогрессирования CD3-ассоцированого периинсулита, а также снижение концентрации провоспалительных цитокинов. Широкое применение ингибиторов ДПП4 в группах разной чувствительности к препарату (алоглиптин) [11] продемонстрировали дополнительные эффекты: снижение НОМА-IR и компенсацию липидограммы с превалированием антиатерогенных фракций [10].
Материалы и методы исследования.
Под наблюдением находилось 34 человека. Из них: женщин — 18 (53 %), мужчин — 16 (47 %). Средний возраст пациентов составил 48,5±0,86 лет, средняя длительность МС — 7,1±0,37 лет, средняя масса тела — 90,7±1,47 кг, значение ИМТ — 31,1±0,49 кг/м2, ОТ — 96,3±1,06 см. Всем больным проводилась комбинированная терапия, включавшая гипокалорийное питание с учётом физической активности (1150–1350 ккал/сут), инсулиносенситайзеры группы бигуанидов (средняя доза метформина пролонгированного действия — 1250 мг/сутки), ингибиторы ДПП4 (алоглиптин до 12,5 мг/сут), индивидуальная физическая активность. Лабораторные методы исследования рутинных параметров крови проводились по общепринятым методикам: пре- и постпрандиальная гликемия, уровень гликированного гемоглобина (прямым методом) (HbA1c), общего холестерина, холестерина ЛПНП и ЛПВП, триглицеридов, АЛТ, АСТ (как параметры контроля безопасности). У больных изучали следующие параметры адипокинового статуса: уровень ФНО-α (реактивы ООО «Цитокин» (Россия)), адипонектина, лептина (реактивы «R&DSystem, Inc». (США)) методом ELISA на АИФР-01 «Униплан» («Пикон», (Россия)), также определяли базальный уровень инсулина.
Для каждого пациента на основе значений инсулина и глюкозы сыворотки крови препрандиального периода рассчитывали показатель HOMA-IR по формуле:
![]() ,(1)
,(1)
При базальном уровне инсулина ≥18 мкЕд/мл констатировалась ГИ, значение показателя HOMA-IR ≥2,27 свидетельствовало о наличии ИР [9,13]. Указанные параметры исследовались до начала терапии и спустя 3 мес. Статистическая обработка выполнена с помощью программ Excel 2013 (Microsoft) и Statistica 8.0 (StatSoft, Inc.), исследуемые показатели приведены в виде M±m, для сравнения использовали критерий Уилкоксона (W), критический уровень значимости (p) принимали равным 0,05.
Результаты исследования и их обсуждение.
До начала терапии у всех пациентов отмечалась инсулино- и лептинорезистентность: уровень лептина составлял 32,7±1,23 нг/мл, инсулина — 21,6±0,49 мкЕд/мл, индекс НОМА-IR — 5,96±0,13, а также сниженное значение АН — 3,8±0,08 нг/мл на фоне повышения ФНО-α — 14,6±0,39 пг/мл. Нарушение гликемического статуса соответствовало НГН (n=8) и НТГ (n=26), значение препрандиальной гликемии — 6,2±0,05 мМ/л, постпрандиальной гликемии — 8,5±0,07 мМ/л, HbA1c — 6,45±0,06 %. Значение уровня HbA1c обнаруживало прямую корреляцию с величиной инсулина (r +0,59, p<0,01), индекса НОМА-IR (r +0,65, p<0,01), лептина (r +0,61, p<0,01), ФНО-α (r +0,57, р<0,01) и обратную корреляцию с уровнем АН (r -0,56, p<0,01). Выявлена прямая зависимость инсулина и массы тела (r +0,43, p<0,05), ИМТ (r +0,41, p<0,05), ОТ (r +0,41, p<0,05), лептина (r +0,74, p<0,01), ФНО-α (r +0,89, р<0,01) и отрицательная корреляция с АН (r ‑0,61, p<0,01). Величина лептина отрицательно коррелировала с АН (r -0,71, p<0,01) и положительно — с ФНО-α (r +0,77, p<0,01). Обнаруживалась отрицательная взаимосвязь уровня ФНО-α и АН (r -0,69, p<0,01).
Спустя 3 месяца от начала комплексной терапии масса тела снизилась на 13 % (∆-11,8 кг) и составила 79±1,5 кг, ИМТ уменьшился на 13,5 % (∆-4,2 кг/м2), достигнув 26,9±0,55 кг/м2, также отмечалось снижение ОТ на 11,1 % (∆-10,7 см), составившего 85,7±0,91 см (W, p<0,01), рис 1. Уровень САД снижался с 149±0,7 до 132±0,4 мм рт.ст. на 11,4 % (∆-17 мм рт.ст.) и ДАД — с 95±0,7 до 75±0,5 мм рт.ст. на 21,1 % (∆-20 мм рт.ст.) (W, p<0,01) рис. 1.
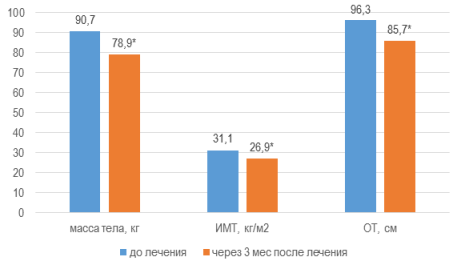
Рис. 1. Модификация параметров массы тела, индекса массы тела и объема талии через 3 мес. от начала терапии
Примечания: * — уровень достоверности различий значений параметра р<0,01 при использовании критерия Уилкоксона.
Параметры углеводного обмена характеризовались сходной тенденцией: уровень препрандиальной гликемии уменьшился на 24,5 % до 4,7±0,05 мМ/л (∆-1,5 мМ/л), постпрандиальной — на 19,8 % до 6,8±0,04 мМ/л (∆-1,7 мМ/л) и HbA1c — на 26,8 % до 4,7±0,06 % (∆-1,7 %) (W, p<0,01). Не было зарегистрировано гипогликемических реакций. Значение инсулинемии снижалось на 77 % до 5,0±0,21 мкЕд/мл (∆-16,6 мкЕд/мл), индекса НОМА-IR — на 82,6 % до 1,0±0,04 (∆-4,9) (W, p<0,01), рис. 2.
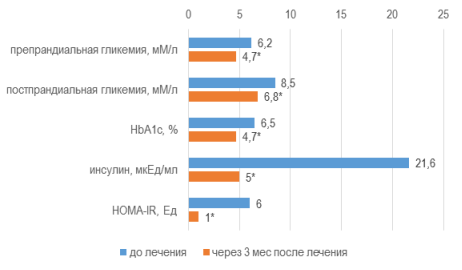
Рис. 2. Модификация параметров углеводного обмена через 3 мес от начала терапии
Примечания: * — уровень достоверности различий значений параметра р<0,01 при использовании критерия Уилкоксона
У пациентов отмечалось достоверное изменение показателей липидного обмена: уровень ОХС снижался на 29 % до 4,8±0,06 мМ/л (∆-2,0 мМ/л), ТГ — на 41,5 % до 1,4±0,05 мМ/л (∆-1,0 мМ/л), ХС ЛПНП — на 43,1 % до 2,9±0,05 мМ/л (∆-2,2 мМ/л) (W, p<0,01); значение ХС ЛПВП увеличивалось на 74 % до 1,81±0,03 мМ/л (∆+0,77 мМ/л) (W, p<0,01).
Параметры адипокинового статуса характеризовались следующими изменениями: величина лептина уменьшалась на 65,0 % до 11,4±0,51 нг/мл (∆-21,3 нг/мл), ФНО-α — на 67,4 % до 4,75±0,17 пг/мл (∆-9,8 пг/мл), в то время как концентрация АН демонстрировала рост на 250,5 % до 13,1±0,22 нг/мл (∆+9,4 нг/мл) (W, p<0,01), рис. 3.
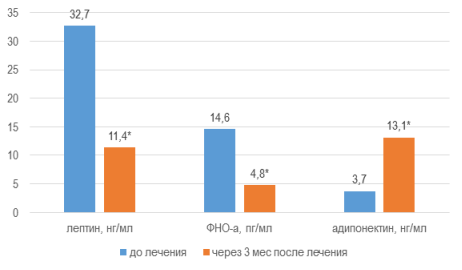
Рис. 3. Модификация параметров адипокинов через 3 мес от начала терапии
Примечания: * — уровень достоверности различий значений параметра р<0,01 при использовании критерия Уилкоксона
Комплексное действие индивидуализированной физической активности и изменения суточной калорийности питания в сочетании с назначением алоглиптина и метформина оказывает существенное влияние на компоненты метаболического синдрома (коррекция массы тела, объема талии, углеводного и липидного обмена) и способствуют как снижению лептино- и инсулинорезистентности, ингибированию синтеза ФНО-α, так и приросту адипонектина у наблюдаемых больных. Накопление научных данных о роли ДПП4 как адипокина, модификатора продукции анорексигенов, фактора потенцирования секреции глюкагоноподобного пептида 1 типа существенно расширяют наши представления о механизмах регуляции пищевого поведения и формирования МС, что позволяет применять ингибиторы ДПП4 (алоглиптин) в низкой терапевтической дозе (12,5 мг/сут, с контролем параметров гликемического профиля и HbA1c) в комбинации с метформином, но вместе с тем требует и дальнейшего изучения потенциально перспективных путей коррекции патогенетических звеньев МС.
Литература:
- Горшков И. П. Роль адипокинов в патогенезе сахарного диабета 2 типа и метаболического синдрома / И. П. Горшков, В. И. Золоедов // Вестник новых медицинских технологий. — № 1. — 2010. — С. 132–134.
- Демидова Т. Ю. Роль жировой ткани в развитии метаболических нарушений у больных сахарным диабетом 2-го типа в сочетании с ожирением / Т. Ю. Демидова, А. В. Селиванова, А. С. Аметов // Терапевтический архив. — 2006. — Т. 78, № 11. — С. 64–69.
- Adiponectin, chemerin, cytokines, and dipeptidyl peptidase 4 are released from human adipose tissue in a depot-dependent manner: an in vitro system including human serum albumin / H.Svensson, B.Oden, S.Eden, M.Lonn // BMC Endocr Disord. — 2014. — Vol. 14, N 1. — 7 p. — doi: 10.1186/1472–6823–14–7.
- Adipose dipeptidyl peptidase-4 and obesity: correlation with insulin resistance and depot-specific release from adipose tissue in vivo and in vitro / H.Sell [et al.] // Diabetes Care. — 2013. — Vol. 36, N 12. — P. 4083–4090.
- Dipeptidyl peptidase 4 is a novel adipokine potentially linking obesity to the metabolic syndrome / D.Lamers [et al.] // Diabetes. — 2011. — Vol. 60, N 7. — P. 1917–1925.
- DPP-IV inhibition enhances the antilipolytic action of NPY in human adipose tissue / K.Kos [et al.] // Diabetes Obes Metab. — 2009. — Vol. 11, N 4. — P. 285–292.
- Evaluation and treatment of hypertriglyceridemia: An endocrine society clinical practice guideline / L.Berglund [et al.] // Journal of Clinical Endocrinology & Metabolism. — 2012. — Vol. 97. — P. 2969–2989.
- Hamamoto H. Analyzing the factors contributing to withdrawal from insulin therapy following additional administration of alogliptin: retrospective study after removing glucotoxicity with insulin / H.Hamamoto, K.Nakanishi, M.Noda // Jpn Clin Med. — 2015. — N 6. — P. 15–20. — doi: 10.4137/JCM.S27202.
- Insulin resistance induced by tumor necrosis factor-alpha in myocytes and brown adipocytes / M.Lorenzo [et al.] // J Anim Sci. — 2008. — Vol. 86, Suppl. 14. — P. E94-E104.
- Kutoh E. Alogliptin: a new dipeptidyl peptidase-4 inhibitor with potential anti-atherogenic properties / E.Kutoh, N.Kaneoka, M.Hirate // Endocr Res. — 2015. — Vol. 40, N 2. — P. 88–96. — doi: 10.3109/07435800.2014.952743.
- Kutoh E. Distinct glucose-lowering properties in good responders treated with sitagliptin and alogliptin / E.Kutoh, M.Hirate, A.Wada // Int J Clin Pract. — 2015. — doi: 10.1111/ijcp.12697.
- Munzberg H. Leptin-signaling pathways and leptin resistance / H.Munzberg // Forum Nutr. — 2010. — Vol. 63. — P. 123–132.
- Roberts C. K. Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training / C. R. Roberts, A. L. Hevener, R. J. Barnard // Compr Physiol. — 2013. — Vol. 3, N 1. — P. 1–58.
- Secretion of neuropeptide Y in human adipose tissue and its role in maintenance of adipose tissue mass / K.Kos [et al.] // Am J Physiol Endocrinol Metab. — 2007. — Vol. 293, N 5. — P. E1335-E1340.
- The role of «mixed» orexigenic and anorexigenic signals and autoantibodies reacting with appetite-regulating neuropeptides and peptides of the adipose tissue-gut-brain axis: relevance to food intake and nutritional status in patients with anorexia nervosa and bulimia nervosa / K.Smitka [et al.] // Int J Endocrinol. — 2013. — Epub: 483145. — 21 p.
- TNF-alpha inhibits insulin action in liver and adipose tissue: A model of metabolic syndrome / S. S. Solomon [et al.] // Horm Metab Res. — 2010. — Vol. 42, N 2. — P. 115–121.
- Vega G. L. Metabolic risk susceptibility in men is partially related to adiponectin/leptin ratio / G. L. Vega, S. M. Grundy // Journal of Obesity. — 2013. — Vol. 2013. — Article ID 409679. — 9 p.

