Исследование комплексообразования мeди (II) С 2,6-дитиол-фенолом и гидрофобными аминами
Авторы: Кулиев Керим Аваз оглы, Вердизаде Наиля Аллахверди кызы, Исмаилова Шахназ Юсиф кызы
Рубрика: 5. Аналитическая химия
Опубликовано в
II международная научная конференция «Современная химия: Успехи и достижения» (Чита, апрель 2016)
Дата публикации: 07.04.2016
Статья просмотрена: 447 раз
Библиографическое описание:
Кулиев, К. А. Исследование комплексообразования мeди (II) С 2,6-дитиол-фенолом и гидрофобными аминами / К. А. Кулиев, Н. А. Вердизаде, Ш. Ю. Исмаилова. — Текст : непосредственный // Современная химия: Успехи и достижения : материалы II Междунар. науч. конф. (г. Чита, апрель 2016 г.). — Чита : Издательство Молодой ученый, 2016. — С. 16-23. — URL: https://moluch.ru/conf/chem/archive/162/9873/ (дата обращения: 27.10.2024).
Complex formation of copper with 2,6-dithiolphenol (DTF) and a hydrophobic amine (Am) was Investigated spectrophotometrically. Aniline (An), N-methylaniline (mAn), and N, N-dimethylaniline (dAn) were used as the hydrophobic amine. It has been found that ternary complexes formed in a weakly acidic medium (pHopt = 4.3–5.5). The ratio of the reactants in the mixed-ligand complexes corresponds to the Cu (II): DTP: Am = 1: 2: 4. The molar absorbance coefficients are equal to (2.92–3.35) • 104. Based on findings, procedure were developed for photometric determination of copper in different brands of steels and in oil and oil-products..
Keywords: copper, extraction-photometric method, 2,6-dithiollphenol, determination
Медь относится к числу тех металлов, которые обладают хромофорными свойствами, поэтому среди многочисленных фотометрических методов определения меди имеются как методы, основанные на использовании окрашенных реагентов с хромофорными группами, так и методы, в которых применяют бесцветные реагенты. Большинство методов обладают высокой избирательностью. Это дитизоновый, дитиокарбоматный, купроиновый и купризоновый методы или метод, с применением бис-(циклогексанон)оксалилдигазона; наибольшей чувствительностью обладает дитизоновый метод [1]. Реагенты, содержащие гидрокси — и карбокси -, или две гидрокси-группы в орто положении друг к другу, взаимодействуют с медью преимущественно в слабокислых и нейтральных средах с образованием окрашенных комплексных соединений [2].
Для экстракционно-спектрофотометрическое определения меди (II) предложен изонитрозопропиофенон [3]. Разработан чувствительная и селективная методика спектрофотометрического определения меди (II) в сплавах и в воде [4].
В неионно- мицеллярной среде фотометрическим методом определяли следовых количеств Cu (II) с 1- (2-пиридилазо) -2-нафтолом (ПАН) в присутствии нейтрального поверхностно-активного вещества, Тритон Х-100. [5].
Для спектрофотометрического определения меди в некоторых экологических и биологических объектах с помощью предложен салицилальдегид бензоил гидразон [6]. Разработаны экстракционно-фотометрическая методика определения меди с ализариновым желтым Р и триизобутил-фосфатом в пищевых продуктах [7].
Cогласно гипотезы аналогий, реакции с реагентами типа R-SH возможны для ионов элементов, образующих малорастворимые в воде сульфиды [8]. Разработаны методики определения элементов в виде разнолигандных комплексов (РЛК) с 2-гидрокси-5-галогентиофе-нолами и гидрофобными аминами [9,10, 11]. Представляло интерес изучение комплексообразования мeди (II)с 2,6-дитиолфенолом.
Представленная работа посвящена спектрофотометрическому исследованию взаимодействия меди с 2,6-дитиолфенолом в присутствии анилина, N-метиланилина, и N,N-диметиланилина.
Экспериментальная часть
Реагенты и растворы. Для приготовленияисходного раствора (1мг/мл) меди 3,9296г свежеперекристаллизованный CuSO45H2Oрастворили в воде, прибавляли 2 капли конц. серной кислоты и разбавляли в мерной колбе водою до 1л [12]. Растворы с концентрацией 0,1 мг/мл получали разбавлением исходного раствора. В работе использовали 0,01М раствор 2,6-дитиолфенола (ДТФ) и гидрофобных аминов (Ам). Анилин (Ан), N — метиланилин (мАн) и N,N-диметиланилин (дАн) использовали в свежеперегнанном виде. В качестве экстрагента применен очищенный хлороформ.
Ионную силу растворов, равную µ=0,1 поддерживали постоянной, введением рассчитанного количества KCl. Для создания необходимой кислотности растворов применяли 0,1М раствор HCI.
Аппаратура. Оптическую плотность органической фазы измеряли на КФК-2 и СФ-26. Значение рН водной фазы контролировали при помощи прибора И-120.2. со стеклянным электродом. ИК-спектры снимали на спектрофотометре UR-20. Все указанные приборы прошли госпроверку.
Методика. Вградуированные пробирки с притертыми пробками вводили 0,1–0,8 мл, с интервалом 0,1 мл исходного раствора меди, 2,2 мл 0,01М раствора ДТФ и 0,6–0,8 мл Ам. Необходимое значение рН устанавливали добавлением 2 мл 0,1М раствора NaOH. Объем органической фазы доводили до 5 мл хлороформом, а водной фазы — до 20 мл дистиллированной водой. Спустя 5 минут органический слой отделяли и измеряли его оптическую плотность при комнатной температуре на КФК-2 при 490 нм.
Результаты иих обсуждение
Представленная работа посвящена спектрофотометрическому исследованию взаимодействия меди (II) с 2,6-дитиоленолом. ДТФ с медью образует окрашенный комплекс, нерастворимый в неполярных органических растворителях. Заряд комплекса был установлен методом электромиграции ионов и методом электрофореза на бумаге. При изучении электро-миграции данного комплекса, в U-об-разной трубке наблюдалось движение окрашенных в оранжевый цвет ионов к положительному полюсу, на основании чего был сделан вывод о том, что окрашенный комплекс является анионом. При введении в систему гидрофобных аминов наблюдается экстракция анионного комплекса в органическую фазу в виде разнолигандного комплекса (РЛК). Из гидрофобных аминов использованы анилин, N-метиланилин, N,N-диметиланилин. На основании полученных данных разработаны новые избирательные и высокочувствительные методики фотометрического определения микроколичеств меди в сталях различных марок.
Выбор экстрагента. Для экстракции РЛК использованы неводные растворители: хлороформ, 1,2-дихлорэтан, четыреххлористый углерод, бензол, хлорбензол, толуол, ксилол, изобутанол, изопентанол и диэтиловый эфир. Экстрагируемость комплексов оценивали коэффициентом распределения и степенью экстракции. Наилучшими экстрагентами оказались хлороформ, дихлорэтан и четыреххлористый углерод. При однократной экстракции хлороформом извлекается 98,2–98,6 % меди в виде РЛК. Дальнейшие исследования проводили с хлороформом. Содержание меди в органической фазе определяли фотометрически — дитиолом после реэкстракции, а в водной — по разности. При экстракции комплексов меди с ДТФ молекулы хлороформа не входят в состав экстрагирующихся комплексов; сольватное число, характеризующееся значением тангенса угла наклона в данном случае равно нулю. При уменьшении диэлектрической проницаемости растворителя константы устойчивости комплексов возрастают. Понижение растворимости реагентов и комплексов в воде, как правило, сопровождается улучшением их растворимости в органических растворителях. Применение экстракционных методов намного повышает избирательность и чувствительность реакций.
Влияние рН водной фазы. Для образования и экстракции смешанных комплексов оптимальным является рН=4,9–6,1. При рН раствора ![]() 7 экстракция комплексов практически не наблюдается, что, видимо, связано с понижением степени протонизации аминов. С другой стороны увеличивается концентрация в водном растворе неэкстрагирующегося комплекса [Сu(ДТФ)2]4-, так как диссоциация ДТФ по второй сульфгидрильной группе (рК2=8,56) продолжает возрастать.
7 экстракция комплексов практически не наблюдается, что, видимо, связано с понижением степени протонизации аминов. С другой стороны увеличивается концентрация в водном растворе неэкстрагирующегося комплекса [Сu(ДТФ)2]4-, так как диссоциация ДТФ по второй сульфгидрильной группе (рК2=8,56) продолжает возрастать.
Зависимость оптической плотности от рН представлена на рис.1. Наличие одного максимума оптической плотности в указанных пределах рН подтверждает предположение об образовании одного комплексного соединения.

Рис.1. Зависимость оптической плотности РЛК меди (II) от рН водной фазы
1.Cu — ДТФ — Ан, 2.Cu — ДТФ — мАн, 3.Cu — ДТФ — дАн
![]() = 1,87510–5 М; СДТФ=0,8810–3 М;
= 1,87510–5 М; СДТФ=0,8810–3 М; ![]() = 1,2410–3 М, КФК-2, =540нм, l=0.5 cм.
= 1,2410–3 М, КФК-2, =540нм, l=0.5 cм.
Влияние концентрации лигандов и времени выдерживания. РЛК меди образуются в присутствии большого избытка комплексообразующих реагентов. Оптимальным условием образования и экстракции этих соединений является 0,8810–3 моль/л концентрация ДТФ и 1,2410–3 моль/л — Ам.
РЛК меди с ДТФ и Ам устойчивы в водных и органических растворителях и не разлагаются в течении трех суток, а после экстракции — больше месяца. Максимальная оптическая плотность достигается в течении 5 минут.
Спектры поглощения. Максимальный аналитический сигнал при комплексообразовании меди с ДТФ и Ам наблюдается при 530–536 нм (рис.2). ДТФ максимально поглощает при 270 нм. При комплексообразовании наблюдается батохромное смещение максимума светопоглощения на 260–266 нм. Контрастность реакций высока: исходные реагенты почти бесцветны, а комплексы-красно-бурого цвета. Молярные коэффициенты поглощения составляют (2,92 -3,35)104.
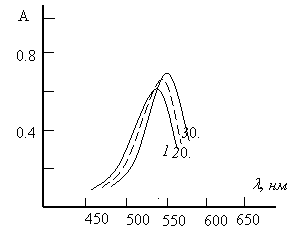
Рис.2. Спектры поглощения комплексов меди(II) с ДТФ и Ам
1. Cu -ДТФ-Ан, 2.Cu -ДТФ-мАн, 3.Cu -ДТФ-дАн
![]() = 1,875 10–5 М; СДТФ= 0,88 10–3 М;
= 1,875 10–5 М; СДТФ= 0,88 10–3 М; ![]() = 1,2410–3 М, СФ-26, l=1cм.
= 1,2410–3 М, СФ-26, l=1cм.
Состав и строение комплексов. Стехиометрию исследуемых комплексов устанавливали методами сдвига равновесия и относительного выхода[13]. Приведенные на рис.3 данные показывают, что соотношение компонентов в составе РЛК Cu(II): ДТФ: Ам. Методом Назаренко было установлена, что комплексообразующей формой меди является Cu2+[14,15]. При этом число протонов, вытесняемых им из одной молекулы ДТФ, оказалось равным 1.
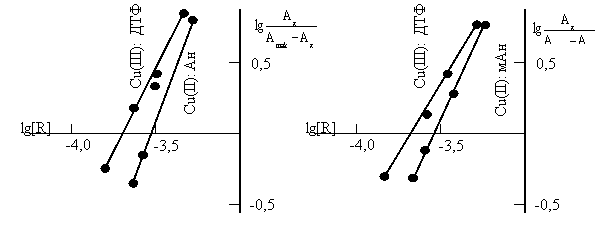
Рис.3. Определение состава комплекса Cu -ДТФ-Ам методом сдвига равновесия
![]() = 1,875 10–5 М; СФ-26, l=1cм.
= 1,875 10–5 М; СФ-26, l=1cм.
В ИК-спектрах комплекса в области 950–960 см-1 появляется интенсивная полоса поглощения, которая отсутствует в спектрах реагента. Эта полоса обусловлена валентным колебанием связи метал-лиганд. Исчезновение ярко выраженной полосы при 2580см-1, наблюдаемая в спектре ДТФ и появление в спектрах комплекса двух полос поглощения, одна из которых смещена в сторону меньших частот, говорит о том, что один из –SH групп участвует в образовании комплекса. Исчезновение полосы поглощения в области 3200–3600см-1 с максимумом при 3460см-1 показывает, что гидроксильная группа принимает участие в образовании связи с металлом. Обнаружение полосы поглощения при 2380 см-1 указывает на наличие протонированного анилина, а полосы поглощения при 1370 см-1 — на наличие координированного анилина [16,17].
Медь (II) с dsp2гибридными орбиталями образует плоские квадратные комплексы. Однако, плоские квадратные комплексыCu(II) с одним неспаренным электроном способны присоединить дополнительные лиганды, образуя октаэдрические комплексы [2].
Произведенные расчеты показали, что РЛК в органической фазе не полимеризуются и находятся в мономерной форме (=1,05–1,08) [18].
Механизм образования РЛК можно представить следующим образом. Ионы меди при взаимодействии с двумя молекулами ДТФ и Ам образуют двухзарядный анионный комплекс, который экстрагируется с двумя молекулами протонированного Ам. Состав экстрагируемых смешанных комплексов можно представить формулой ![]() .
.
Можно предположить, что при комплексообразовании происходят процессы:
![]() (1)
(1)
![]()
![]() (2)
(2)
Константа равновесия реакции равна![]()
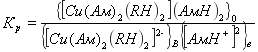 (3)
(3)
Поскольку коэффициент распределение (D) равен
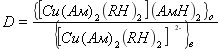 (4)
(4)
То
![]() (5)
(5)
Прологарифмировав последнее выражение, получим
![]() (6)
(6)
Величины ![]() , вычисленные по формуле(6) для комплексов [Cu(ДТФ)2(Ан)2](АнН)2 [Cu(ДТФ)2(мАн)2](мАнH)2 и [Cu(ДТФ)2(дАн)2](дАнH)2 равны 6,55±0,27; 6,62±0,14 и 6,79±0,34 соответс-твенно.
, вычисленные по формуле(6) для комплексов [Cu(ДТФ)2(Ан)2](АнН)2 [Cu(ДТФ)2(мАн)2](мАнH)2 и [Cu(ДТФ)2(дАн)2](дАнH)2 равны 6,55±0,27; 6,62±0,14 и 6,79±0,34 соответс-твенно.
В табл. 1. приведены основные спектрофотометрические характеристики РЛК меди.
Таблица 1
Характеристика РЛК меди сДТФ иАм.
|
Соединение |
рН |
,нм |
,нм |
·10–4 л·мол-1·см-1· |
Рабочий диапазон, мкг/мл |
|
|
Образования и экстракции |
Оптимальная |
|||||
|
[Cu(ДТФ)2(Ан)2](АнН)2 |
1.5–5.7 |
4.3–5.2 |
530 |
260 |
2.92 |
0.05–3.2 |
|
[Cu(ДТФ)2(мАн)2](мАнH)2 |
1.8–5.9 |
4.4–5.3 |
534 |
264 |
3.21 |
0.05–3.2 |
|
[Cu(ДТФ)2(дАн)2](дАнH)2 |
2.0–6.4 |
4.5–5.5 |
536 |
266 |
3.35 |
0.05–3.4 |
В интервале концентраций 0,05–3.4 мкг в 1мл экстракта ионных ассоциатов соблюдается линейная зависимость между оптической плотностью и концентрацией раствора.
Влияниепосторонних ионов. Для оценки применимости экстрактов РЛК для разделения и определения меди изучено мешающее влияние посторонних ионов. Избирательность спектрофотометрического определения меди в виде изученных комплексов представлена в табл.2. Установлено, что большие количества щелочных, щелочноземельных элементов, РЗЭ, F-, CI-, ![]() не мешают определению меди. Олределению мешают цитраты и тартраты, J-,CN-,
не мешают определению меди. Олределению мешают цитраты и тартраты, J-,CN-, ![]() , тиомочевина. Мешающее влияние Fе (III) устраняли щавеловой кислотой; Ti(IV)– фторидом натрия или тайроном; Hg(II)-сульфит ионом; Nb(V) и Ta(V) –щавелевой кислотой, а Mo(VI) и W(VI)- фторидом натрия и щавелевой кислотой. При использовании 1 %-го раствора аскорбиновой кислоты определению не мешают Mn(VII), V(IV), Nb(V), Cr(VI), Mo(VI) и Fe(III). При использовании 0,01М раствора щавеловой кислоты определению не мешают V(IV), Nb(V), Ta(V), Cr(III), Mo(VI), W(VI) и Fe(III). Кроме того Nb(V), Ta(V) и Ti(IV) с ДТБФ и Ам образуют комплексы в более кислой среде.
, тиомочевина. Мешающее влияние Fе (III) устраняли щавеловой кислотой; Ti(IV)– фторидом натрия или тайроном; Hg(II)-сульфит ионом; Nb(V) и Ta(V) –щавелевой кислотой, а Mo(VI) и W(VI)- фторидом натрия и щавелевой кислотой. При использовании 1 %-го раствора аскорбиновой кислоты определению не мешают Mn(VII), V(IV), Nb(V), Cr(VI), Mo(VI) и Fe(III). При использовании 0,01М раствора щавеловой кислоты определению не мешают V(IV), Nb(V), Ta(V), Cr(III), Mo(VI), W(VI) и Fe(III). Кроме того Nb(V), Ta(V) и Ti(IV) с ДТБФ и Ам образуют комплексы в более кислой среде.
Таблица 2
Влияние посторонних ионов на определение меди сДТФ иАм. (взято 30мкг Cu(II))
|
Ион |
Мольный избыток иона |
Маскирующий реагент |
Найдено,мкг |
RSD (%) |
|
Co(II) |
50 |
|
30,0 |
2 |
|
Ni(II) |
50 |
|
29,8 |
2 |
|
Fe(II) |
200 |
|
29,8 |
3 |
|
Cd(II) |
200 |
|
29,6 |
4 |
|
Al(III) |
180 |
30,0 |
2 |
|
|
Fe(III) |
60 |
Щавелевая кислота |
30,2 |
4 |
|
Zr(IV) |
50 |
29,8 |
3 |
|
|
W(VI) |
25 |
Щавелевая кислота |
29,6 |
5 |
|
Hg(II) |
30 |
30,2 |
5 |
|
|
Ti(IV) |
30 |
тайрон |
29,6 |
3 |
|
V(IV) |
20 |
тайрон |
29,6 |
3 |
|
Mo(VI) |
10 |
Фторид натрия |
30,4 |
4 |
|
Cr(III) |
120 |
29,8 |
4 |
|
|
Nb(V) |
50 |
Фторид натрия |
30,1 |
5 |
|
Ta(V) |
50 |
Фторид натрия |
30,1 |
5 |
|
|
50 |
|
29,2 |
4 |
Относительное стандартное отклонение на основе трех определений
На основании уравнений градуировочных графиков рассчитывали предел фотометрического обнаружения и предел количественного определения меди в виде ионных ассоциатов [19].
В таблице 3 приведены калибровочные характеристики тройных комплексов Сu-ДТФ-Ам.
Таблица 3
Аналитические характеристики для тройных комплексов Сu-ДТБФ-Ам
|
Параметр |
Сu-ДТФ-Ан |
Сu-ДТФ-мАн |
Сu-ДТФ-дАн |
|
Уравнение градуировочных графиков |
у = 0,035 + 0,425x |
у = 0,032 + 0,466 x |
у = 0,039 + 0,489x |
|
Коэффициент корреляции |
0.9993 |
0.9995 |
0.9995 |
|
Линейный диапазон градуировочных графиков, мкг/мл |
0.05–3.2 |
0.05–3.2 |
0.05–3.4 |
|
Предел обнаружения нг/ см3 |
10,50 |
9,70 |
8,60 |
|
Предел количественного определения, нг/ см3 |
34,65 |
32,31 |
28,38 |
|
Чувствительность, нг/ см2 |
2,19 |
1,99 |
1,91 |
В табл. 4 приведены данные, позволяющие сравнить аналитические характеристики методик определения меди с некоторыми уже известными [1] методиками.
Таблица 4
Сравнительные характеристики методик определения меди
|
Реагент |
pH(растворитель) |
, нм |
10–4 |
|
|
Известные методики |
||||
|
Диэтилдитиокарбаминат |
4–11(четыреххлористый углерод) |
436 |
1,4 |
|
|
Купроин |
4–7(изоамиловый спирт) |
546 |
0,64 |
|
|
Неокупроин |
3–10(изоамиловый спирт) |
454 |
0,79 |
|
|
Предлагаемые методики |
||||
|
Дтф+мАн |
4.4–5.3 (хлороформ) |
534 |
3,21 |
|
|
ДТФ+дАн |
4.5–5.5 (хлороформ) |
536 |
3,35 |
|
Определение меди в сталях. Навеску стали (около1г) растворяли в 10 мл смеси концентрированных кислот HCl и HNO3 в соотношении 3:1. После полного растворения добавляли 5 мл H2SO4(1:1) и полученный раствор выпаривали до прекращения выделения паров SO3. Прибавляли 30 мл воды, 2–3 мл 30 % раствора H2O2 и нагревали до кипения. Нерастворимый осадокотфильтровывали через сухой бумажный фильтр, осадок промывали дважды дистиллированной водой. Фильтрат и промывные воды собирали в мерную колбу емкостью 100 мл и после охлаждения разбавляли дистиллированной водой до метки. Отбирали аликвотную часть полученного раствора, переносили в делительную воронку, создали рН 5 и 2,2 мл 0,01 М дтф. После тщательного перемешивания прибавляли 2,8 мл 0,01 М мАн. Объем органической фазы доводили до 5 мл хлороформом, а общий объем — до 25 мл дистиллированной водой. Смесь встряхивали 5 мин. После расслаивания фаз светопоглощение экстрактов измеряли на КФК-2 при 540 нм в кювете с толщиной 0,5 см. Содержание меди находили по градуировочному графику.
Результаты экспериментов представлены в табл. 5. Как видно из таблицы, результаты определения меди в стали свидетельствуют о достаточной надежности предлагаемых методик.
Таблица 5
Правильность ивоспроизводимость определений меди встали (с16б, Cu-0,219%). n=6, Р=0,95
|
Метод |
|
Сходимость,% |
SD |
RSD,% |
|
|
Диэтилдитио-карбаминат |
0,214 |
98,5 |
0,0120 |
5,6 |
0,214±0,012 |
|
Дтф+мАн |
0,216 |
99,0 |
0,0110 |
5,1 |
0,216±0,011 |
|
ДТФ+дАн |
0,220 |
101,5 |
0,0094 |
4,3 |
0,220±0,010 |
Определение меди внефти. Для определения содержания меди в нефти в фарфоровую чашку с диаметром 90 мм брали с точностью 0,001г навеску 40г испытуемого топлива и сжигали в соответствии ГОСТ 1461–75. Затем фарфоровую чашку с золой помещали в муфель при температуре 550±20оС и выдерживали при этой температуре 1 час. После охлаждения в чашку добавляли 5 мл HCl (1:1), кипятили ее содержимое до объема 2мл и добавляли к нему 0,5г безводного Na2CO3; затем чашку помещали на 2–3 минуты в муфель, нагретый до 800оС. После охлаждения остаток в чашке растворяли в 5 мл дистиллированной воды, дважды фильтровали через один и тот же фильтр в мерную колбу с вместимостью 50 мл, промывали осадок 2–3 раза дистиллированной водой, промывные воды присоединяли к фильтрату и нагревали до объема около 25 мл, переносили в колбу с емкостью 25 мл, подкисляли прибавлением 1–2 мл конц. HCl и объем раствора довели до метки дистиллированной водой. Отбирали аликвотные части и добавляли к ним одинаковые объемы сульфата меди (30 мкг Cu(II)). Содержание меди определяли разработанными экстракционно-спектрофотометрическими методами по прописи, описанной при построении градуировочных графиков. Разработанные методики определения меди контролировали фотометрически — диэтилдитиокарбаминатом.
Правильность и воспроизводимость определения меди в нефти показаны в табл. 6.
Таблица 6
Правильность ивоспроизводимость определений меди внефти (n=6, Р=0,95)
|
Метод |
|
Сходимость,% |
S |
Sr |
|
|
Калмас СК № 416 |
|||||
|
Диэтилдитио-карбаминат |
1,12·10–2 |
98,5 |
0,000381 |
0,034 |
(1.12±0.04)·10–2 |
|
Дтф+Ан |
1,14·10–2 |
99,0 |
0,000296 |
0,026 |
(1.14±0.03)·10–2 |
|
ДТФ+дАн |
1,15·10–2 |
101,5 |
0,000368 |
0,032 |
(1.15±0.04)·10–2 |
|
Грязевая сопка СК № 416 |
|||||
|
Диэтилдитио-карбаминат |
1,16·10–2 |
102 |
0,00045 |
0,039 |
(1.16±0.05)·10–2 |
|
Дтф+Ан |
1,18·10–2 |
101 |
0,00033 |
0,028 |
(1.18±0.03)·10–2 |
|
ДТФ+мАн |
1,19·10–2 |
99 |
0,00045 |
0,024 |
(1.19±0.05)·10–2 |
|
НГД СК № 318 |
|||||
|
Диэтилдитио-карбаминат |
1,46·10–2 |
104 |
0.00054 |
0,037 |
(1.46±0.06)·10–2 |
|
ДТФ+Ан |
1,45·10–2 |
102 |
0.00056 |
0,038 |
(1.45±0.07)·10–2 |
|
Дтф+мАн |
1,49·10–2 |
98 |
0.00054 |
0,043 |
(1.49±0.06)·10–2 |
|
СК № 129 |
|||||
|
Диэтилдитио-карбаминат |
1,24·10–2 |
98 |
0.00059 |
0.048 |
(1.24±0.06)·10–2 |
|
ДТФ+мАн |
1,28·10–2 |
98 |
0.00049 |
0.039 |
(1.28±0.05)·10–2 |
|
Дтф+дАн |
1,29·10–2 |
103 |
0.00057 |
0.044 |
(1.29±0.06)·10–2 |
Литература:
- Марченко З., Бальцежак М. К. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе. М.:Бином. Лаборатория знаний. 2007. 711с.
- Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. М.: Мир, 1975. С. 286.
- Archana R Kocharekar and N V Takkar //Journal of Sciens & Industrial Research. Vol. 63. 2004. p. 283
- D. Rekha, K. Suvardhan, K. Suresh Kumar, P. Reddyprasad, B. Jayaraj and P. Chiranjeev // J. Serb. Chem. Soc. (2007) 72 (3) p 299–310
- Agnihotri NK, Singh VK, Singh HB // Talanta. 1997; 45 (2), p 331–341.
- M. Jamaluddin Ahmed and Tasnima Zannat. // Pak. J. Anal. Environ. Chem. (2012), Vol. 13, No. 1. p 22–35
- Рустамов Н. Х., Рустамова У. Н. // Молодой ученый. 2012. № 8. С. 47–50.
- Кузнецов В. В. Применение органических аналитических реагентов в анализе неорганических веществ. М.: МХТИ.1972. 145 с.
- Вердизаде Н. А., Амрахов Т. И., Кулиев К. А., Залов А. З. //Журн. аналит. химии. 1997. Т.52. № 10. С.1042.
- Вердизаде Н. А., Залов А. З., Аллахвердиев М. А., Ибрагимов Г. И. //Тез. докл. межд. Конференции «Экстракция органических соединений». Воронеж, 2010. С.171.
- Вердизаде Н. А., Залов, Кулиев К. А., Абаскулиева У. Б., Ибрагимов Г. И. // Всероссийская конференция «Химический анализ», Тезисы докладов. М.: ИОНХ. 2008.С.97.
- Коростелев П. Т. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР, 1964. 401с.
- Булатов М. И., Калинкин И. П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия, 1986. 432c.
- Назаренко В. А., Бирюк Е. А. // Журн. аналит. химии.1967.Т.12. № 2. С. 463.
- Назаренко В. А. // Тр. комис. по аналит. химии АН СССР. М.: Наука, 1969. Т. 17. С.22.
- Накaмато К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536c.
- Беллами Л. Инфракрасные спектры сложных молекул. М.:1963. 592с.
- Ахмедли М. К., Клыгин А. Е., Иванова Л. И., Баширов Э. А. // Журн. неорган. химии. 1974. Т. 19. № 8. С. 2007.
- Дорохова Е. Н., Прохорова Г. В. Аналитическая химия (физико-химические методы анализа). М.: Высшая школа, 1991. С. 250.
Похожие статьи
Синтез и спектральные характеристики комплексов 1,3-дифенилтриазенов меди, марганца и кобальта
Синтезированы комплексные соединения 1,3-дифенилтриазенов меди, марганца и кобальта. Методами ИК-, электронной спектроскопии, химического, рентгенфазового и термогравиметрического анализов изучен состав и строение полученных комплексов. В соответстви...
Эффект влияния концентрации оксида магния на физико-химические и каталитические свойства высококремнеземных цеолитов типа ЦВМ в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации магния на физико-химические и каталитические свойства НЦВМ в реакции алкилирования толуола изопропанолом. На основании данных полученных методами ТПД аммиака и ВЕТ, показано, что в результате химического модифицирования п...
Синтез и исследование структуры и свойств комплексных соединений двухвалентного марганца со смешанными лигандами (2-амино-3-гидроксипропионовая кислота и карбамид)
Синтезировали сложные комплексы марганца (II) с серин и карбамид (L1-серин (C3H7NO3), L2-karbamid ((NH2) CO), [MnL1L2Cl2], [MnL1L2(H2O)2]Cl2, в различных средах. С помощью химического, ИК-спектрального и термогравиметрического анализа установлены сос...
Эпоксидирование некоторых полициклических мостиковых олефинов в присутствии модифицированного полиоксомолибденового соединения
Изучено эпоксидирование полициклических мостиковых олефинов, синтезированных на основе С5-С7 циклических непредельных углеводородов и их некоторых производных гидропиритом (аддуктом Н2О2 и СО(NH2)2) в присутствии фосфорномолибденового гетерополисоеди...
Влияние концентрации иттербия на свойства высококремнеземного цеолита ЦВН в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации иттербия на текстурные, кислотные и каталитические свойства цеолита ЦВН в реакции алкилирования толуола изопропанолом в интервале температур 300–350°С. На основании данных, полученных с помощью методов термопрограмированн...
Влияние природы катионов переходных элементов на каталитические свойства цеолита типа CaY в реакции алкилирования о-ксилола третбутанолом
Изучено алкилирование о-ксилола трет-бутанолом на цеолитах типа У модифицированных переходными элементами. Установлена высокая активность цеолитных катализаторов содержащих два многозарядных катиона (FeCaNaY, CrCoCaNaY и CoCaNaY) и показано, что пере...
Эффект модифицирования Н-пентасила фосфором в реакции алкилирования бензола этанолом
Изучено модифицирующее влияние фосфором на физко-химические свойства Н-пентасила в реакции алкилирования бензола этанолом. Модифицирование фосфором сопровождается химическим взаимодействием с цеолитом, что приводит к изменению его кислотных и текстур...
Амперометрическое комплексиметрическое титрование ионов некоторых благородных металлов и ртути(II) тионалидом и тиомочевиной
Показана возможность титрования некоторых благородных металлов и ртути. Установлено что при образовании комплексов тионалид и тиомочевины с исследованными нами металл в конечной точке титрования их молярное соотношение с реагентами 1:1 для Ag+, 1:2 P...
Синтез и свойства n-алкил-производных изомеров метилциклопентена
Синтезированы и охарактеризованы ранее неизвестных представители N-алкил-2(5)-метилциклопентил метанола на основе продуктов реакции трехкомпонентной конденсации изомеров метилциклопентена с формальдегидом и галогенводородных кислоты выходом 83–92 %. ...
Превращение природного газа и метанола на цеолитах типа пентасила, модифицированных нанопорошками Zr, Cr и Mo
Изучено совместное промотирующее влияние нанопорошков циркония, хрома и молибдена на каталитические свойства цеолита типа пентасила в процессе конверсии природного газа и метанола в ароматические углеводороды (АРУ). Показано, что добав-ки Zr, Cr к Mo...
Похожие статьи
Синтез и спектральные характеристики комплексов 1,3-дифенилтриазенов меди, марганца и кобальта
Синтезированы комплексные соединения 1,3-дифенилтриазенов меди, марганца и кобальта. Методами ИК-, электронной спектроскопии, химического, рентгенфазового и термогравиметрического анализов изучен состав и строение полученных комплексов. В соответстви...
Эффект влияния концентрации оксида магния на физико-химические и каталитические свойства высококремнеземных цеолитов типа ЦВМ в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации магния на физико-химические и каталитические свойства НЦВМ в реакции алкилирования толуола изопропанолом. На основании данных полученных методами ТПД аммиака и ВЕТ, показано, что в результате химического модифицирования п...
Синтез и исследование структуры и свойств комплексных соединений двухвалентного марганца со смешанными лигандами (2-амино-3-гидроксипропионовая кислота и карбамид)
Синтезировали сложные комплексы марганца (II) с серин и карбамид (L1-серин (C3H7NO3), L2-karbamid ((NH2) CO), [MnL1L2Cl2], [MnL1L2(H2O)2]Cl2, в различных средах. С помощью химического, ИК-спектрального и термогравиметрического анализа установлены сос...
Эпоксидирование некоторых полициклических мостиковых олефинов в присутствии модифицированного полиоксомолибденового соединения
Изучено эпоксидирование полициклических мостиковых олефинов, синтезированных на основе С5-С7 циклических непредельных углеводородов и их некоторых производных гидропиритом (аддуктом Н2О2 и СО(NH2)2) в присутствии фосфорномолибденового гетерополисоеди...
Влияние концентрации иттербия на свойства высококремнеземного цеолита ЦВН в реакции алкилирования толуола изопропанолом
Изучено влияние концентрации иттербия на текстурные, кислотные и каталитические свойства цеолита ЦВН в реакции алкилирования толуола изопропанолом в интервале температур 300–350°С. На основании данных, полученных с помощью методов термопрограмированн...
Влияние природы катионов переходных элементов на каталитические свойства цеолита типа CaY в реакции алкилирования о-ксилола третбутанолом
Изучено алкилирование о-ксилола трет-бутанолом на цеолитах типа У модифицированных переходными элементами. Установлена высокая активность цеолитных катализаторов содержащих два многозарядных катиона (FeCaNaY, CrCoCaNaY и CoCaNaY) и показано, что пере...
Эффект модифицирования Н-пентасила фосфором в реакции алкилирования бензола этанолом
Изучено модифицирующее влияние фосфором на физко-химические свойства Н-пентасила в реакции алкилирования бензола этанолом. Модифицирование фосфором сопровождается химическим взаимодействием с цеолитом, что приводит к изменению его кислотных и текстур...
Амперометрическое комплексиметрическое титрование ионов некоторых благородных металлов и ртути(II) тионалидом и тиомочевиной
Показана возможность титрования некоторых благородных металлов и ртути. Установлено что при образовании комплексов тионалид и тиомочевины с исследованными нами металл в конечной точке титрования их молярное соотношение с реагентами 1:1 для Ag+, 1:2 P...
Синтез и свойства n-алкил-производных изомеров метилциклопентена
Синтезированы и охарактеризованы ранее неизвестных представители N-алкил-2(5)-метилциклопентил метанола на основе продуктов реакции трехкомпонентной конденсации изомеров метилциклопентена с формальдегидом и галогенводородных кислоты выходом 83–92 %. ...
Превращение природного газа и метанола на цеолитах типа пентасила, модифицированных нанопорошками Zr, Cr и Mo
Изучено совместное промотирующее влияние нанопорошков циркония, хрома и молибдена на каталитические свойства цеолита типа пентасила в процессе конверсии природного газа и метанола в ароматические углеводороды (АРУ). Показано, что добав-ки Zr, Cr к Mo...











