Синтезированы и охарактеризованы ранее неизвестных представители N-алкил-2(5)-метилциклопентил метанола на основе продуктов реакции трехкомпонентной конденсации изомеров метилциклопентена с формальдегидом и галогенводородных кислоты выходом 83–92 %. Путем замещения атомов галогена, полученных (2-хлор(бром)-2(5)-метилциклопентил)метанолов с вторичными аминами, синтезированы соответствующие [2-(N-алкил)-2(5)-метилциклопентил]метанолы с хорошими выходами, гидроксильная группа которых расположена в метиленовом фрагменте боковой цепи. Строение синтезированных продуктов доказано при помощи элементного анализа, ИК- и 1 Н и 13 С ЯМР- спектроскопии. Полученные аминоспирты испытаны в качестве антимикробных присадок к смазочным маслам и установлено, что они эффективно подавляют жизнедеятельность микроорганизмов.
Ключевые слова: метилциклопентены, формальдегид, конденсация, хлор(бром)метил-циклопентилметанолы, вторичные амины, N-алкил-метилциклопентилметанолы, антимикробные и бактерицидные свойства.
Аминоспирты с С 5 -С 12 с алициклическими фрагментами содержащие различные функциональные группы и одновременно гетероатомы, такие как азот и сера, в молекуле, универсальные «строительные блоки» для создание разнообразных новых синтетических аналогов природных биологически активных веществ [1]. Эти соединения также являются ценными продуктами или полупродуктами и используются для получения материалов технического назначения, как эффективных добавок для улучшения качеств масла и топлив обладающие бактерицидными и противовирусными свойствами [2–5]. Они так же интересные как удобные синтоны для получения фармацевтических и лекарственных препаратов с широким спектром свойств: антимикробными, противотуберкулезными, противомалярийными, анальгетическими, и анти-ВИЧ активностью [6–10].
Сведения о получении гидроксиамин-производных с циклопентановыми структурными фрагментами в литературе весьма ограничены.
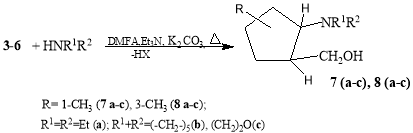
В продолжение наших исследований в области получения содержащих NH 2 - группы алициклических спиртов [10–13] в данной работе приведены результаты синтеза и изучения свойств новых [2(5)-(N-алкил)-5(2)-метилциклопентил]метанолов. С этой целью в начале реакцией эквимольных количеств изомеров 1-метил- или 3-метилциклопентена (1,2) с формальдегидом и хлор(бром)водородных кислоты, трехкомпонентный реакцией по реакции Манниха получали (2-галоген- 2(5)-метилциклопентил)метанолы (3–6) (схема 1). Далее, с последующим замещением атома галогена первичными или вторичными аминами (диэтиламин, пиперидин, морфолин) щелочной среде (40 %-ный раствор NaOH в воде или пропан-2-оле) при 50–60 0 С в течение 3–4 ч получали ранее неизвестные [2(5)-(N-алкил)-5(2)-метилциклопентил] метанолы 7(а-с) и 8(а-с) гидроксильная группа которого расположена в баковой метиленовым фрагменте (схема 2).
Обсуждение результатов
В качестве исходного сырья были использованы изомеры 1- и 3-метилциклопентены. Установлено. что реакции конденсации этих изомеров с формальдегидом и галогенводородных кислоты (в условиях мономеризации параформа) приводят к образованию [2-хлор(бром)-2(5)метилциклопенте-нил] метанолов 3–6 водну стадии (схема 1):
Схема 1
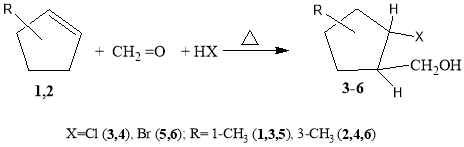
Реакция [2-хлор(бром)-2(5)метилциклопентенил]метанолов 3–6 спервичными или вторичными аминами приводит к аминоспиртам 7а-с и 8а-с ( схема2):
Схема 2
Экспериментальная часть
Исходные изомеры метилциклопентена(МЦПЕ) получены по известной методике [14] путем дегидратации циклогексанола в циклогексен и изомеризации последнего при 430–450 0 С над активной γ-Al 2 O 3 , предварительно модифицированного соединениями циркония и объемной скоростью 0.5 ч -1 . Индивидуальные изомеры выделены из продуктов дегидратации и изомеризации, четкой ректификацией из него было выделено 65 % 1-СН 3 -ЦПЕ (Т.кип.75 0 С, П ᴅ 20 1.4333, ԁ 4 20 0.7869) и 35 % смесь 3- и 4- СН 3 -ЦПЕ (Т.кип.65 0 С, П ᴅ 20 1.4222, ԁ 4 20 0.7624). По данным газожидкостного хроматографического (ГЖХ) анализа чистота 1- СН 3 -ЦПЕ составляет 99.5 % а 3- СН 3 -ЦПЕ содержит незначительное количества 4- СН 3 -ЦПЕ.
Реакцию конденсации изомеров метилциклопентенов с формальдегидом и галогенводородных кислоты проводили в автоклаве. По завершении реакции реактор охлаждают до комнатной температуры, содержимой вливают, моют водой до нейтральной реакции (по лакмусу), высушивают и подвергают вакуумной разгонку и выделяют целевой продукт.
Получение аминоспиртов проводили в стеклянном реакторе снабженной магнитной мешалкой, термометром и капельной воронкой. По завершении реакции и после разгонки растворителей выделяют аминоспирт. ГЖХ анализы проводили на хроматографе Цвет-500 с ПИД колонка 2000 х3 мм. фаза — полиэтиленгликольсукцинат (ПЭГС) на хромосорбе (5 мас %), газ-носитель — гелия, т.кол =120–140°С, т.исп =220–240°С.
Влияние соединений 7а-с и 8а-с на антимикробную свойства масла «М-11» изучали, применяя их растворы в указанном масле в концентрации 0.25–1 %. Антимикробные свойства определены термовлагокамере методом лунки. Опыты проводили при температуре 28–30 0 С в течение 2–3 суток. В качестве теста микроорганизмов использовали грибные и бактериальные культуры.
Антимикробную активность соединений 7а-с и 8а-с изучали методом серийных разведений на нескольких штаммах микроорганизмов. В качестве питательной среды использовали мясопептонный агар (МПА) с рН 7.2–7.4 (для бактерий) и среду Сабура (для грибов). Степен разведения была 1:200; 1:800; 1:1600; 1:3200. В качестве эталонов для сравнения были использованы в тех же разведениях спирт, фенол, хлорамин, риванол и нитрофунгин. Высевы проводили через 10, 20, 30, 40 и 60 мин для грибов и бактерий.
Строение полученных соединений подтверждали с помощью ИК-, ЯМР 1 Н, 13 С спектроскопии и элементного анализа. ИК-спектры синтезированных соединений снимали на Фурье-спектрометре Alpha в диапазоне 400–4000 см -1 в виде суспензий в вазелиновом масле и таблетках КВr. Спектры ЯМР 1 Н и 13 С зарегистрировали на импульсном Фурье-спектрометре фирмы “Bruker” при рабочей частоте 300.18 и 75 МГц, соответственно в растворителе СНD 3 . В качестве внутреннего стандарта использовали сигнал дейтерий-хлороформа СНD 3 (δ Н 7.25, δ С 77.00 м.д.) при комнатной температуре. Элементный анализ выполнен на приборе «Tru Spes Mikro Leco Corporatin» (USA).
В опытах использовали коммерческие амины фирмы Alfa Aesar (A. Johonson Malthey Co) диэтиламин, пиперидин и морфолин, также циклогек-санол, циклогексен, «хч».
(2-Хлор-2-метилциклопентил)метанол (3). В автоклав к 82 г (1 моль) 1-СН 3 -ЦПЕ прибавляли 75г формалина и 110 г 33 % раствора НСl. Реакционную смесь 3–4.5 ч при 110–20 0 С и по завершении процесса реактор охлаждали до комнатной температуры и количественно переносили в стакан с объемом 0.5 л. Выпавший слабо желтой маслянистой осадок отфильтровывали и дополнительно промывали водой до нейтральной реакции (по лакмусу), высушивали над безводной сернокислой натрий и подвергли вакуумной разгонке. Выход 128.8 г (92 %), т. кип. 225–6°С. ИК — спектр . см -1 : 3570. 3480(.OH), 2920 s , 2865 а s , (CH 3 ), 2860, 2848 с ( s ,CH 2 ), 1055 (,OH), 710–778 (C-Cl) [16, 17]. ЯМР 1 H, (СНD 3 ), , м.д. [18, 19]: 1.67c (3H, CH 3 ), 1.36–1.83 м (6H. 3CH 2 ), 1.91д(1Н, Н ССН 2 ОН, J 7.1Гц), 3.39 т (1H. C Н а Н в ОН J 7.1 Гц),3.60 т (1H. CН а Н в ОН J 7.1 Гц), 3.67 уш.c. (H, OH).]. ЯМР 1 3 С, (СНD 3 ), , м.д.: 60 ( С Н 2 ОН), 54.5( С -Сl), 51.8 ( С СН 2 ОН), 44( С Н 2 С-Сl), 30( C H 3 C-Cl), 25( С Н 2 С-CH 2 OH), 20,8(CH 2 С Н 2 СH 2 -CH 2 OH) [23,24]. Найдено. %: С 56.74; Н 8.78; Cl 23.98. C 6 H 13 ClO. Вычислено. %: С55.98; H 8.81; Cl 23.93.
Соединения 4–6 получены аналогично.
[2-(Диэтиламино)-2-метилциклопентил]метанол (7а) получен из 7.35г (50ммоль) 3 (2- хлор-2-метилциклопентил)метанола и 7.3 г (100 ммоль) диэтиламина. Выход 6.43 г (87.6 %). т.пл. 63–5°С. ИК спектр. .см -1 : 3630 (ОН), 3340. 3125 (C-N), 2960. 2895 (СН 3 ), 2940–2920. 2850 ( s СН 2 ),.1935. 1658.1460 ( а s СН 2 ), 1320. 1280. 1250(, С-N). 1048 (δ. ОН). Спектр, ЯМР 1 Н, (СНD 3 ), δ. м.д.: 1.05т (6Н. N<(CH 2 С Н 3 ) 2 , J 8.2 Гц), 1.39с (3Н. НОС-С Н 3 ). 1.37–1.68м (6Н. 3СН 2 ).1.83м(1Н, Н С-СН 2 ОН), 2.45д [4H.СN<(C H 2 CH 3 ) 2 . J 8.1 Гц], 3.39 т (1H. C Н а Н в ОН J 7.1 Гц),3.60 т (1H. CН а Н в ОН J 7.1 Гц), 3.67 уш.c. (H, OH).]. ЯМР 13 С, (СНD 3 ), , м.д.: 65.6 (СН 3 - С -N<), 60.8(HС- С H 2 OH), 48.5 (H С -СH 2 OH), 47.8 [N<( С Н 2 CН 3 ) 2 ], 41.4( С Н 2 С-СN<), 26.3(2 C H 2 ), 25.5( С Н 2 СH-CH 2 OH), 14 [N<(СН 2 C Н 3 ) 2 ], Найдено, %: С 70.93; Н 12.51; N 7.58 С 11 Н 23 NО. Вычислено, %: С 71.36; Н 12.48; N 7.56.
[2-Метил-2-(пиперидин-1-ил)циклопентил]метанол(7 b ) получен из 7.35г (50ммоль)(2-бром-2- метилциклопентил)метанола 5, и 8.5 г (100 ммоль) пиперидина. Выход 6.44 г (84.3 %). т.пл. 90–2°С. ИК спектр. .см -1 : 3930. 3370 (ОН). 2960 (CН 3 ), 2940. 1450 (СН 2 ), 2950, 1620, 1595 (СN), 1056 (.ОН). Спектр. ЯМР 1 Н, (СНD 3 ), δ. м. д.: 1.38с (3Н. С Н 3 СN<), 1.34–1.58м (12Н. 6СН 2 ),1.83т(1Н, Н ССН 2 ОН), 2.48 д [4Н. N<(С Н 2 СН 3 ) 2 . J 7.2 Гц], 3.36 д (1H. C Н а Н в ОН J 8.1 Гц),3.61 д (1H. CН а Н в ОН J 8.1 Гц), 3.67 уш.с (1Н. CH 2 О Н ) ЯМР 13 С,(СНD 3 ), , м.д.: 66.9 (СН 3 - С -N<), 60.8(HС- С H 2 OH), 49.4 [N<( С Н 2 CН 3 ) 2 ], 48.7 (H С -СH 2 OH),41.4( С Н 2 С-СN<), 26.3(3 C H 2 ), 25.5( С Н 2 СH-CH 2 OH), 24.6 [N<(СН 2 CН 2 ) 2 > C H 2 ], Найдено. % С 73.12; Н 11.89; N 7.11 С 12 Н 23 NО. Вычислено. %: С 72.58; Н 11.64; N 7.16.
[2-Метил-2-(морфолин-4-ил)циклопентил]метанол (7с) получен из 7.35г (50ммоль) ( 2-бром-2-метилциклопентил)метанола 5 и 8.8 г (100 ммоль) морфолина. Выход 15.0 г (85.6 %), т.пл. 101–3°С (из пропан-2-ола). ИК спектр,.см -1 :3493 (.ОН), 3374. 3320(.СN), 2950. 2940 (. СH 2 ).1620.1596 (. СN), 1240. 1300. 1180 (,COC),1054 (.OH). ЯМР 1 H, (СНD 3 ), . м. д.: 1.39с (3Н. С Н 3 CN<, J 6.7 Гц), 1.34–1.58 м (6H. 3CH 2 ). 1.83 т (1H. H CСН 2 ОН, J 7.1 Гц), 2.69д [4H.СНN<(С Н 2 СН 2 ) 2 О, J 7.2 Гц], 3.61 д [4H. СНN<(СН 2 С Н 2 ) 2 О, J 7.2 Гц], 3.67 уш.с(1H. СН 2 О Н ). ЯМР 13 С,(СНD 3 ), , м.д.: 67.5 О<( С Н 2 ) 2 , 66.7 (CH 3 C N<), 60.8( C H 2 OH), 48.6( С CH 2 OH), 41.4 (( С Н 2 C CН 3 , 48.7 (H С -СH 2 OH),41.4( С Н 2 С-СN<), 26.3( C H 2 и C H 3 ), 25.5( С Н 2 СH-CH 2 OH), Найдено. %: С 66.55; Н 10.86. N 7.26, C 1 1 H 2 1 NO 2 .Вычислено. %:С 66.33; Н 10.55;N 7.04
[2-(Диэтиламино)-5-метилциклопентил)метанол (8а) получен 7.3г (100 ммоль) (2-хлор-5-метилциклопентил)метанoла 4 и 7.3 г (100 ммоль) диэтиламина. Выход 8.1 г (89.6 %), т.кип. 126–8°С. (2.5 мм. рт. ст.). ИК спектр .см -1 : 3630 (ОН), 3340. 3125 (C-N), 2960. 2895 (СН 3 ), 2940–2920. 2850 ( s СН 2 ),.1935. 1658.1460 ( а s СН 2 ), 1320. 1280. 1250(, СN). 1050 (δ. ОН). Спектр, ЯМР 1 Н, (СНD 3 ), δ. м.д.:0.98 д (3Н,С Н 3 СН,J 7.2 Гц), 1.05т (6Н. N<(CH 2 С Н 3 ) 2 ,J8.2 Гц), 1.67к (1Н. Н С-СН 3 , 1 J= 2 J=7.1, 3 J=6.8 Гц), 1.83м (1Н, Н С-СН 2 ОН), 2.43д [4H.СN<(C H 2 CH 3 ) 2 , J 8.1 Гц], 2,65д [1Н, Н СN< (CH 2 CH 3 ) 2 , J 7.1 Гц], 3.39 д (1H. C Н а Н в ОН J 7.1 Гц),3.63 д (1H. CН а Н в ОН J 7.1 Гц), 3.67 уш.c. (H, OH).]. ЯМР 13 С, (СНD 3 ), , м.д.: 67.2 ( С -N<), 60.8( С H 2 OH), 50.3 (N- С H 2 CH 3 ) 2 , 44.9( С НCН 2 OH), 35( С НСH 2 ), 32( C H 2 ), 20.6( С Н 2 СH), 18.4 (СН C Н 3 ), 13.8 СN<(CH 2 C H 3 ) 2 . Найдено, %: С 69.97; Н 12.53; N 7.55 С 11 Н 23 NО. Вычислено, %: С 71.36; Н 12.48; N 7.56.
[2-Метил- 5 -( пи пе ридин -1-ил)циклопентил]метанол(8b) получали 7.35 г (50 ммоль) (2-бром-5-метилциклопентил)метанола 6, и 8.5 г (100 ммоль) пиперидина. Выход 6.62 г (86.6 %). т.пл. 60–2°С (из пропан-2-ола). ИК спектр. .см -1 : 3930. 3370 (ОН). 2960 (CН 3 ), 2940. 1450. (СН 2 ). 1620. 1595 (СN),2950, 1320.1280 (, -N<), 1110. 1095 (.ОН). Спектр. ЯМР 1 Н, (СНD 3 ), δ. м. д.: 1.33с (3Н. С Н 3 СНОН). 1.43–1.76м (12Н. СН 2 ). 2.48 д [4Н. N<(С Н 2 ) 2 . 2 J 7.4 Гц]. 2.73 т (1Н. Н СN< 1 J 6.9 Гц). 3.67 уш.с (1Н. Н ОCCH 3 ) Найдено. % С 71.96; Н 11.38; N 7.25 С 11 Н 21 NО. Вычислено. %: С 72.13; Н 11.47; N 7.61.
[2-Метил-5-(морфолин-4-ил)циклопентил]метанол (8с) получили 7.35 г (50 ммоль) (2-бром-5- метилциклопентил)метанола 6 и 8.8 г (100 ммоль) морфолина. Выход 6.88 г (89.5 %), т.пл. 75–7°С (из пропан-2-ола). ИК спектр,.см -1 :3493 (.ОН), 3374. 3320(.СN), 2950. 2940 (. СH 2 ).1620.1596 (. СN),1240. 1300. 1180 (,COC), 1052 (.OH). ЯМР 1 H, (СНD 3 ), . м. д.: 0.98 д (3Н,С Н СН 3 . J 6.9 Гц), 1.36–1.75 м (5H. 2CH 2 ,СН). 1.84 д (1H. H CСН 2 ОН, J=7.1 Гц), 2.68д [4H. N<(СН 2 ) 2 , J 7.2 Гц], 3.39 д (1H. C Н а Н в ОН J 7.1 Гц), 3.58 д [4Н. О<(CH 2 ) 2 J 7.2 Гц], (3.63 д (1H. CН а Н в ОН J 7.1 Гц), 3.67 уш.c. (H, OH).]. Найдено. %: С 66.05; Н 10.28. N 6.95.C 11 H 21 NO 2 .Вычислено. %:С 66.33; Н 10.55;N 7.05
Соединения 7(а-с) и 8(а-с) были испытаны в качестве антимикробных присадок маслам. Испытание проводилось в масле «М-11» (ГОСТ-9–052–75).
В качестве тест-культур были использованы грибные (Aspergillus niger, Candida tropicalis) и бактериальные (Pseudomonas aeruginosa) культуры. Результаты испытаний приведены в таблице.
Как видно из представленных данных таблицы испытуемые соединения: [2-(диэтиламино)-2-метил- и 2-(диэтиламино)-5-метилцикло-пентил]-метанол (7а и 8а), [2-метил-2-(пиперидин-1-ил)- и 2-метил-5-(пиперидин-1-ил) циклопентил]метанол (7b и 8b), [2-метил-2-(морфолин-4-ил)- и 2-метил-5-(морфолин-4-ил) циклопентил]метанол (7с и 8с), обладают бактерицидными и фунгицидными свойствами и эффективно действуют на подавление роста микроорганизмов в масле «М-11» при концентрации 0.25–0.5 %, при этом соединения (7а) и (8а) показывают более высокую эффективность, чем остальные соединения, и выше, чем у промышленной присадки 8-оксихинолин, взятой в качестве эталона. Остальные соединения показывают близкие к эталону результаты.
Таким образом, использование олефинов циклического строения в многокомпонентной реакции конденсации является перспективным методом, который позволяет придать определенные функциональные свойства исходным реагентам, обладающим полезными свойствами, без изменения их углеродной структуры.
Таблица
Результаты испытаний антимикробных свойства [2(5)-( N -алкил)-5(2)-метилциклопентил] метанола 7(а-с) и 8(а-с) в масле М-11.
|
Соединение |
Концентрация присадки, % |
Диаметр зоны угнетения микроорганизмов, в см * | ||
|
Грибы |
Бактерии | |||
|
Aspergillus niger |
Condida tropicalis |
Pseudomonas aeruginosi | ||
|
M-11 + 7а |
1.0 |
39 |
35 |
31 |
|
0.50 |
19 |
17 |
15 | |
|
0.25 |
14 |
13 |
12 | |
|
M-11 + 7b |
1.0 |
27 |
31 |
32 |
|
0.50 |
13 |
16 |
18 | |
|
0.25 |
12 |
11 |
12 | |
|
M-11 + 7c |
1.0 |
27 |
33 |
32 |
|
0.50 |
14 |
18 |
17 | |
|
0.25 |
13 |
14 |
11 | |
|
M-11 + 8а |
1.0 |
40 |
37 |
33 |
|
0.50 |
21 |
19 |
17 | |
|
0.25 |
15 |
14 |
12 | |
|
M-11 + 8b |
1.0 |
28 |
32 |
33 |
|
0.50 |
14 |
17 |
18 | |
|
0.25 |
13 |
13 |
12 | |
|
M-11 + 8c |
1.0 |
27 |
32 |
33 |
|
0.50 |
15 |
15 |
17 | |
|
0.25 |
12 |
11 |
13 | |
|
M-11 + 8 –окси-хинолин (этанол) |
1.0 |
28 |
28 |
36 |
|
0.50 |
14 |
14 |
16 | |
|
0.25 |
9 |
8 |
14 | |
|
А) M-11 |
0 |
+ |
+ |
+ |
* A) (+)-обильный рост микроорганизмов вокруг лунки в чашке Петри.
Соединения 7(а-с) и 8(а-с) были испытаны на антимикробную активность. Изучение антимикробных свойств соединений проводили в сравнении с применяемыми на практике препаратами, этанол, карболовой кислотой (фенол), хлораминами, риванолом и нитрофунгином. Антимикробную активность веществ изучали методом серийных разведений. В качестве тест-культур брали грамотрицательные (кишечная и синегнойная палочки), грамоположительные (золотистый стафилококк), спороносные (антракоид) бактерии и дрожжеподобные грибы (род Кандида). Результаты, полученные при изучении антимикробной активности, показали, что испытуемые соединения 7(а-с) и 8(а-с) проявляют относительно более ярко выраженную антимикробную активность, чем применяемые на практике реагенты.
Благодарности
Работа выполнена в рамках государственного задания Института Нефтехимических Процессов имени Ю. Г. Мамедалиева НАН Азербайджана.
Финансирование работы
Работа выполнена при финансовой поддержке НАН Азербайджана.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Информация о вкладе авторов
Авторы: О. А. Садыгов. Н. А. Пашабейли принимали участие в разработке и в проведении экспериментальных реакций по синтезу изомеров метилциклопентена их гидроксибромированию, эпоксидирования и аминолиза продуктов реакции.
Литература:
- Bergmeier S. C. The Synthesis of Vicinal Aminoalcohols.// Tetrahedron. 2000.Vol. 56. N. 17. Р. 2561. Doi 101016/S 0040–4020(00)00149–6.
- Kулиев А. М. Химия и технология присадок к маслам и топливам.М.:Химия,1985.245 с.
- Пальчиков В. А. Морфолины. Синтез и биологическая активность// ЖОрХ. 2013, Т. 49, Вып.6. С. 807–831. [PalʹchikovV. A. Russ.Org.Chem. 2013, 49, 787–831] doi 10.1134/S1070428013060018.
- Matheu R., Ertem M. Z., Gimbert-Surinach C., Benet-Buchholz J., Sala X., Llobet A., Hydrogen Bonding Rescues Overpotential in Seven-Coordinated Ru Water Oxidation Catalysts.//ACS Catal.2017,7,6525–6532.doi10.1021/-acscatal.7b01860.
- Ахметова В. Р., Хаурулина Р. Р., Надыргулова Г. Р., Кунакова К. С., Джемилев У. М. Мультикомпонентная гетероциклимеризация амидов карбоновых кислот с H 2 S и H 2 O. // ЖОрХ. 2008, Т. 44, Вып.2. С. 200–206.
- Basappa C. S., Kumar A., Nanjunda S., Sugahara K., Rangappav K. S., Anti-tumor and anti-angiogenic activity of novel hydantoin derivatives: Inhibition of VEGF secretion in liver metatestatic osteosarcoma cells.// Bioorg. Med.Chem.2009,17. P.4928–34.
- Burmistrov V., Morisseau C., Lee K. S. S., Shihaih T. R., Butov G. M., Hammock B. D., Simmetric adamantly diureas as soluble epoxide hydrolase inhibitors.//Bioorg.Med.2014,24,2193.
- Heinemann F., Karges J., Gasser G., Critical Overview of the Use of Ru(II)Polypyridyl Complexes as Photo sensitizers in One-Photon and Two-Photon Photodinamic Therapy.//Acc.Chem.Res.2017,50,2727–2736.doi 1021/acs.ac-counts.7b00180.
- KuchnelM.F., Orchard K. L., Dalle K. E., Reisner E. Selective Photocatalytic CO 2 Reduction in Waterthrugh Anchoring of Molekular Ni Catalyst on CdS Nanocrystals.// J.Am.Chem.Soc.2017, 139,21.7217–7223. Doi1021/jacs.7b0–0369.
- Машковский М. Д. Лекарственные средства: В 2т- Изд. 14-е, М.: Новая волна 2002. Т.1, 540 с.; Т.2, 608 с.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И., Бабаев Н. Р. Однореакторный синтез N-замещенных алкиламиноциклогексанолов путем присоединения электрофильных реагентов, образующихся in situ в системе H 2 O 2 -HBr(HCl).// ЖОХ. 2018. Т. 88. Вып. 4. С. 566–573. Doi 10.1134/S10700363218040072.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И. Индуктивное гидроксигалогенироване бицикло [2.2.1]гептенов и синтез аминоспиртов на основе продуктов реакции. // ЖОХ. 2018. Т. 88. Вып. 5. С. 717. Doi 10.1134/S107036328050031.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И., Бабаев Н. Р. Синтез циклододекан и декагидро-1.4-этанонафталин гидроксиаминов.// ЖОрХ,2020.Т. 56. Вып. 6. С.893–899. Doi10.31857/S051474922006–00063
- Пашабейли Н. А., Садыгов О. А., Индуктивное гидроксибромирование изомеров метилциклопентена и синтез N-замещенных производных на основе продуктов реакции.// «Молодой ученый», 2021. № 12(354). С.6–11.
- Мусаев М. Р., Гайдаров Э. Э., Ахмедова Р. Э. // Определение состава и структуры продуктов окисления метилциклопентенов кислородам воздуха. Аз. хим. журнал, 1978, Вып.4. С.47–49.
- Larkin P. J. Infrared and roman spectroscopy principal and spectral interpretation. Stamford, Elsevier. 2011, 230 p.; Поисковая база спектральных данных органических веществ (Spectral database for organic compounds. National Institute of Advanced Industrial Science and Technology Japan): http:// riodb 01.ibase.aist.go.jp
- Преч Э., Бюлман Ф., Аффольтер К. Определение строения органических соединений. М.:Мир,2006,439с.
- Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. М.: БИНОМ, Лаборатория знаний. 2011,520с.
- Дероум Э. Современные методы ЯМР для химических исследований. М: Мир. 1992. 410 c.

