Проведено введение и пирамидирование генов устойчивости к пирикуляриозу Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b в генотипы отечественных сортов риса. ДНК-маркерный анализ позволил выявить устойчивые к болезни образцы риса, несущие 3 целевых генов в гомозиготном состоянии. Разработана система мультиплексной ПЦР для идентификации в гибридном потомстве одновременно двух генов устойчивости к патогену Pi-1+Pi-2, Pi-ta+Pi-33, Pi-ta+Pi-b.
Ключевые слова: рис, гены устойчивости к пирикуляриозу, SSR- маркеры, мультиплексная ПЦР.
ВВЕДЕНИЕ
Несовершенный гриб Magnaporthe grisea (Herbert) Barr Yaegashi &Udagawa (анаморф Pyricularia grisea, пирикуляриоз) является фитопатогеном широкого спектра действия, охватывающего большинство семейств сельскохозяйственных культур, в том числе и риса. Экономический ущерб, наносимый заболеванием, значителен во всех зонах мирового рисосеяния и достигает высоких цифр [1].
Создания «иммунных» сортов риса — источников устойчивости к данному патогену и быстрое внедрение их в производство является наиболее перспективным решением в борьбе с этим заболеванием. Их возделывание позволит сократить до минимума применение фунгицидов на рисовых полях и обеспечит пищевую безопасность продукции рисовой отрасли.
Однако, обеспечение устойчивости — одно из самых трудных направлений селекции. Вредители и особенно болезни имеют большой потенциал изменчивости, что в сочетании с их колоссальными способностями к размножению обеспечивает патогену высочайшие приспособительные возможности [2].
Объединение нескольких эффективных генов устойчивости на генетической основе элитных сортов — это результативная стратегия селекции на устойчивость к высоковариабельным грибным патогенам.
По многолетним исследованиям фитопатологов гены рисоспецифической устойчивости к пирикуляриозу Pi-zt, Pi-ta2, Pi-b и Pi-ta являются эффективными для юга России [3]. Гены Pi-taи Pi-b сиквенированы. Гены Рi-1, Рi-2, Рi-33 относят к генам широкого спектра резистентности риса к патогену [4]. Исследования показывают, что наибольший эффект перечисленные гены проявляют при совместном действии [5, 6].
Сорта риса, возделываемые на территории юга России, не обладают вышеуказанными эффективными генами устойчивости.
В связи с этим целью данной научной работы является создание устойчивых к пирикуляриозу сортов и линий риса с использованием методов молекулярного маркирования.
Исходя из поставленной цели, в ходе исследований предусматривалось выполнение следующих задач:
1. Выполнить программу по введению и пирамидированию генов устойчивости к пирикуляриозу Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b в отечественные, высокопродуктивные сорта риса.
2. Провести оценку созданного селекционного материала на наличие в генотипе вышеуказанных генов методом ПЦР.
3. Разработать системы мультиплексной ПЦР для идентификации в гибридном потомстве одновременно несколько выше указанных генов.
4. Оценить созданный селекционный материал по комплексу количественных признаков в условиях вегетационного и полевого опытов.
5. Выполнить фитопатологический тест для оценки созданного селекционного материала на устойчивость к краснодарской популяции патогена.
МЕТОДИКА.
В качестве доноров переносимых генов устойчивости (отцовская форма) использовали линии зарубежной селекции C101-A-51 (донор гена Pi-2), C101-Lac (донор генов Pi-1, Pi-33), IR-36 (донор гена Pi-ta), BL-1 (донор гена Pi-b). Предварительная оценка линий-доноров на чувствительность к местной популяции возбудителя пирикуляриоза, путём инокуляции растений риса культурой гриба, показала устойчивость тестируемых линий. Однако в условиях юга России данные линии-доноры проявили себя как позднеспелые, с вегетационным периодом 140–155 дней и характеризовались низкой фертильностью. В местной зоне рисосеяния возможно возделывание сортов, созревающих не более чем за 125 дней.
Материнской формой послужили высокопродуктивные районированные сорта риса Флагман и Снежинка.
При гибридизации растений использовали пневмокастрацию материнских форм и опыление «ТВЕЛЛ» — методом [2].
Из листовой пластинки гибридных растений ВС-популяций всех комбинаций были выделены образцы ДНК СТАВ-методом с модификациями [7]. Экстракцию ДНК проводили буфером следующего состава: 1М Tris-HCl (pH 7.5), 5M NaCl, 0.5M EDTA (pH 8.0), 10 % SDS. Часть листа (2–3см) растирали в 500 мкл экстрагирующего буфера в пластиковой пробирке объемом 1,5 мл. Образцы инкубировали при 65º С в течение 3 часов. Затем охлаждали до комнатной температуры. Супернатант отделяли центрифугированием при 12000 об/мин. К перенесенной в чистую пробирку верхней фазе добавляли 250 мкл изопропанола, оставляли на 10 минут, предварительно перемешав. После этого образец центрифугировали 5 минут при 12000 об/мин, полученный осадок промывали 250 мкл 70 % этанола, высушивали и растворяли в 50 мкл 0,1*ТЕ. В ПЦР смесь добавляли по 3 мкл раствора ДНК, выделенного данным методом.
ПЦР проводили по стандартной методике, но с предварительной оптимизацией её параметров.
При подборе комбинаций молекулярных маркеров, вносимых в реакционную смесь, учитывали их температуру отжига; разницу в размерах ПЦР-продуктов, синтезируемых в ходе амплификации с праймерными парами и самокомплементарность их последовательностей.
В ПЦР смесь вносили как смесь ДНК сортов-стандартов с целевыми генами устойчивости, так и ДНК гибридных образцов, несущих комбинацию генов Pi-1+Pi-2, Pi-33+Pi-ta, Pi-ta+Pi-b.
На начальном этапе нами были апробированы ДНК-маркеры на два гена Pi-1+Pi-2 (рис.1), Pi-33+Pi-ta (рис.2),Pi-ta+Pi-b (рис. 3) резистентности к патогену. Для идентификации генов Pi-1, Pi-2, использовали известные из литературных источников праймерные пары фланкирующих микросателлитных SSR-маркеров RM224+ RM527+SSR140 (сиквенс праймерных пар доступен на сайте gramene.com). Для идентификации генов Pi-33+Pi-ta использовали праймерные пары фланкирующих микросателлитных SSR-маркеров RM310+RM72 + праймерные пары кодоминантного SSR — маркера PitaF1/PitaR1 и PitaF2/PitaR2, созданного в нашей лаборатории [8]. Для идентификации генов Pi-ta+Pi-b — праймерные пары кодоминантного SSR — маркера PitaF1/PitaR1 и PitaF2/PitaR2 + праймерные пары кодоминантного SSR — маркера Pib4, Pib5 и Pib6, также созданного в нашей лаборатории [9, 10].
Мультиплексную ПЦР проводили с 40–50 нг ДНК, 0,1 µМ dNTPs, 25mM KCL, 60 mM Tris-HCL (pH 8,5), 0,1 % Тритон Х-100б 10 мМ 2-меркаптоэтанол, 1,5 mM MgCL2, 1 единица Taq-полимеразы и 0,3 µМ праймеров в конечном объёме 25 мкл. Амплификацию осуществляли в ДНК-амплификаторе «Терцик», оптимизировав при этом условия ПЦР. Это позволяет получать высокий выход целевых амплифицированных фрагментов наряду с минимальным количеством неспецифичных амплификатов: 1) Начальная денатурация- 5 минут при 94°С -1 цикл. 2) 35 циклов: денатуация — 35 сек при 94°С; отжиг праймеров 45 сек при 60° С; синтез 30 сек при 72°С. 3) Синтез 5 мин при 72°С -1 цикл.
При электрофорезе использовали 8 %-ный полиакриламидный гель. После электрофореза гелевые пластины помещали на 20–30 минут в раствор бромистого этидия (5 мкг/мл) и фотографировали в ультрафиолетовом свете.
РЕЗУЛЬТАТЫ.
На основе использования технологии ДНК-маркерной селекции (marker assisted selection — MAS — селекция с применением ДНК маркеров к генам интереса) нами проведено введение генов устойчивости к пирикуляриозу Pi-ta, Pi-b, Pi-1, Pi-2, Pi-33 в высокопродуктивные отечественные сорта риса (Флагман и Снежинка), адаптированные к агроклиматическим условиям рисосеяния юга России. Эта стратегия была использована нами для придания этим сортам длительной устойчивости к заболеванию.
Серия проведенных скрещиваний и отборов позволила получить гомозиготные линии риса на основе сортов Флагман и Снежинка с пирамидированными генами устойчивости к пирикуляриозу Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b (рис.1–3). В течение всех циклов возвратных скрещиваний перенос доминантных аллелей каждого гена в потомстве контролировался тесно сцепленными молекулярными маркерами. Растения, в генотипе которых аллели устойчивости не обнаруживали, выбраковывали.
Для повышения экономической эффективности маркерной селекции при проведении ПЦР-анализа нами разработана система мультиплексной (мультапраймерной) ПЦР, позволяющая определять одновременно последовательности двух генов Pi-1+Pi-2, Pi-33+Pi-ta и Pi-ta+Pi-b (рис. 1–3) резистентности к Magnoporthe grisea (Herbert) Barr в геномной ДНК гибридных растений при постановке одной реакции. Это существенно снижает себестоимость анализов в количество раз, равное количеству идентифицируемых генов за одну реакцию.
На рисунке 1 представлены результаты апробации комбинации пар праймеров, фланкирующих маркерные участки целевых генов Pi-1 и Pi-2.
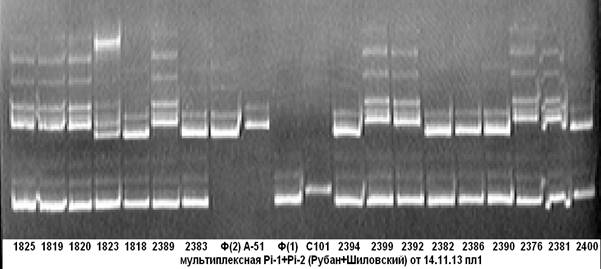
Рис. 1. Мультиплексная ПЦР на гены устойчивости к пирикуляриозу
Pi-1+Pi-2
Примечание: 1825–2400 — гибридные растения; С101- линия С101Lac-донор гена Pi-1; А-51- линия С101А-51-донор гена Pi-2; Ф — сорт Флагман.
Из электрофореграммы видно, что образец под № 2400 несёт доминантную аллель гена устойчивости к пирикуляриозу Pi-1, все остальные анализируемые образцы на ген Pi-1 несут аллель материнской формы (сорт Флагман); у образцов под № № 1825–1820, 2389, 2399, 2392, 2376, 2381 несущих доминантную аллель гена устойчивости к пирикуляриозу Pi-2, присутствует специфичный для неё ПЦР-продукт. Чёткость идентификации на электрофореграмме даёт возможность безошибочно определить наличие доминантных аллелей целевых генов.
На рисунке 2 представлены результаты мультиплексной ПЦР на присутствие в одном генотипе одновременно двух генов устойчивости к пирикуляриозу Pi-33+Pi-ta.
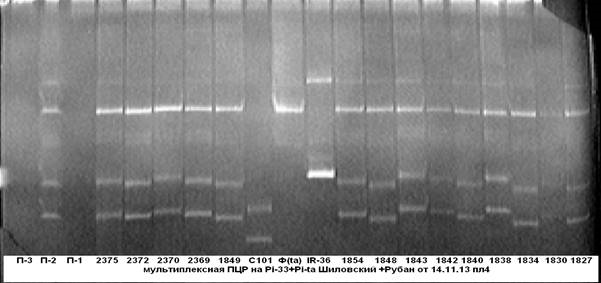
Рис. 2. Мультиплексная ПЦР на гены устойчивости к пирикуляриозу
Pi-33+Pi-ta
Примечание: 1827……2375 — гибридные растения; С101- линия С101Lac- донор гена Pi-33; IR-36- линия IR-36-донор гена Pi-ta; Ф — сорт Флагман.
Из электрофореграммы видно, что у образцов под № № 1838, 1843 и 2370, несущих доминантные аллели генов устойчивости к пирикуляриозу Pi-33 и Pi-ta, присутствует специфичный для них ПЦР-продукт.
На рисунке 3 представлены результаты ПЦР- анализа на наличие в этих же анализируемых гибридных образцах гена Pi-b.
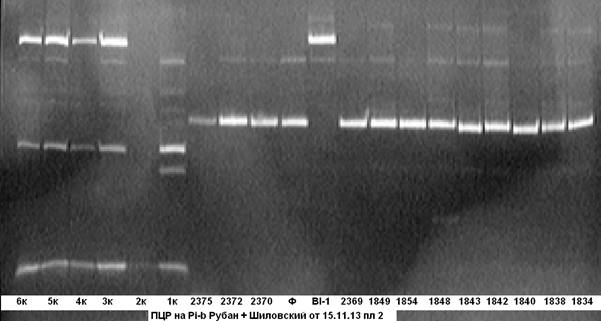
Рис. 3. ПЦР на ген устойчивости к пирикуляриозу Pi-b
Примечание: 1834……6к — гибридные растения; Bl- линия BL-1- донор гена Pi-b; Ф — сорт Флагман.
Из электрофореграммы видно, что анализируемые гибридные образцы № № 1к- 6к несут доминантную аллель гена Pi-b, остальные образцы несут аллель материнской формы.
В ходе дальнейшей работы нами была апробирована и отобрана комбинация праймерных пар на гены Pi-ta+Pi-b (рис. 4, 5).
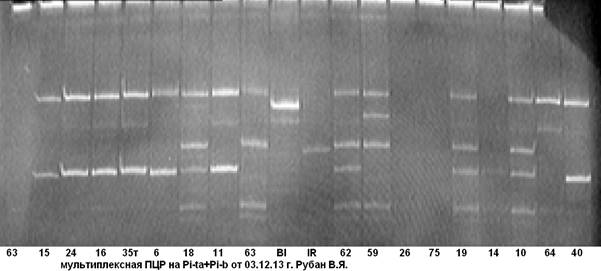
Рис. 4. Мультиплексная ПЦР на гены устойчивости к пирикуляриозу Pi-ta+Pi-b
63……40 — гибридные растения; Bl- линия Bl-1- донор гена Pi-b; IR- линия IR-36-донор гена Pi-ta.
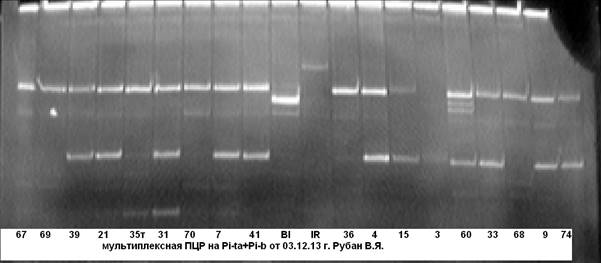
Рис. 5. Мультиплексная ПЦР на гены устойчивости к пирикуляриозу Pi-ta+Pi-b
Примечание: 67……74 — гибридные растения; Bl- линия Bl-1- донор гена Pi-b; IR- линия IR-36-донор гена Pi-ta.
Из рисунков 4, 5 видно, что анализируемые гибридные образцы № № 18 и 60 несут доминантную аллель генов Pi-taи Pi-b. Чёткость идентификации на электрофореграмме даёт возможность безошибочно определить наличие доминантных аллелей целевых генов.
Разработанная мультиплексная технология идентификации одновременно нескольких генов устойчивости к пирикуляриозу внедрена нами в систему маркерной селекции риса по созданию резистентных к патогену генресурсов риса.
В текущем 2013 году в условиях полевого опыта на рисовой оросительной системе ВНИИ риса лабораторией защиты риса был проведен фитопатологический тест полученных линий с пирамидированными генами устойчивости к пирикуляриозу Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b. Инокуляцию растений проводили культурой гриба, выделенной из гербарного материала, собранного на полях Краснодарского края при 105 конидий/мл, что соответствует 10–14 спорам в поле зрения микроскопа.
Растения заражали в полевых условиях инфекционного питомника в фазы кущение, вымётывание – цветение из расчета 0,5 мл на одно растение. При обработке использовали опрыскиватель. В суспензию добавляли прилипатель Квин из расчёта 1 капля на литр воды. В качестве контроля использовали устойчивый сорт риса Авангард. Учёт степени поражения растений проводили на 14 день после инокуляции.
Оценку осуществляют, учитывая два показателя: тип реакции (в баллах), используя при этом десятибалльную шкалу Международного института риса [11]; интенсивность развития болезни ИРБ (в процентах), согласно экспресс-методу оценки сортовой устойчивости риса к пирикуляриозу [11]:
— устойчивые — 0–1 баллов — отсутствие поражения, мелкие коричневые пятна, покрывающие менее 25 % общей поверхности листьев;
— среднеустойчивые — 2–5 баллов — типичные пирикуляриозные пятна эллиптической формы, 1–2 см длиной, покрывающие 25,1–50 % общей поверхности листьев;
— неустойчивые — 6–10 баллов — типичные пирикуляриозные пятна эллиптической формы, 1–2 см длиной, покрывающие 50,1 и более % общей поверхности листьев.
Результаты фитопатологического теста, проведенного в рамках программы интродукции генов Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b в отечественные сорта риса Флагман и Снежинка представлены в таблице 1.
Таблица 1
Результаты фитопатологического теста, проведенного в рамках программы интродукции генов Pi-1, Pi-2, Pi-33, Pi-ta, Pi-b в отечественные сорта риса в 2013 г.
|
Образец |
Интенсивность развития пирикуляриоза, % |
Степень устойчивости | |
|
Введённые гены устойчивости к пирикуляриозу |
ИРБ, % | ||
|
1362 дл |
Pi-2, Pi-ta |
7,0 |
устойчив |
|
1360 |
Pi-b |
12,2 |
устойчив |
|
2646–154 |
Pi-2 |
13,3 |
устойчив |
|
1344 |
Pi-2, Pi-b |
15,6 |
устойчив |
|
1363 |
Pi-b, Pi-ta |
15,6 |
устойчив |
|
1364 |
Pi-b |
15,6 |
устойчив |
|
2661–575 |
Pi-2, Pi-b |
16,7 |
устойчив |
|
1359 |
Pi-2, Pi-b, Pi-ta |
17,8 |
устойчив |
|
1345 |
Pi-2, Pi-b |
17,8 |
устойчив |
Для селекции риса на современном этапе желательным является низкорослый тип растений, с высокой интенсивностью первоначального роста, устойчивый к полеганию, с высокопродуктивной метёлкой и неосыпающимися в фазу полной спелости колосками. Среди растений, которые по результатам ДНК-анализа, несли пирамидированные гены и при фитопатологической оценки на резистентность к патогену показали себя как устойчивые и среднеустойчивые, было отобрано несколько форм, совмещающих в себе скороспелость, низкорослость, неосыпаемость и фертильность колосков. Они были вовлечены в работу по схеме селекционного процесса и в 2013 году прошли испытание по комплексу признаков в контрольном питомнике.
Работа продолжается.
ВЫВОДЫ.
1. В результате проведенных исследований с помощью современных биотехнологических методов (молекулярное маркирование на основе ПЦР) в сочетании с традиционной селекцией в короткие сроки получены линии риса, в генотипе которых собрано три эффективных генов резистентности к пириуляриозу (Pi-2, Pi-b, Pi-ta), (Pi-2, Pi-b, Pi-33). Проведенная фитопатологическая оценка показала их устойчивость к патогену. Внедрение таких сортов в производство позволит избежать эпифитотийного развития болезни, сохранить биологическую урожайность риса и получать экологически чистую сельхозпродукцию.
2. Разработана схема мультиплексной ПЦР идентификации одновременно двух генов устойчивости в пирикуляриозу: Pi-1+ Pi-2, Pi-33+Pi-ta, Pi-ta+Pi-b. Её использование позволит значительно сократить затраты расходных материалов и время на выполнение анализа образцов с указанными пирамидированными генами резистентности к патогену, что повышает экономическую эффективность ДНК-маркерной селекции.
Литература:
1. Зеленский Г. Л. Перспективы создания сортов риса с высокой продуктивностью и адаптивными качествами // Рисоводство.- 2003 г. –
2. № 3. С. 11.
3. Зеленский Г. Л. Селекция сортов риса, устойчивых к пирикуляриозу, рисовой листовой нематоде и бактериальному ожогу в условиях Российской Федерации // Автореферат диссертации на соискание ученой степени д. с.-х. наук. — Краснодар. — Тип. КубГАУ. — 1993. — 49 с.
4. Дьяков Ю. Т., Озерецковская О. Л., Джавахия В. Г., Багирова С. Ф.//
5. Общая и молекулярная фитопатология. Москва. «Общество фитопатологов». — 2001. 301 с.
6. Хавкин Э. Е. Молекулярная селекция растений: ДНК-технологии создания новых сортов сельскохозяйственных культур // Сельскохозяйственная биология.- 2003. — № 3. — С. 26–41.
7. Коваленко Е. Д., Горбунова Ю. В., Ковалева А. А. и др. Методические указания по оценке устойчивости сортов риса к возбудителю перикуляриоза. — М., 1988. — 30 с.
8. Коломиец Т. М. Отбор исходного материала риса для селекции на иммунитет к пирикуляриозу // Автореферат диссертации на соискание ученой степени кандидата биологических наук. — Голицыно, 1990.- 21 с.
9. Murray M. G. Rapid isolation of high molecular weight plant DNA/ Murray M. G., Thompson Genomt.- V. 40.-p. 379–378.
10. Мухина Ж. М., Токмаков С. В., Мягких Ю. А., Дубина Е. В. Создание внутригенных молекулярных маркеров риса для повышения эффективности селекционного и семеноводческого процессов.// Полиматический сетевой электронный научный журнал КубГАУ.- 2011- № 67 (03).
11. Мухина Ж. М., Коломиец Т. М., Волкова С. А., Дубина Е. В., Супрун И. И., Токмаков С. В., Мягких Ю. А. Создание внутригенных ДНК-маркеров и их использование в практической селекции риса // Труды Кубанского государственного аграрного университета. — 2009. — № 3(22), Краснодар.- С.63–67.
12. Ж. М. Мухина, Т. Коломиец, С. А. Волкова, Е. В. Дубина, И. И. Супрун, С. В. Токмаков, Ю.Мягких. Создание внутригенных ДНК-маркеров и их использование в практической селекции риса // Сб. Пятого Международного конгресса.- Москва, 2009. — С. 261.
13. Лабораторный экспресс-метод оценки сортовой устойчивости риса к пирикуляриозу. А. А. Аверьянов, В. П. Лапикова, Г. Г. Петелина. — Большие Вяземы: ВНИИФ, 1990.- 12 с.

