Были получены циклические металлоорганические производные ферроцена и цимантрена прямым оксиалкилированием литиевых производных ферроцена (цимантрена) циклическими кетонами — циклопентаноном (циклогексаноном) в условиях межфазного катализа. Путем последующего взаимодействия синтезированных карбинолов с N,N — циклогексил(2-гидрок-си)пропиламином получены соответствующие эфирные производные ферроцена. Строение целевых продуктов доказано с помощью методов ЯМР 1Hи ИК-спектроскопии.
Ключевые слова:ферроцен, цимантрен, комплексообразование, циклопентанон, циклагексанон, ЯМР 1Н, ИК-спектроскопия.
Synthesized previously unknown cyclic organometallic ferrocene derivatives and direct cymantrene oxyalkylating lithium derivatives of ferrocene (cymantrene) cyclic ketones-cyclopentanone (cyclohexanone) under phase transfer catalysis. By subsequent reaction with synthesized carbinols N, N — cyclohexyl (2-hydroxy-phenoxy) propylamine obtained corresponding ether derivatives of ferrocene. The structure of final products using the methods shown 1H NMR and IR spectroscopy.
Keywords:ferrocene, cymantrene, complexation, cyclopentanone, tsiklageksanon, 1H NMR, IR spectroscopy.
Продолжение исследований в области синтеза и изучения свойств моно — LVC5H4C(R1R2)OH и биядерных [LMC5H4]2C(R)OH карбинольных производных ферроцена и цимантрена (где LM=C5H5Fe, (OC)3Mn, R1=alk, R2=aril, R1=R2) [1] явились эксперементальные данные по синтезу, установлению составов, структурных и некоторых других физико-химических характеристик ферроценил-,(цимантренил-), циклопентил-, (циклогексил-)металлоорганических(карбинольных) производных:
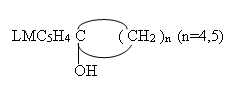
Для получения вышеуказанных соединений, были осуществлены реакции между литиевыми производными ферроцена — C5H5FeC5H4Li , цимантрена — (OC)3MnC5H4Li [1] как с циклопентаноном, так и циклогексаноном. Оказалось, что проведение реакции с участием литиевого производного ферроцена (C5H5FeC5H4Li) независимо от природы циклического кетона приводят не только к образованию ферроценилциклопентилкарбинольных (I) ферроценилциклогексилкарбинольных (II) производных, но и различных продуктов взаимодействия не прореагировавших в целевой реакции циклических кетонов с перекурсором получения литиевых производных метал-локомплексов-бутиллитием (Н-C4H9Li «BuLi»).
Установлено, что в присутствии смеси растворителей (гексан — тетрагидрофуран, ТГФ), взятых в соотношении (1:1), в результате взаимодействия между литиевым производным ферроцена и циклопентаноном (циклогексаноном) в температурном интервале 20÷40°C, в течении 2-3 часов происходит образование соответствующих металлоорганических производных ферроцена I и II с выходом 26-28 %.
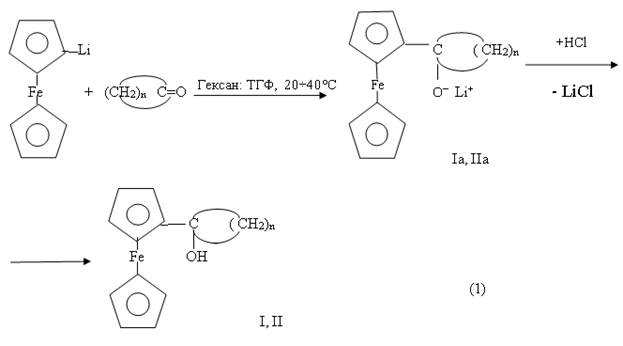
где в I и Ia, n=4 ; в II и IIa, n=5
Предполагаемой причиной образования ферроценилкарбинольных производных I и II по реакции (1) с достаточно низкими выходами является, во-первых, степень литирования ферроцена с участием BuLi, как в неполярных растворителях, например, в гексане, так и в полярных растворителях, например в ТГФ, не превышает 60-65 % [2]. Во-вторых, за счет низкой селективности процесса литирования , происходит образование смеси моно (C5H5FeC5H4Li) дизамещенных производных ферроцена (LiC5H4FeC5H4Li), параллельно вступающих во взаимодействие с циклическими кетонами, и тем самым усложняющих состав конечных продуктов реакции. В-третьих, вследствие нестабильности литиевых производных затруднен процесс их разделения, что обуславливает необходимость их совместного вовлечения в реакцию.
Следует также отметить, что синтезированные упомянутым способом как монолитиевые, так и дилитиевые производные ферроцена, из-за низкой стабильности, невозможно хранить и использовать как готовые реагенты в соответствующих реакциях (1).
Поэтому с целью обеспечения высокой селективности получения монолитийферроцена в процессе литирования ферроцена с помощью BuLi, были изучены как температурные факторы, так и сольватирующая способность растворителей, используемых для целевой реакции.
При этом обнаружено, что при температуре 10÷40°C, независимо от соотношения ферроцен : BuLi, как указывалось выше, наблюдается литирование обоих циклопентадиенильных колец ферроцена. В связи с этим образуется соль моно- и дилитийзамещенных производных ферроцена, разделение которой с получением индивидуальных соединений из-за легкого окисления и гидролиза, не представляется невозможным.
С другой стороны, при осуществлении взаимодействия ферроцена с BuLi при пониженной (-20 ÷ -40°C) температуре, в среде гексана наблюдается только следы продукта литирования, а в сильно полярных растворителях, например, в тетрогидрофуране и диметилсульфоксиде при этой же температуре взаимодействие протекает очень быстро, однако, не очень высокой селективностью.
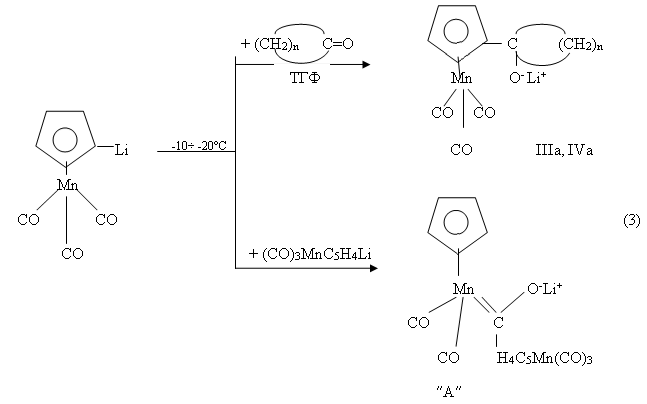
В условиях превращения литиевых производных ферроцена (1) исследовалась также возможность взаимодействия между литиевыми производными цимантрена (OC)3MnC5H4Li, полученных в условиях [3], как с циклопентаноном, так и с циклагексаноном (2). При этом обнаружено, что продуктами реакции в зависимости от температуры процесса являются либо литийкарбонилатные соли, как в случае ферроцена, либо соответствующие продукты присоединения цимонтренилциклопентила (циклогексил), либо же смеси карбеновых металлокомплексов [4].
Однако, в случае смешанного растворителя (гексан : ТГФ=1:1) и при температуре 0-10°C реакция протекает, с высокой селективностью и может служить в качестве оптимальной рецептуры для препаративного получения монолитийферроцена.
Так, например, реакция (2) при минусной температуре ( -10÷ -20°C) независимо от природы циклического кетона приводит к продуктам присоединения IIIa и IVa,которые при нейтрализации превращаются в соответствующие карбинольные производные III,IV.
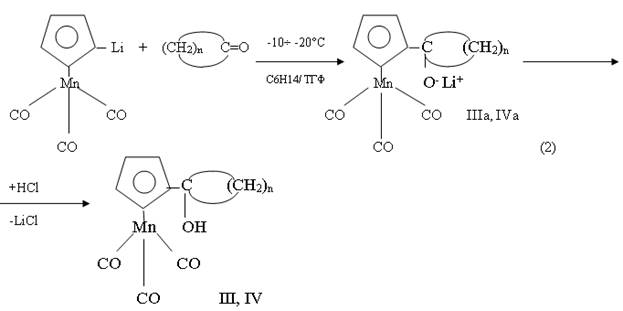
где n=4, IIIa, III; n=5, IVa, IV
Однако, если проводить эту реакцию в температурном интервале (10÷40°C), то ее продуктами (3) являются небольшие количества (8-10 %) IIIa, IVa, а остальное, согласно данным [5], является карбеновым комплексом Фишера ( ″А″ ) достаточно сложного строения.
Следовательно, в этих условиях, с участием молекул (OC)3MnC5H4Li происходит межмолекулярное взаимодействие одной из терминальных карбонильных групп (СО) с молекулой сореагента.
Как известно, в условиях (2) литиевые производные цимантрена (OC)3MnC5H4Li с ацетил- и формилцимантреном (OC)3MnC5H4COCH3 [5] и (OC)3MnC5H4CHO [5] образуют с достаточно высоким выходом, соответствующие гомобиядерных карбинольных металлокомплексов: [(OC)3MnC5H4]2C(R)OH (где R=H, CH3) [5].
Поэтому направления протекания обеих рассматриваемых реакций тесно связаны со структурными особенностями циклических кетонов. Строение образующегося в ходе этих реакций в температурном интервале ( -10÷ -20°C) карбен-ового комплекса ″А″ было доказано косвенно, методами ЯМР 1Н и ИК-спектроскопии в дейтерированномтетрогидрофуране (C4D8O).
Таким образом, синтез карбинольных производных ферроцена и циментрена в условиях реакций (1) и (2) представляет нам препаративно не выгодным, многостадийным процессом, причем выделение из реакционной смеси целевых продуктов с высокой степенью чистоты связано со многими техническими сложностями.
В связи с данным обстоятельством возник вопрос о разработке одностадийного и более удобного метода синтеза циклических карбинольных производных ферроцена и цимантрена.
С учетом упомянутых выше особенностей протекания реакций направленных на получение соединений I-IV по схемам (1) и (2) представляет важный научно-практический интерес их осуществление в условиях межфазного катализа. В качестве нерастворимых друг в друге фазообразователей были использованы вода (неорганический фазообразователь) и петролейный эфир (органический фазообразователь).
В органическую фазу вводятся реагирующие компоненты — ферроцен (цимантрен) и циклические кетоны, а в неорганическую фазу катализатор (H2SO4) и переносчик катализатора из неорганической фазы в органическую. Как было установлено ранее [4], из-за низкого значения рК=10-11, присоединение ферроцена к кетонам и альдегидам происходит только в условиях высокой кислотности. При подборе оптимальных условий для присоединения ферроцена (цимантрена) к циклическим кетонам, следует учесть не только соотношение органической фазы к неорганической (10:1), но и соотношение катализатора как взаимодействующим кетонам (1:1), так и переносчикам диэтиламинонафтенатной четвертичной соли (DEANaf). В нашем случае соотношение четвертичной аммониевой соли к катализатору было взято (1:10).
Результаты присоединения ферроцена и цимантрена к циклическим кетонам в условиях межфазного катализа проведены ниже.
|
Фаза |
Фазообразующие компоненты |
Соотношение компонентов |
Реагирующие компоненты |
Продукты присоединения |
|
органическая |
пэтролейный эфир |
10 |
ферроцен (цимантрен) и циклопентанон (циклогексанон) |
ферроценил (цимантренил) циклопентил (циклогексил) карбинолы |
|
неорганическая |
вода |
1 |
катализатор H2SO4 и его переносчик + - (C2H5)2(H)NOOCNaf |
катализатор H2SO4 и его переносчик + - (C2H5)2(H)NOOCNaf |
Оказалось, что в случае ферроцена, реакция присоединения к циклическим кетонам в предлагаемых условиях межфазного катализа начинается сразу же после введения переносчика DEANaf [3,4].
При повышении температуры от комнатной (20°C) до 40°C продукты присоединения — ферроценилциклопентил(циклогексил)металлоорганические(карбинольные) производные переходят в органическую фазу, и выделение их становится не сложной процедурой. Выход ферроценилкарбинольных производных I и II по ферроцену по этому методу составляло 87-91 %.
Однако, проведение реакции оксиалкилирования цимантрена с участием этих циклических кетонов в тех же условиях, что и ферроцена, приводит к частичному разрушению исходного металлокомплекса. Поэтому эту и подобные ей реакции следует проводить при более низких ( -10÷ -20°C) температурах. Вывод III-IV цимантренилметаллорганических(карбинольных) производных по цимантрену находился при этом в пределах 70-74 %.
Образующиеся в ходе реакции целевые продукты, такие, как ферроценил- , циклопентил- (циклогексил)карбинольные соединения ( I и II ), а также цимантренил-циклопентил(циклогексил)карбинольные производные ( III и IV ) из реакционной смеси были выделены следующим образом: сначала реакционный раствор упаривался досуха, а затем, остаток экстрагировался изопропиловым спиртом для выделения I-IV производных.
Методом микроанализа был установлен элементный состав карбинольных металлокомплексов, который соответствовал формулам: C15H18FeO (I) ; C16H20FeO (II) ; C13H13MnO4 (III) ; C14H15MnO4 (IV).
Оказалось, что карбинольные производные ферроцена (I и II) являются низкоплавкими соединениями с Тпл 68-71°C (I) и Тпл 58-60°C (II).
Что же касается карбинольных производных цимантрена (III и IV) то они оказались жидкими продуктами с относительной плотностью d20= 1.267 г/см3 (IV).
Установлено, что как производные ферроцена (I,II), так и производные цимантрена (III,IV) на открытом воздухе не гидролизуются и не окисляются.
Изучение реакционной способности полученных соединений (I-IV) показало,что в отличие от линейных и изоструктурных карбинольных производных ферроцена и цимантрена LMC5H4C(R1R2)OH [6, в присутствии каталитических количеств, например, метричные эфирные производные. Однако в этих условиях, с органическими кислотами по-видимому, из-за стерических факторов, не образуются каких-либо сложно эфирных производных (I-IV).
Тем не менее, производные I-IV, вступая в обменную реакцию при рН=8-9 с Na(K)OH, образуют соответствующие алкоголяты этих металлов, V-VIII.
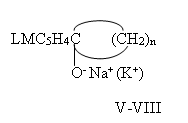
А их реакции в водно-спиртовой среде с Ba(OH)2 приводит, с очень низким выходом, к сольватному алкоголяту бария IX-X:
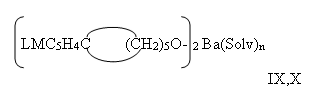
LM=C5H5Fe, IX; LM=(OC)3Mn, X; Solv=H2O, ТГФ, ROH, n=2-4.
При этом обнаружено, что как натриевые (калиевые) V-VIII, так и бариевые алкоголяты IX-X представляют собой порошки изменяющие цвет от бледно синего до темно синего, хорошо растворяющиеся в теплой воде, умеренно в спиртах, а бариевые сольватные алкоголяты — в различных марках бензина.
Они не характеризуются четкими температурами плавления, так как производные V-VIII разлагаются при температуре выше 180°C, а производные IX-X, разлагаются при температуре свыше 205°C [6] .
На примере ферроценилциклогексил(циклопентил)металлоорганических(карбинольных )производных (I) и (II) были изучены реакции с хиральными центрами. Так, на базе N,N — циклогексил-(2-гидрокси)пропиламина в кипящем ДМФО в присутствии H2SO4 — катализатора были получены соответствующие эфирные производные ферроцена (XI-XII):
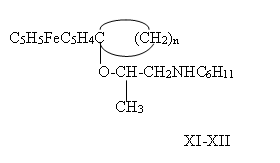
n=4 (XI); n=5 (XII).
Производные XI и XII оказались темно-коричневого цвета жидкостями
XI — Tкип=186-188°C, d20=1.467 г/см3 XII — Tкип=162-164°C, d20=1.4283 г/см3, ЯМР
1Н — спектр (в CDCl3): δС5Н4(α,β)=3.872; 3.913; 3.982, 4.061 м.д; δC5H5=4.10 м.д.
Строение полученных металлоорганических(карбинольных) производных ферроцена и цимантрена изучалось с помощью ИК и ЯМР 1Н спектральных методов.
Обнаружено, что ИК-спектральная полоса поглощения карбинольными группами в исходных соединениях для циклопентанона составляет νС=О 1678 см-1, а для циклогексанона νС=О 1690 см-1. В результате присоединения ферроцена и цимантрена в этих циклических кетонах наблюдались полосы поглощения карбинольных групп для ферроценильных производных (I,II) в области νОН 3420-2485 см-1, а для цимантренильных производных (III,IV) в области νОН 3390-3445 см-1. Причем, независимо от природы металлоорганического остатка наблюдаемые полосы находятся в области νОН 3420-3435 см-1 и νОН 3448-3485 см-1; для производных III,IV подобные полосы находятся в области νОН 3395-3412 см-1 и νОН 3415-3445 см-1. Согласно [5], полосы поглощения, находящиеся в более высокочастотной области спектра, следует отнести к валентным колебаниям свободных ОН групп, а полосы, проявляющиеся в виде умеренных рефлексов и находящихся в высокочастотной области спектра — к валентным колебаниям ОН групп координационных атомами Fe и Mn [5].
ЯМР1Н спектры для (I-IV) производных снятые в CCl4 при комнатной температуре, на приборе “Bruker-WP-200SY” показали, что введение как циклопентилкарбонильных, так и циклогексилкарбонильных заместителей в ЦПД кольце приводит к расщеплению α и β протонов ЦПД кольца, не зависимо от природы металлоорганического радикала. Так, например, в ЯМР1Н спектре у феррценилциклопентил(циклогексил-)карбинольных производных (I,II) — введение к ЦПД кольцо как циклопентилкарбинольных (I),так и циклогексилкарбинольных (II) заместителей приводит не только к расщеплению α и β — протонов замещенного ЦПД кольца, но и наблюдаемые сигналы появляются в виде двух триплетов. При этом, химические сдвиги этих сигналов для производных (I) составляют δС5Н4(α,β)=3.82 и 3.91 м.д, а сигналы протонов от незамещенного ЦПД кольца наблюдаются при δС5Н4=4.12 м.д. Для производных (II) химические сдвиги от протонов замещенного ЦПД кольца наблюдается при δС5Н4(α,β)=3.88 и 3.97 м.д, а для незамещенного — при δС5Н4=4.12 м.д, которые не зависимо от природы заместителей, в ЦРД кольце прктически не изменяются.
Что касается ЯМР1Н спектров производных III и IV, то они по своему расположению и характеру очень похожи на спектры производных I и II. При введении вышеуказанных карбинольных заместителей в ЦПД кольцо цимантрена (химические сдвиги протонов незамещенного ЦПД кольца находится при δC5H5=5.14 м.д) наблюдается расщепление α и β протонов, которое для соединения (III) арактеризуются химическими сдвигами, находящимися при δС5Н4(α,β)=4.68 и 4.92 м.д, а для IV при δС5Н4(α,β)=4.62 и 4.89 м.д. [6] . Установленные химические сдвиги от протонов (α и β протонов) замещенного ЦПД кольцав ЯМР1Н спектрах для производных I-IV, однозначно показывает, что карбинольные остатки введенные в ЦПД кольцо проявляют сильно электродонорные свойства [7].
Литература:
1. Сулейман Г.З., Литвишков Ю.Н., Кадырова Э.М., Рустамов М.И. и др. //Изв. Вузов. РФ. Химия и химическая технология. Иваново. 2005. Т.48. Вып.12. С.73-76.
2. Велиев Р.А., Кадырова Э.М., Курбанов З.Г., Сулейман Г.З. //Изв. Вузов, Химия и химическая технология. 2010. Т.53. Вып.1. С.70-74 .
3. Перевалова Э.Г, Решетова О.А., Грандберг К.И. Методы элементоорганической химии. Ферроцен. М: Наука. 1983. 498с.
4. Несмеянов А.Н., Перевалова Э.Г., Тюрин Э.Д. и др. Электрофильное замещение в ряду ферроцена // Изв. АН СССР.Сер.хим. 1976, № 9, с.178.
5. Гинзбург А.Г Химия π-циклопентадленильных комплексов марганца. Итоги науки и техники ВИНИТИ, сер. Координационная химия. Металлоорганическая химия. 1990. Т.2. С.1-160.
6. Сыркин В.Г. Карбинолы металлов. М.: Химия, 1992, 238c.
7. Сулейман Г.З., Литвишков Ю.Н., Кадырова Э.М. //Азерб. хим. журн. 2006. № 1. С.37-42.

