Изучена реакция жидкофазного окисления н-гексена-1 кислородом воздуха в соответствующий гидропероксид и использование его для алкилирования алифатических альдегидов с альфа-олефинами. Показано, что реакция окисления н-гексена-1 более селективно протекает в присутствии каталитического количества гидропероксида изопропилбензола.
Установлено, что в реакции свободнорадикального присоединения н-гексена-1 к ацетальдегиду в качестве инициатора можно использовать гидропероксид самого олефина.
Ключевые слова: свободнорадикальное присоединение, гидропероксид н-гексена-1, ацетальдегид.
Одним из перспективных путей синтеза алифатических кетонов, представляющих собой ценные душистые вещества для применения в составе парфюмерных композиций [1], а также промежуточные соединения органического синтеза может служить реакция свободнорадикального присоединения альфа — олефинов к ацетальдегиду и его гомологам.
Ранее была изучена реакция свободнорадикального присоединения циклоолефинов к ацетальдегиду в присутствии пероксидов –третбутила и третбутилпербензоата [2]. Однако вышеперечисленные инициаторы у нас в Республике не производятся, закупка их из зарубежных стран обходится дорого. С этой точки зрения для проведения реакции свободнорадикального присоединения представляет интерес в качестве инициатора использовать гидропероксид самого олефина, полученного инициированным окислением олефина кислородом воздуха.
В настоящей статье приведены результаты экспериментов по окислению н-гексена-1 в гидропероксидгексен и использование его в качестве инициатора в реакции присоединения алифатических альдегидов к альфа-олефинам С5-С10.
Экспериментальная часть
В качестве исходного сырья использованы алифатические углеводороды нормального строения, из алифатических альдегидов С2-С5 марки «Х.Ч».. Опыты по окислению α-олефинов проводили в стеклянном реакторе с обратным холодильником и термометром барботированием воздуха. Алкилирование альдегидов проводили под давлением собственных паров реагирующих компонентов в ампуле из нержавеющей стали.
Изомерный состав и чистота полученных кетонов определены методом ГЖХ. Наличие функциональных групп и строение синтезированных соединений установлены методами ИК и ЯМР.
Результаты иих обсуждение
Поиск оптимальных условий получения гидропероксида α-олефинов осуществлена на примере окисления н-гексена-1, по схеме (1)
![]() (1)
(1)
где: R= C2H5-; C3H7-; C4H9-; C5H11; C6H13-; C7H15
С целью нахождения оптимальных условий окисления олефинов кислородом воздуха изучено влияние различных параметров, природы и количества инициатора, взятого в реакцию окисления, температуры и продолжительности опытов на выход и состав продуктов реакции.
Результаты экспериментов по окислению н-гексена-1 кислородом воздуха приведены в табл.1.
Таблица 1
Условия ирезультаты опытов окисления н-гексена-1 кислородом воздуха (с участием 0,5% мас. гипериза)
|
Скорость подачи воздуха, мл /час |
Тем-ра, ºС |
Продолжительность, час |
Выход гидропероксида, % |
|
20 |
40 |
1 |
2,7 |
|
20 |
40 |
2 |
3,0 |
|
20 |
40 |
3 |
5,4 |
|
20 |
40 |
4 |
9,8 |
|
20 |
40 |
5 |
10,2 |
|
20 |
40 |
6 |
11,3 |
|
20 |
45 |
5 |
12,0 |
|
20 |
50 |
5 |
9,5 |
|
20 |
55 |
5 |
8,0 |
|
18 |
45 |
5 |
10,6 |
|
16 |
45 |
5 |
9,8 |
|
14 |
45 |
5 |
8,0 |
|
12 |
45 |
5 |
4,4 |
Таким образом, в результате проведенного исследования окисления
н-гексена-1 в присутствии 0,5 % мас. гипериза изучено влияние различных параметров на выход и состав продуктов реакции и найдены оптимальные условия синтеза гидропероксида н-гексена-1: скорость подачи воздуха 20 л/ч, температура 45º С и продолжительность 5 часов. Выход при описанных условиях составляет 10,2–12,0 % мас. на исходный олефин.
Полученный оксидат н-гексена-1 без предварительного выделения гидропероксида использовали для алкилирования алифатических альдегидов по схеме:
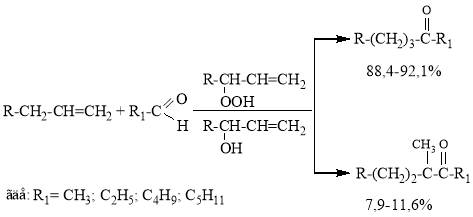 (2)
(2)
Для исследования влияния различных параметров на выход и состав продуктов и с целью разработки оптимальных условий процесса в качестве модели выбрана реакция ацетальдегида с оксидатом, состоящяя из смеси гексена-1 и его гидропероксида.
Изучено влияние различных параметров — мольного соотношения реагирующих веществ, содержания гидропероксида гексена в оксидате, температуры и продолжительности опытов на выход и состав продуктов реакции.
Результаты экспериментов по присоединению ацетальдегида к гексену приведены в табл. 2.
Таблица 2
Условия ирезультаты опытов присоединения ацетальдегида (I) кн-гексену-1(II) (кол-во гидропероксида 12% от массы олефина)
|
Количество оксидата в (г) |
Тем-ра, ºС |
Продность, час |
Мольное соотношениеII:I |
Выход метил-гексил-кетона,% мас. на исходный олефин |
Остаток % мас. на исходную смесь |
|
26.8 |
80 |
4 |
1:3 |
52.4 |
2.7 |
|
26.8 |
90 |
4 |
1:3 |
60.7 |
3.0 |
|
26.8 |
100 |
4 |
1:3 |
66.5 |
3.7 |
|
26.8 |
120 |
4 |
1:3 |
66.3 |
4.2 |
|
26.8 |
130 |
4 |
1:3 |
65.7 |
4.5 |
|
26.8 |
140 |
5 |
1:3 |
65.9 |
4.7 |
|
26.8 |
140 |
6 |
1:3 |
64.2 |
5.1 |
|
26.8 |
140 |
4 |
1:3 |
65.8 |
5.9 |
|
33.8 |
140 |
5 |
1:2 |
49.7 |
2.1 |
|
22.7 |
140 |
5 |
1:4 |
67.3 |
4.3 |
|
16.9 |
140 |
5 |
1:6 |
70.6 |
4.1 |
|
12.6 |
140 |
5 |
1:8 |
70.1 |
3.6 |
|
16.9 |
140 |
1 |
1:6 |
27.3 |
1.9 |
|
16.9 |
140 |
2 |
1:6 |
32.4 |
2.1 |
Как видно из приведенных в таблице 2 данных, избыток ацетальдегида благоприятно влияет на селективность реакции и выход целевого продукта. Так, при прочих одинаковых условиях при температуре 140º С и продол-жительности 5 часов с увеличением содержания ацетальдегида в реакционной смеси от двукратного до восьмикратного мольного избытка относительно оксидата выход метилгексилкетона увеличивается от 49.5 % до 70.1 % на исходный олефин. Это объясняется тем, что скорость реакции определяется концентрацией ацетильных радикалов в единице объема реакционной среды, источником которых является продукт реакции ацетальдегида с гидропероксидом. С другой стороны, избыточное количество альдегида, играя роль растворителя, благотворно влияет на течение реакции, а именно, способствует увеличению ее селективности и выхода целевого продукта. Однако дальнейшее увеличение количества альдегида практически не влияет на выход метилгексилкетона, и поэтому, мольное соотношение оксидата и ацетальдегида 1:6 принято за оптимальное.
Выход целевого продукта с увеличением содержания гидропероксида в реакционной среде от 5.0 до 10.0 г/моль на 1 моль гексена-1 заметно увеличивается. При мольном соотношении последнего с ацетальдегидом 1:6, температуре 140º С и продолжительности 5 часов выход метилгексилкетона увеличивается до 70,6 %. Дальнейшее увеличение содержания гидропероксида приводит к снижению выхода целевого продукта (до 49,7 %). Оптимальной концентрацией гидропероксида принята 10.0 г/моль гексена.
Одним из основных параметров реакции инициированного присоединения является температура, определяющая скорость распада гидропероксида, а, следовательно, и скорость реакции в целом.
За оптимальную температуру реакции при мольном соотношении ацетальдегида к н-гексену-1 1:6 и продолжительности опытов 5 часов принято считать 140 ºС. Выход метилгексилкетона при этой температуре составляет 70.6 % мас. и уменьшается как с понижением температуры до
120 ºС 49.5 %, так и с повышением температуры до 150 ºС от 70.6 до 65.7 %, за счет понижения селективности реакции и увеличения количества образующихся высококипящих продуктов.
Одним из основных параметров реакции алкилирования является также продолжительность опыта, влияние которой изучено при мольном соотношении ацетальдегида и гексена-1 6:1, температуре 140 ºС. Если в течение часа при описанных условиях выход метилгексилкетона составляет 27.3 %, то с увеличением продолжительности опытов до 4 и 5 часов выход его возрастает до 66.3 % и 70.6 % соответственно. Оптимальной продолжительностью реакции принято считать 5 часов.
Таким образом, в результате исследования реакции присоединения ацетальдегида к гексену-1 в присутствии оксидата-гидропероксида гексена-1 изучено влияние различных параметров на выход и состав продуктов реакции и найдены оптимальные условия синтеза метилгексилкетона: мольное соотношение гексена и ацетальдегида 6:1, температура реакции
140 ºС и продолжительность опыта 5 часов. Выход метилгексилкетона при описанных условиях составляет 70.6 % на исходный н-гексен-1, а количество высококипящих продуктов — остатка от разгонки алкилата —достигает 4.1 % мас.
Большая разница в температурах кипения компонентов реакционной смеси, содержащей непрореагировавшую часть исходного альдегида (Т.кип 20,2ºС), гексена-1 (Т.кип 64ºС), а также целевого продукта — метилгексилкетона (Т.кип 71–74ºС/20мм-рт.ст)ненасыщенного спирта (Т.кип. 135°С) позволяет легко выделить последний с высокой степенью чистоты, без применения специальных методов разделения и очистки.
Атмосферно-вакуумной перегонкой из 59,9 г полученного алкилата ацетальдегида и н-гексена-1 выделены: фракция возвратного альдегида, выкипающая до 25ºС — 39,5 г (66,1 % от массы алкилата), фракция, до 70ºС возвратного н-гексена-1 в количестве 2,2 г (3,6 % от массы алкилата); фракция, 71- 74ºС/20 мм.рт.ст метилгексилкетон в количестве 15,5г (25,9 % от массы алкилата), что составляет 70,6 % моль на исходный и 76,4 % на превращенный гексен-1. Остаток от разгонки составляет 2,5г (4,1 % от массы алкилата) и потери 0,2 г (0.3 % мас.).
При найденных для метилгексилкетона оптимальных условиях проведена реакция присоединения С5-С10 альфа-олефинов к ацетальдегиду (табл.3) и алифатическим альдегидам СЗ-С5 (табл.4) в присутствии гидропероксида соответствующего олефина.
Результаты проведенных исследований показывают, что выход и состав продуктов реакции зависят не только от условий проведения экспериментов, но и от структуры реагирующих альфа-олефинов и алифатических альдегидов. Физико-химическими методами идетификации установлено, что синтезированные метилалкилкетоны представляют собой смесь двух изомеров, линейного и разветвленного, образующихся в результате присоединения ацетильного радикала по альфа, и частично по бета-углеродному атому при кратной связи алкена. Как видно из данных таблицы 3, присоединение альдегида по бета-углеродному атому алкена в меньшей степени зависит от длины углеродной цепи и меняется в пределах 7,9- 12,4 %.
Таблица 3
Выход, состав иорганолептическая оценка продуктов присоединения ацетальдегида (ІІ) кС5-С10 олефинам (І). (Мольное соотношение І:ІІ=6:1, температура 140ºС, продолжительность 5 часов)
|
Исходный олефин |
Выход кетона % моль на взятый олефин |
Наименование иизомерный состав полученного кетона в% |
Органолептическая оценка |
Остаток% мас.от исход. смеси реагент. | |||
|
Линейного |
Разветвленного |
|
| ||||
|
н-пентен-1 |
64,5 |
гептанон-2 |
92,1 |
3-метилгексанон-2 |
7.9 |
4.3 |
2.0 |
|
н-гексен-1 |
70,6 |
октанон-2 |
92 |
3-метилгентанон-2 |
8.0 |
4.0 |
2.9 |
|
н-гептен |
72,2 |
нононон-2 |
89 |
3-метилоктанон-2 |
11,0 |
4.3 |
3.0 |
|
н- октен-1 |
74,7 |
деканон-2 |
88 |
3-метилнонанон-2 |
12,0 |
4.1 |
3.9 |
|
н- нонен-1 |
75,3 |
ундеканон-2 |
87,6 |
3- метил деканон-2 |
12.4 |
4.2 |
5.7 |
|
н- децен-1 |
76,6 |
додеканон-2 |
88,4 |
3-метилундеканон-2 |
11,6 |
4.1 |
5.8 |
Условия проведения опытов: мольное соотношение альдегида и олефина 6:1, температура 140ºС, продолжительность-5 часов, концентрация гидропероксида олефина 10–12 %.
Таблица 4
Результаты присоединения С2-С5 алифатических альдегидов кС5-С10 альфа-олефинам
|
Исходный олефин |
Выход кетонов,% мас. на взятый олефин | |||
|
уксусный |
пропионовый |
масляный |
валериановый | |
|
н-пентен-1 |
60.5 |
46.9 |
36,7 |
32,0 |
|
н-гексен-1 |
66.5 |
49.2 |
38,4 |
32,6 |
|
н- октен-1 |
67.2 |
51,3 |
40,2 |
34.8 |
|
н- нонен-1 |
70.0 |
52,4 |
42.5 |
37,0 |
|
н- децен-1 |
72,2 |
54,5 |
44,8 |
38,3 |
Физико-химическими методами идентификации установлено, что синтезированные метилалкилкетоны представляют собой смесь двух изомеров, линейного и разветвленного, образующихся в результате присоединения ацетильного радикала по альфа и частично по бета-углеродному атому при кратной связи алкена. Как видно из данных таблицы 3, присоединение альдегида по бета-углеродному атому алкена в меньшей степени зависит от длины углеродной цепи и меняется в пределах 7.9–11,6 %. Условия проведения опытов: мольное соотношение альдегида и олефина 6:1, температура 140°С, продолжительность-5 часов, концентрация гидропероксида олефина 10–12 %.
Полученные образцы метилалкил кетонов использованы для приготовления мыльных отдушек. Из них, метилнонилкетон рекомендован для замены широко применяемого в парфюмерной промышленности дефицитного рутового эфирного масла.
По результатам исследования бактерицидных свойств полученные алканоны-2 могут быть рекомендованы так же в качестве антимикробных препаратов для защиты нефтепродуктов-топлив, масел, смазочно-охлаждающих жидкостей от биокоррозии с сохранением эксплуатационных качеств.
Исследованием токсичности синтезированных кетонов установлено, что они относятся к малотоксичным веществам, не обладают кумулятивными свойствами и могут быть рекомендованы к промышленному производству и широкому применению.
Литература:
- Хейфиц Л. А., Дашунин В. М. «Душистые вещества и другие продукты для парфюмерии». М. Химия, 1994, 254 с.
- Аббасов М. Ф. «Свободнорадикальное присоединение алифатических альдегидов к циклододецену». Азерб. Хим. Журнал, 1999, № 3, 18–21 с.
- Аббасов М. Ф., Джафарова Н. А. «О взаимодействии ∆3 карена с ацетальдегидом». Известия Высших Технических Учебных заведений Азербайджана, 2016, Т. 18, № 3, 85–88 с.
- Сулейманова Э. Т., Мехтиев С. Д., Аббасов М. Ф. и др. «Реакция свободнорадикального присоединения алифатических альдегидов к цикленам и разработка способа получения алкилциклоалкилкетонов». Нефтехимия, 1979, т. ХIX, № 3., 452–457 с.
- Сулейманова Э. Т., Хейфиц Л. А., Аббасов М. Ф. и др. «Получение душистых веществ радикальным присоединением карбонильных соединений к циклододецену». Масло-жировая промышленность, 1987, № 9, с. 27–29.
- А.С. № 1151534 (СССР), 1984, Б.И. 1985, № 15, 18 с.
- Гордон А., Форд Р., «Спутник химика». М. Мир. 1976, 54 с.
- Дероум Э. «Современные методы ЯМР для химических исследований». М., 1992, с. 410 с.

