Изучено влияние различных факторов (температуры, продолжительности, мольного соотношения реагентов, природы окислителя и количества катализатора) на конверсию α-метилстирола и состав оксидата. Установлено, что превращение α-метилстирола протекает в двух направлениях.1- эпоксидирование по кратной связи без изменения структуры исходного субстрата.2- изомерезация оксиранового цикла с образованием соответствующих альдегидов. При оптимальных условиях конверсия α-метилстирола составляет 68,5–76,2 %, а селективность по 2-фенилпропаналю (гидратроповый альдегид) 81,9–85,3 %.
Ключевые слова: α-метилстирол, альдегид, эпоксид, диол, фенилацетон, полиоксовольфрамат, метилфенилоксирана.
Известно, что α-метилстирол в присутствии кислотных катализаторов подвергается линейной или циклической димеризации [1,2,3,4,5,6].Однако, в присутствии различных окислителей, в частности, перуксусной кислоты [7,8], NaClO [9], пероксида водорода с участием ферментов пероксидаз и муелопероксидаз [10], реакция протекает с образованием соответствующего эпоксида или 2-фенилпропаналя.
С целью изучения возможных направлений превращений α-метилстирола в присутствии синтезированных РЗЭ- содержащих гетерокомплексов вольфраматов проведено исследование различных факторов с варьированием в широком диапазоне.
Экспериментальная часть
Исследования проводились в двух направлениях: с участием водного раствора Н2О2 и гидропирита (аддукта Н2О2 и карбамида) в растворе 95 % -ой уксусной кислоты. Было изучено влияние температуры, концентрации катализатора, продолжительности опыта, а также мольных соотношений реагентов и концентрации используемых окислителей.
При окислении α-Метилстирол с участием водного раствора Н2О2 в зависимости от концентрации последнего превращается в различные оксипродукты. Результаты проведенных исследований приведены в табл.1. и 2. Как видно из данных этих таблиц, независимо от исходной концентрации Н2О2 активный кислород расходуется в направлении молекулярного выделения и индуктивного окисления α-метилстирола. Выделение молекулярного кислорода, вероятно, протекает путем образования комплекса катализатора: активный кислород без участия субстрата. Вовлечение α-метилстирола в состав данного комплекса способствует снижению выхода молекулярного кислорода.
Вследствие образования трехкомпонентного комплекса, концентрация свободного пероксокомплекса уменьшается, что приводит к снижению степени непродуктивного разложения пероксида водорода.
Предварительная обработка церййсодержащего полиоксовольфрамата 35 %-ным раствором Н2О2 существенно влияет на его активность. Предполагается, что в данном случае применяемый катализатор распадается на более активные пероксокомплексы. Использование такого катализатора приводит к сокращению индукционного периода (табл.2).
Таблица 1
Влияние концентрации водного раствора Н2О2 на степень инаправление превращения исходных соединений (Т=70°С,=6ч, мольн.соотн. α-МСт: Н2О2=1:2,Кат состава CePO4 ∙PW12O41∙nH2O 10 г/л,растворитель толуол:2-пропанол=1:1)
|
СН2О2,% |
Конверсия,% |
Выход% | |||
|
α-МСт |
Н2О2 |
эпоксида |
2-фенилпропаналя |
1-фенил-1-метил-этандиола-1,2 | |
|
10 15 20 26 30 35 |
11.2 12.6 19.4 29.3 45.1 64.7 |
21.8 23.0 25.4 35.0 49.7 68.7 |
10.1 10.7 14.6 14.5 17.3 29.5 |
- — 3.0 12.1 20.3 36.4 |
1.1 1.9 1.8 2.7 3.0 2.8 |
Таблица 2
Влияние продолжительности реакции на конверсию иселективность превращения α-метилстирола (Т=70°С, мольн.соотн. α-МСт: Н2О2=1:2, 35%-ный Н2О2,кат 10г/л,растворитель толуол:2-пропанол=1:1)
|
продолжи-тельность, час |
Конверсия,% |
Выход% | ||||
|
α-МСт |
Н2О2 |
эпоксида |
2-фенил- пропаналя |
фенил-метилэтандиола |
фенилацетона | |
|
1 2 3 5 7 10 12 1* 3* 5* 7* |
3.6 6.1 18.3 42.6 64.7 71.2 74.2 8.3 29.7 57.0 75.8 |
8.4 10.2 23.8 47.0 68.7 73.5 78.0 11.4 32.6 61.2 79.0 |
3.2 4.7 9.9 18.7 29.5 14.2 11.1 7.6 25.8 34.2 26.5 |
0.4 1.4 9.4 21.8 36.4 32.6 54.7 0.7 2.4 15.8 41.7 |
- — — 2.0 2.8 3.0 4.8 — 1.4 3.2 3.4 |
- — — — — 1.4 3.6 — — 3.8 4.2 |
Примечание: * катализатор предварительно обработанный Н2О2
При окислении α-метилстирола продукты окислительной олигомеризации практически не наблюдаются. Основными продуктами реакции являются соответствующий эпоксид, диол и альдегид, образующиеся по схеме:

Согласно данным табл.1. и 2. первичным продуктом окисления α-метилстирола является 1-метил-1-фенилоксиран, который далее превращается в 2-фенилпропаналь и 1-метил-1-фенилэтан-1.2-диол.В катализате также имеется некоторое количество продуктов перегруппировки эпоксида -фенилацетон. Как видно из данных табл.2. окисление α-метилстирола существенно зависит от первичной проработки катализатора пероксидом водорода. Так, при использовании необработанного церий полиоксовольфромата, т.е при введении в среду реагентов, растворителя и катализатора, последний проявляет низкую каталитическую активность. В данном случае, реакция имеет большой индукционный период (до 2 ч.), что обусловлено, образованием пероксокомплекса, ответственного за реакции окисления субстрата. Однако, при использовании предварительно обработанного пероксидом водорода церийполиоксовольфрамата (мольное соотношение Кт: Н2О2=100) индукционный период практически отсутствует. Если в присутствии исходного церийполиоксофосфорновольфрамата максимальная конверсия α-метилстирола достигается в течение 12 часов (74,2 %), то с участием предварительно обработанного катализатора высокая конверсия субстрата достигается за 7 часов (75,8 %). При этом меняется также состав катализата. Как видно из таблицы 2 при использовании пероксокомплекса в качестве катализатора выход 2 -фенилпропаналя при одинаковых условиях (70°с,=7 часов, мольн. соотн. α-МСт:Н2О2=1:1) увеличивается от 36.4 до 41,7 %.однако более высокая селективность реакции по метилфенилоксирану (77,0–96.6 %) достигается при невысоких степенях превращения субстрата (8,3–29.7 %)
Также было изучено влияние природы катализатора на состав продуктов окисления α-метилстирола. Превращение активного кислорода Н2О2 и селективность реакции существенно зависит от кислотной обработки используемого катализатора церий- и тербий содержащих полиоксовольфраматов.
Несомненно, исследования активности других синтезированными нами катализаторов в данной реакции дает возможность оценить их активность. Приведены результаты эпоксидирования α-метилстирола церий- и тербийсодержащих полиоксовольфраматами, обработанными щавелевой кислотой. Полученные данные приведены в табл.3.
Как видно из приведенных данных в отличие от цериййполиоксофосфорновольфрамата (табл.1.и 2.) в присутствии вышеуказанных полиоксовольфраматов, обработанных шавелевой кислотой. α-Метилстирол преимущественно превращается в направлениях накопления 2-фенилпропаналя и фенилацетона. Выход соответствующего эпоксида не привышает 25–30 % от общего количества продуктов окисления.
С увеличением продолжительности реакции количество эпоксида и альдегида в оксидате меняется антибатно. Так, в присутствии церийполиоксовольфрамата обработанного щавелевой кислотой и пероксидом водорода количество эпоксида в катализате уменьшается от 11.8 до 9.0 %, а фенилпропаналя и фенилацетона увеличивается от 19.8 до 48.8 %.Вероятно,это обусловлено,высокой восстановительной способностью самой щавелевой кислоты.
Таблица 3
Результаты каталитического окисления α-метилстирола пероксидом водорода вприсутствии церий итербийполиоксовольфраматов,обработаных щавелевой кислотой (условия реакции приведены втабл.3.13)
|
продолжительность час |
Конверсия,% |
Выход% | ||||
|
α-МСт |
Н2О2 |
эпокси-да |
2-фенил- пропаналя |
фенил-метилэтан-диола |
фенилацетона | |
|
CeO2 +(NH4)6W12O41∙n H2O+Н2С2О4 | ||||||
|
3 5 7 10 5* 7* 10* |
12.4 31.6 48.4 57.2 34.7 53.2 60.0 |
15.8 33.0 52.7 60.4 36.1 54.8 63.6 |
4.7 13.6 15.9 14.2 11.8 9.4 9.0 |
7.7 12.8 25.5 33.5 15.6 35.5 43.0 |
- 2.8 4.0 4.1 3.1 3.1 2.2 |
- 2.4 3.0 5.4 4.2 5.2 5.8 |
|
Tb4O7-x +(NH4)6W12O41∙n H2O+Н2С2О4 | ||||||
|
5 7 10 5* 7* 10* |
34.2 51.7 60.0 40.3 56.2 63.5 |
38.3 59.0 70.4 43.7 58.4 65.2 |
16.1 18.0 17.0 16.2 19.4 18.2 |
13.6 26.6 33.0 18.4 28.1 35.1 |
1.4 2.1 3.8 2.1 3.5 4.2 |
3.1 5.0 6.2 3.6 5.2 6.0 |
В отличие от ненанесенного катализатора в присутствии церийполиоксовольфрамата, нанесенный на углеродный материал и предварительно обработанного 35 %-ным пероксидом водорода окисление α-метилстирола более селективно протекает в направлении образования 2-фенилпропаналя (рис.1.). Кривая, характеризующая выход метилфенилоксирана (1´,2´,3´) проходит через максимум.Следовательно, 2 фенилпропаналь образуется по последовательной схеме:

Вероятно, промежуточным продуктом в данном случае является соответствующий диол, образующийся в результате гидролиза оксирана.
В отличие от ненанесенного катализатора, на церийполиоксовольфрамате, нанесенного на углеродный материал, выход альдегида значительно выше, что объясняется низкой скоростью десорбции первичного продукта окисления -эпоксида, далее превращающегося в альдегид или кетон.
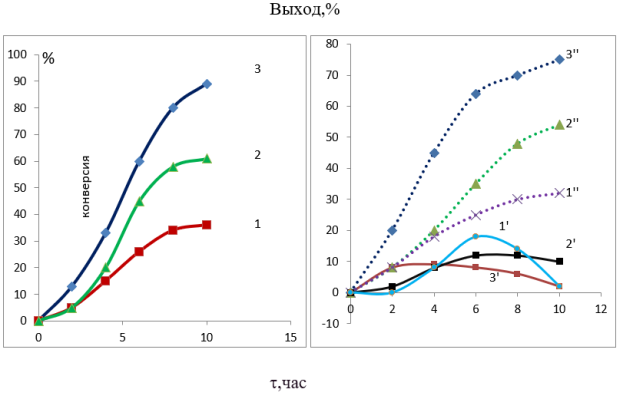
Рис. 1. Динамика превращения α-метилстирола и накопления продуктов окисления при разных температурах в присутствии церийполиоксовольфрамата нанесенного на углеродный материал и обработанного пероксидом водорода и щавелевой кислотой. Температура,°С: 1,1´,1´´-50;2,2´,2´´-70;3,3´,3´´-90;1,2,3-конверсия α-МСт, 1´,2´,3´-метилэтилоксирана,1´´,2´´,3´´-2-фенилпопаналь+фенилацетон
При жидкофазном окислении α-метилстирола, также рассмотрено влияние температуры и использованного растворителя на выход и состав продуктов окисления. Наличие метильной группы в молекуле α -метилстирола существенно влияет на его реакционную способность по сравнению с незамещенным стиролом.
Более существенное влияние на состав оксидата оказывают температура реакции и природа выбранного растворителя.
Влияние последних на окисление α-метилстирола нами изучено с участием гидропирита в присутствии гетерогенизированного на углеродном материале церийполиоксофосфорновольфрамата.
Как видно из табл.4. состав оксидата в зависимости от температуры реакции меняется в широком интервале. Следует отметить, что в отсутствии катализатора окислениеα-МСт протекает с большим индукционным периодом.
В отличие от водного раствора Н2О2 при использовании гидропирита окисление проводиться с участием муравьиной или уксусной кислот. В отсутствие этих кислот окисление α-МСт практически не протекает. Кроме того, наблюдается высокая степень непродуктивного расхода кислорода.
Предполагается, что при использовании кислот окисление протекает по радикально-ионному механизму. Для определения роли кислот исследования проводились в двух вариантах:
– введением в среду всех реагентов, катализатора и кислоты в реакционную зону.
– растворением гидропирита в муравьиной или уксусной кислоте и последовательным добавлением катализатора, растворителя и реагентов.
Таблица 4
Влияние температуры на конверсию α-метилстирола ина состав оксидата при использовании вкачестве окислителя гидропирита (аддукта мочевины ипероксида водорода) α-МСт:СН3СООН: Н2О2=1:0,2:1, растворитель -толуол,=7ч, CePO4 ∙PW12O41∙nH2O/МУМ-15 г/л.
|
Температура,С° |
Конверсия,% |
Состав оксидата,%мол | ||||
|
α-МСт |
Н2О2 |
эпоксид |
2-фенил- пропаналь |
фенил-ацетон |
1-метил-1-фенилэтан-1,2-диол | |
|
40 50 60 70 80 |
18.6 31.0 54.2 68.5 76.2 |
20.4 39.3 23.8 11.2 5.4 |
54.7 39.3 23.8 11.2 5.4 |
45.3 59.1 72.9 81.9 85.3 |
- 1.6 1.9 4.2 5.1 |
- — 1.4 2.7 4.2 |
Полученные данные показывают, что в первом случае активность катализатора значительно ниже, чем во втором случае. Следовательно, используемые карбоновые кислоты непосредственно участвуют в переносе активного кислорода гидропирита к катализатору и субстрату.
С целью определения этого фактора, были поставлены определенные опыты без использования катализатора. Более высокие результаты получены с участием муравьиной кислоты, которая в этих условиях легко превращается в пероксокислоту.
![]()
В этом аспекте хотя уксусная кислота и уступает муравьиной, при использовании полиоксовольфрамовой кислоты или его РЗЭ соли легко достигается равновесная концентрация переходного комплекса, и реакция селективно протекает с образованием соответствующих продуктов- оксирана и альдегида (фенилпропаналя):
[PW12O40]3-+28H2O2→{PO4 [WO(O2)2]4}3-+20H2O+4 [W2O3(O2)4(H2O)2]2-
{PO4 [WO(O2)2]4}3-+8CH3COOH→{PO4 [WO(O2)(OH)2(CH3COO)2]4}3-
При использовании муравьиной кислоты окисление протекает не избирательно, наряду с альдегидом и кетоном в процессе окисления образуются 2-фенилпропановая и бензойная кислоты. При более жестких условиях (80°С,8ч) количество их достигает 15.0–20.0 %.
Как видно из табл.3.15 превращение α-МСт в присутствии вышеуказанного каталитического комплекса с участием уксусной кислоты реакция до 40°С протекает с явно выраженным индукционным периодом. При 40°С и продолжительностью опыта 7 часов конверсия исходного реагента составляет всего 18.6 %. При этих условиях соотношение эпоксида и 2-фенилпропаналя в катализате составляет 1:1. По мере повышения температуры в интервале 50–80°С индукционный период резко уменьшается и конверсия субстрата достигает 76.2 %. При этом соотношение эпоксида к альдегиду резко меняется. Количество эпоксида уменьшается от 54,7 до 5.4 %,а 2-фенилпропаналя увеличивается от 45,3до 85,3 %.Также наблюдается накопление в катализате продукта перегруппировки оксирана-фенилацетона.
При вышеуказанных температурных условиях направление окисления α-метилстирола зависит также от природы,в частности,полярности применяемого растворителя. Из данных табл. 5 видно, что в случае использования слабополярных растворителей (толуол, ксилол, диоксан) окисление α-метилстирола более селективно протекает в направлении накопления соединений с карбонильной группой-2-фенилпропаналя и фенилацетона. Суммарная селективность по этим соединениям достигается 86,1–90,2 %. С повышением полярности растворителей в катализате увеличивается содержание эпоксида и продукта его гидролиза-диола соответствующей структуры.
После фильтрации катализата, органический слой отделяли от водного, водный слой подвергали экстракции толуолом. Экстракт объединяли с органическим слоем и подвергали атмосферно-вакуумной перегонке.
Фракция 100–101°С/1.33 кПа,![]() 1.008,
1.008,![]() -1.5092 по данным ГЖХ анализа состоит из 95.0 % 2-фенилпропаналя и 5.0 % 1фенилпропанона и имеет приятный запах зелени, гиацинта.
-1.5092 по данным ГЖХ анализа состоит из 95.0 % 2-фенилпропаналя и 5.0 % 1фенилпропанона и имеет приятный запах зелени, гиацинта.
Таким образом, нами установлено, что основными продуктами жидкофазного окисления α-метилстирола пероксидом водорода (или гидропиритом) являются соответствующий альдегид и кетон. Максимальный выход этих соединений достигается при температуре 70–80°С, продолжительности реакции 7 часов и мольном соотношений α-МСт: Н2О2=1:2.
Таблица 5
Зависимость конверсии α-метилстирола исостав оксидата от применяемого растворителя вприсутствии гидропирита (кат-рCePO4 ∙PW12O41∙nH2O/МУМ мольн.соотн. α-МСт: СН3СООН: Н2О2 [CO(NH2)2]=1:0.2:2, Т=70°С,=7ч)
|
Растворитель |
Конверсия,% |
Состав оксидата, мол% | |||
|
эпоксид |
2-фенил- пропаналь |
фенил-пропанон |
1-метил-1-фенилэтан-диол | ||
|
толуол м-ксилол диоксан этанол пропанол-2 2-метилпропанол-2 диметилформамид толуол+пропанол-2 |
68.5 59.0 56.4 73.5 76.4 80.2 83.7 77.9 |
11.2 9.2 8.8 12.6 14.1 13.7 8.4 12.5 |
81.9 83.6 86.2 74.5 74.1 76.4 72.2 80.5 |
4.2 6.1 4.0 3.2 3.8 6.1 8.2 4.2 |
2.7 1.1 1.0 9.7 8.0 3.8 11.2 2.8 |
В случае использования гидропирита, окисление проводится в присутствии уксусной кислоты, при мольном соотношении α-МСт:СН3СООН: Н2О2=1:0,2:1. При этих условиях выход вышеуказанных соединений достигается 59,0–66,0 %.
Литература:
1. Джемилев У. М, Кутепов Б. И, Григорьева Н. Г, Галяутдинова Р. Р, Ковтуненко И. А, Додонова Н. Е, Ямали Е. И, Целютина М. И. Cпособ получения линейных димеров α-метилстирола// Pat RU 2189964(2008)
2. Chaudhuri B., Sharma M. M., Method for combined synthesis of linear cyclic homo- and codimers of styrene and α-methylstyrene //Ind. Eng. Chem. Res. 1989, V.28, N12, pp.1757–1763.
3. Fujiwara M., Kuraoka K., Yazawa T.. Preparation of an MCM-41/Nafion composite material; a selective catalyst for α-methylstyrene dimerization// Chem. Commun. 2000, pp.1523–1524.
4. Omori, Toshio & Jigami, Yoshifumi & Minoda, Yasuji. (1974). Microbial Oxidation of α-Methylstyrene and β-Methylstyrene. Agricultural and Biological Chemistry. 38. 409–415.
5. Xiaoshuang Tang,Yuhai Tang,Guojin Xu,Saili Wei,Yang Sun,Highly enantioselective epoxidation of styrene and α-methylstyrene catalyzed by new doubly-immobilized chiral (salen)Mn(III) catalysts,Catalysis Communications,Volume 10, Issue 3, 15 December 2008, Pages 317–320
6. Broene RD, Brookhart M, Lamanna WM, Volpe AF Jr.,Cobalt-catalyzed dimerization of alpha-olefins to give linear alpha-olefin products. J Am Chem Soc. 2005 Dec 14;127(49):17194–5.
7. David L. Garin, Melissa Gamber, Bradley J. Rowe Epoxidation of Alpha-Methylstyrene and its Lewis Acid Rearrangement to 2-Phenylpropanal//J. Chem. Educ., 1996, 73 (6), p 555.
8. Nianzhe Li, Yuan Gao,, Xinxin Zhang, Zhanjun Yu, Lei Shi, Qi Sun. Oxidation of styrene to benzaldehyde by p-toluenesulfonic acid using hydrogen peroxide in the presence of activated carbon. //Chinese Journal of Catalysis. 2015.v 36.pp. 721–727.
9. Xiaochuan Zou,Cun Wang,Yue Wang,Kaiyun Shi,Zhongming Wang,Dongwei Li,Xiangkai Fu Chiral MnIII (Salen) Covalently Bonded on Modified ZPS-PVPA and ZPS-IPPA as Efficient Catalysts for Enantioselective Epoxidation of Unfunctionalized Olefins //Polymers 2017, V.9 № 3,р. 108.
10. Tuynman A, Spelberg JL, Kooter IM, Schoemaker HE, Wever R. Enantioselective epoxidation and carbon-carbon bond cleavage catalyzed by Coprinus cinereus peroxidase and myeloperoxidase.// J Biol Chem. 2000,v.275№ 5.рр.3025–3030.

