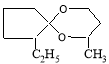
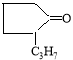
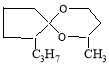
Исследованы особенности реакции каталитической конденсации циклопентанона и его 2-алкилпроизводных формулы R1C5H7O(где R1=Н,СН3, С2Н5, С3Н7; н-алкил) и 1,3-бутандиола в присутствии катализатора на основе природного перлита, модифицированного фосфорной или серной кислотами, или солями циркония, цинка и железа. Установлено, что выход спироацеталей реакции конденсации циклопентанона и 2-алкилциклопентанонов с 1,3-бутандиолом зависит от природы и количества модификатора на природном перлите. Катализаторы, модифицированные солями циркония, показывают наиболее высокую каталитическую активность и селективность
Ключевые слова: циклопентанон, природный перлит, алкилциклопентаноны, конденсация
Циклические ацетали, полученные на основе кетонов и альдегидов, содержащие наряду с ацетильными фрагментами различные функциональные группы, входят в состав многих широко применяемых парфюмерно-косметических изделий и продуктов бытовой химии [1], фармацевтических препаратов [2,3],биологически активных веществ, присадок и различных малотоннажных продуктов [4,5], перспективных высокооктановых добавок, улучшающих эксплуатационные свойства топлив для двигателей внутреннего сгорания [6–10].
Ранее нами были разработаны способы получения высших спироацеталей конденсацией С3-С7 алкил-, диалкил- и циклоалкилзамещенных цикланонов с диолами в присутствии гетерогенных катализаторов, модифицированных кобальтом и бромом, фосфорномолибденовой гетерополикислоты, хлорсодержащих катионитов КУ-28 и КУ-23, Цеокара-2, синтетического и природного морденита и клиноптилолита [11].
Настоящая статья посвящена получению спироацеталей конденсацией циклопентанона и его С1-С3 н-алкилзамещенных производных с 1,3-бутандиолом в присутствии гетерогенного катализатора на основе природного перлита, модифицированного различными модификаторами. В качестве модификатора использованы ортофосфорная или серная кислоты, соли металлов циркония, цинка и железа.
Экспериментальная часть
В качестве исходного сырья были использованы циклопентанон и С1-С3 н-алкилциклопентаноны, синтезированные по ранее разработанной методике [12], и 1,3-бутандиол марки «х.ч»., азетропобразующие растворители — бензол, толуол и изомеры ксилола марки «х.ч.».
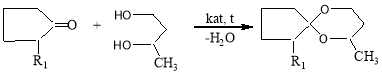
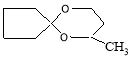
Где R1=H, CH3, C2H5, C3H7
Конденсацию 2-алкилциклопентанонов с 1,3-бутандиолом проводили при 80–130оС перемешиванием в термостатированном стеклянном реакторе, объемом 250 см3, снабженном термометром, насадкой Дина-Старка, обратным холодильником, в который загружали заданное количество исходных реагентов и азетропобразующего растворителя. После выделения (по расчету) количества воды, органический слой отделяли от катализатора (фильтрацией), промывали дистиллированной водой, сушили над MgSO4 и атмосферно-вакуумной перегонкой выделяли целевой продукт.
Модифицированная форма природного перлита приготовлена методом осаждения. Для этого природный перлит размельчили и просеяли через сито с отбором фракции размером 0,6–1 мм. Обезвоживали при температуре 350–400оС в течение 4 часов. После охлаждения до комнатной температуры на него осаждали требуемый модификатор, затем сушили при 100–120оС и прокаливали при 500–550оС.
Изомерный состав и чистота синтезированных ацеталей определены методом ГЖХ на хроматографе «Цвет 500М» с детектором по теплопроводимости на колонке 0,3×200см. Неподвижная фаза полиэтиленгликольсукцинат (10 % масс.), нанесенный на хромосорб W.
Температура термостата колонки — 120–150оС, детектора — 200–220оС, испарителя — 250–270оС, ток моста детектора — 120–140мА, скорость газа-носителя (гелий) –40мл/мин.
Наличие функциональных групп и строение полученных соединений установлены методами ИК Фурье-спектрометр Alpha, в диапазоне 400–4000см-1 в таблетках с KBr, и ЯМР 1Н и 13С, которые были сняты на спектрометре BrukerBioSpin AG при рабочей частоте 30018МГц в CDCl3. Элементарный анализ проводили на анализаторе Truspes Mikro Leco Carporation USA.
Результаты иобсуждение
С целью нахождения характерных особенностей реакции конденсации циклопентанона и его алкилпроизводных с 1,3-бутандиолом более подробно исследовали конденсацию на примере циклопентанона с 1,3-бутандиолом. Изучали влияние природы и количествокатализатора, мольное соотношение кетона к диолу, температуру, продолжительность опыта, азетропобразующий растворитель на выход целевого продукта 2-метил-1,5-диоксаспиро [4.5]декана.Результаты отдельных опытов приведены в табл. 1.
Таблица 1
Зависимость выхода спироацеталя циклопентанона и 1,3-бутандиола от природы катализатора (мольное соотношение кетон:диол = 1:1,75, температура— 130оС, количество катализатора— 5% масс., продолжительность опыта— 5 часов, растворитель— м-ксилол)
|
№ |
Природный перлит, модифицированный |
Выход спироацеталя,% |
|
Кислотами | ||
|
1 |
Ортофосфорной |
73,9 |
|
2 |
Серной |
78,9 |
|
Солями металлов | ||
|
3 |
Железа |
77,4 |
|
4 |
Цинка |
79,7 |
|
5 |
Циркония |
81,3 |
|
Промышленные катализаторы | ||
|
6 |
КУ-2×8 |
79,4 |
|
7 |
Цеокар-2 |
77,0 |
Экспериментально установлено, что наиболее высокие выходы спироацеталя достигаются при использовании природного перлита, модифицированного цирконил сульфатом.
Из данных табл. 1 видно, что выходы спироацеталей и селективность реакции существенно зависят от природы катализаторов. Среди использованных катализаторов наиболее эффективными являются модифицированные железом, цинком и цирконием, хлорированный КУ-2×8, в присутствии которых выходы соответствующих спироацеталей достигают 77,4–81,3 % при мольном соотношении кетон: диол = 1:1,75, температуре — 130оС и продолжительности опыта — 5 часов. Увеличение мольного соотношения циклопентанона и 1,3-бутандиола от 1:1 до 1:2 при 130оС способствует повышению селективности и выходу ацеталя до 81,9 и 58,6 % соответственно. Дальнейшее увеличение количества 1,3-бутандиола практически не влияет на выход целевого продукта и сопровождается образованием значительного количества полиоксосоединений.
Каталитическая конденсация С1-С3 н-алкилпроизводных циклопентанона с 1,3-бутандиолом проведена в оптимальных условиях, найденных для конденсации циклопентанона и 1,3-бутандиола с использованием цирконил содержащего катализатора.
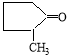
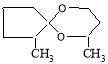
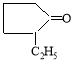
Установлено, что положение алкильных заместителей в молекуле исходного кетона существенно влияет на их реакционную способность. Так, при переходе от циклопентанона к н-алкилпроизводным циклопентанона выходы ацеталей снижаются на 5–30 %, что, по-видимому, связано с пространственными факторами, затрудняющими нуклеофильную атаку на карбонильную группу кетонов.
В результате проведенного исследования и, в частности, методом конкурирующих реакций, экспериментально установлено, что по реакционной способности к ацетализации алкил-кетонов с образованием спироацеталей исследованные алкилцикланоны могут быть расположены в следующий убывающий ряд: циклопентанон>2-метилциклопентанон>2-этилциклопентанон> 2-пропилциклопентанон.
С целью установления реакционной способности также проведена конденсация смесью, состоящей из 57,09 % циклопентанона и 42,91 % этилциклопентанона с 1,3-бутандиолом при температуре 130оС. В результате этого получены ацетальциклопентанона и 1,3-бутандиола с выходом 81,81 %, и ацеталь этилциклопентанона и 1,3-бутандиола с выходом 7,92 %.
Сравнение выходов ацеталей, полученных конденсацией смеси, состоящей из циклапентанона и этилциклопентанона с 1,3-бутандиолом, показывает, что незамещенный циклопентанон почти в 10 раз быстрее вступает в реакцию, чем этилциклопентанон.
Зависимость выхода спироацеталей от структуры исходных кетонов представлена в табл. 2. Таким образом, по данным табл.2 видно, что с увеличением молекулярного веса, т. е. с увеличением числа углеродных атомов в молекуле н-алкильного радикала С1-С3 линейных углеводородов в положении 2-карбонильной группы циклопентанона, выход ацеталя уменьшается от 96,6 % до 83,8 % соответственно.
Таблица 2
Зависимость выхода спироацеталей от структуры исходных кетонов (мольное соотношения кетон:диол = 1:1,75; температура –130оС продолжительность опыта— 5ч, растворитель— м-ксилол)
|
№ |
Наименование иструктурная формула |
Выход спироацеталя, % | |
|
кетон |
спироацеталь | ||
|
1. |
Циклопентанон
|
2-метил-1,5-диоксаспиро [4.5]декан
|
96,6 |
|
2. |
2-метилциклопентанон
|
2,6-диметил-1,5- диоксаспиро [4.5]декан
|
92,6 |
|
3. |
2-етилциклопентанон
|
2-метил-6-этил-1,5- диоксаспиро [4.5]декан
|
87,5 |
|
4. |
2-пропилциклопентанон
|
2-метил-6-пропил-1,5- диоксаспиро [4.5]декан
|
83,8 |
Состав и строение синтезированных ацеталей установлены методами ИК и ЯМР 1Н-спектроскопии, а также данными элементарного анализа.
Спектроскопическими анализами ИК подтверждается отсутствие в спектрах полос поглощения, характерных для валентных колебаний >С=О групп, в области 1740–1715см-1 и ассоциированных групп (широкая полоса поглощения в области 3500–3400см-1). В спектрах ацеталей появляются новые интенсивные полосы поглощения при 1165–1150, 1080–1050, 990–950см-1, характерные для валентных колебаний простой эфирной и оксирановой связи, подтверждающие образование спироацетальной структуры [15–17], другие полосы, относящиеся к валентным и деформационным колебаниям связи С-Н в группах СН, СН2 и СН3 в циклах ацеталей с 1–3 углеродными атомами.
Литература:
- Хейфиц Л. А. Дашунин В. М. Душистые вещества и другие продукты парфюмерии. М.:Химия,1994, 254с
- Войткевиц С. А., Хейфиц Л. А. От древних благовоний к современным парфюмерии и косметике. М.: Пищ. промышленность, 1997, 596с
- Выглазов О. Г., Чуйко В. А., Изотова Л. В., идр. //ЖПХ, 2001,Т.74, № 11, с.1829–1832
- Fefelov A. A., Rolnik L. Z., Yagafarova G. G.// Proc. Word Conf.”Intellectual service For oil and gas industry; analusis, solutions, perspectives.” Ufa: Pube. USPTU, 2004, V.3.P. 186–192
- Фефелов А. А., Сементеева Л. Ш., Кирлан С. А., и др.// Мировое сообщество: проблемы и пути решения. Уфа: УГНТУ, 2004, Выд. 16.с.166–175
- Данилов А. М. Присадки и добавки. Улучшение экологических характеристик нефтяных топлив. М: Химия, 1996, 231с.
- Патент РФ № 2522764С2, 2014
- Патент РФ № 2365617, 2009
- Максимов А. Л., Нехаев А. И., Рамазанов Д. Н. // Нефтехимия. 2015. Т.55.№ 1, с.3–24
- Рамазанов Д. Н., Джумбет А. И., Нехаев А. И. и др. // Нефтехимия, 2015, Т.55, № 2, с. 148–153
- Алимарданов Х. М., Садыгов О. А., Аббасов М. Ф. и др. Синтез высших спироацеталей конденсацией алкил- и циклоалкилциклопентанонов и циклогексанонов с двухатомными спиртами в присутствии гетерогенных катализаторов// Ж. Орг. химии, 2011, 47. 1136–1143
- Сулейманова Э. Т., Мехтиев С. Д., Мусаев М. Р., и др. // Нефтехимия. 1979, Т.19, № 6, с.815–820
- Аббасов М. Ф. Алимарданов Х. М., Сулейманова Э. Т. // ЖПХ. 1997, Т.70, в.4, с.648–655
- Алимарданов Х. М., Аббасов М. Ф., Сулейманова Э. Т., и др. // Азерб.хим.журн. 2002, Т.71, № 2, с.62–67: РЖХим. 2004. 3.19Б4.252.
- Гордон А., Форд Р. Спутник химика. М.: Мир, 1976, 54с.
- Colthupm N. B., Daiy L. H., Wiberiery S. E. //Intraduction to Infrared and Ruman spectroscopy. Boston: San Diego; New York; London; Toronto;Academic Press; 1990, 547р.
- Дероум Э. Современные методы ЯМР для химических исследований. М.: 1992, 410с.