Определена суммарная и относительная антиоксидантная активность водных и спиртовых экстрактов, полученных из некоторых растений, произрастающих в Ферганской долине Республики Узбекистан. Применен потенциометрический метод оценки антиоксидантной активности по изменению аналитического сигнала электрохимического датчика с рабочей камерой 0,1 мл в медиаторной системе, содержащей 0,005 М K3 [Fe(CN)6] и 0,00001 М K4 [Fe(CN)6] в 0,05 М фосфатном буфере с рН 6,86. В качестве стандарта вещества-антиоксиданта использован раствор аскорбиновой кислоты. Предел обнаружения антиоксидантной активности составляет 0,07 мг/мл относительно аскорбиновой кислоты. Предложен метод расчета антиоксидантной активности экстрактов без построения калибровочного графика. Приводятся количественные значения измеренной антиоксидантной активности в экстрактах растений. Показано, что практически все исследуемые растения обладают в большей или в меньшей степени антиоксидантными свойствами, причем более ярко выраженными в спиртовых экстрактах.
Ключевые слова: флора Ферганской долины, лекарственные растения, антиоксиданты, потенциометрическое определение.
Введение
Применение целебных трав и аптечных сборов на их основе в традиционной и народной медицине в настоящее время особенно актуально, что обусловлено существенным преимуществом растений по сравнению с химическими медикаментозными препаратами. Главное из них — отсутствие побочных эффектов и комплексное воздействие на организм [1]. В связи с этим возникает необходимость поиска наиболее перспективных растений, обладающих высоким потенциалом по содержанию биологически активных веществ.
В этом отношении флора заповедных зон Узбекистана, в частности Ферганской долины, представляет несомненный интерес для многих исследователей [2]. Ферганская долина — это межгорная впадина на юго-востоке Узбекистана площадью около 20000 кв.км., окруженная горными хребтами, высота которых местами достигает 5000 м над уровнем моря [3]. Флора Ферганской долины насчитывает не менее 2625 видов различных растений с преимущественным ареалом обитания в зависимости от ландшафтных условий [4]. Горные отроги и вершины Кураминского, Чаткальского, Ферганского, Алайского, Туркестанского хребтов являются естественной условной границей региона Ферганской долины.
Такие примечательные ландшафтно-географические условия создают предпосылки для сосуществования различных дикорастущих растений, содержащих большое количество естественных полезных макро-, микроэлементов и биологически активных веществ, за счет которых можно значительно обогатить список пригодных для фитотерапии растений [5].
Известно, что антиоксидантная активность веществ растительного происхождения в значительной степени определяет лекарственную ценность растения [6]. При этом, если для многих лекарственных растений флоры Ферганы известен макро- и микроэлементный состав [7–9], то исследования их антиоксидантной активности практически не проводились. Целью настоящего исследования является определение суммарной антиоксидантной активности некоторых растений, составляющих флору Ферганской долины.
Экспериментальная часть
Материалом для исследования служили фитосборы, собранные в районе предгорных равнин, предгорий и лугово-степной зоны Ферганской долины в августе-сентябре месяцах в период их цветения и созревания. Высушенные в тени до воздушно-сухого состояния части растений были измельчены до размера частиц 0,5–1,0 мм. Экстракты растений были получены методом мацерации с использованием дистиллированной воды и спиртовых растворов с объемным содержанием этилового спирта 40 % в соответствии с рекомендациями, приведенными в фармацевтических сборниках [10]. Полученные экстракты фильтровали через бумажный фильтр «белая» лента.
Для измерения антиоксидантной активности полученных настоев 0,1 мл экстракта смешивали с 0,9 мл раствора медиатора, содержащего 0,005 М K3 [Fe(CN)6] + 0,001M K4 [Fe(CN)6] в 0,05М фосфатном буфере с рН 6,86. 1,0 мл этой смеси с помощью пипеточного микро-дозатора инжектировали в рабочую камеру электрохимического датчика.
Электрохимический датчик представлял собой двухэлектродную систему, состоящую из золотого планарного электрода, контактирующего с хлорсеребряным электродом сравнения через рабочую микрокамеру, объемом ~ 0,1 мл. Электрохимический датчик был подключен к иономеру И-130М.
В качестве стандарта антиоксидантной активности были использованы свежеприготовленные водные и спиртовые растворы аскорбиновой кислоты с известной концентрацией.
Данные получены усреднением 3–4 параллельных определений. Статистическая и математическая обработка полученных данных осуществлялась с помощью пакета статистических программ «Microsoft Excel» [11] и метода множественной регрессии, при этом статистическая ошибка не превышала 2–4 % от определяемой величины.
Результаты и обсуждение
В основе методов оценки общей антиоксидантной активности лежат реакции взаимодействия с долгоживущими свободными радикалами, которые служат прототипом свободных радикалов, образующихся в живой клетке [12].
Взаимодействие антиоксидантов со свободными радикалами и активными кислородными соединениями (O2˙ˉ, HO˙, H2O2, O и др.) сопровождается передачей электрона и, следовательно, имеет электрохимическую природу.
В работе [13] описан метод потенциометрического определения антиоксидантой активности в водных растворах с применением медиаторной системы, в качестве которой используется смесь ферро-феррицианид-ионов, способных обратимо превращаться на рабочем электроде. При введении в раствор, содержащую такую медиаторную систему, вещества, обладающего антиоксидантными свойствами, протекает химическая реакция между окисленной формой медиатора и антиоксидантом. Изменение потенциала индикаторного электрода в этой системе служит источником информации об антиоксидантной активности вещества.
n∙ [Fe(CN)6]-3 + m∙АО = n∙ [Fe(CN)6]-4 + m∙AOОx (1)
где АО — антиоксидант, AOОx — продукт окисления антиоксиданта;
n, m — стехиометрические коэффициенты реакции.
Следует отметить, что выбор медиаторной системы должен отвечать ряду требований: термодинамическая возможность протекания химической реакции реагента с основными антиоксидантами, обратимость электродной реакции медиаторной системы, быстрое установление равновесного потенциала, Нернстовская зависимость потенциала от изменения концентрации компонентов системы и достаточно высокая скорость реакции с основными антиоксидантами.
Экспериментально нами установлено, что для получения адекватного аналитического сигнала датчика в качестве медиаторной системы оптимально использовать смесь 0,005М K3 [Fe(CN)6] и 0,0001М K4 [Fe(CN)6] в 0,05М растворе фосфатного буфера с рН 6,86. Аналитический сигнал датчика в такой системе хорошо воспроизводим, предлогарифмический коэффициент k = d(ΔE) / d(lg(COx / CRed)) близок к Нерстовской зависимости и составляет 56 ± 1 мв. Время установления потенциала электрохимического датчика не превышало 15 секунд. Инжекция с помощью дозатора пипеточного типа анализируемой пробы, объемом 1,0 мл в рабочую микрокамеру датчика, обеспечивает ее многократную промывку самим анализируемым раствором, что обеспечивает воспроизводимость аналитического сигнала.
В качестве стандарта антиоксидантной активности нами выбрана аскорбиновая кислота, окисление которой до дегидроаскорбиновой кислоты происходит в результате ее взаимодействия с окисленной формой [Fe(CN)6]-3 — ионов.
С6Н8О6 + 2 [Fe(CN)6]-3 = С6Н6О6 + 2 [Fe(CN)6]-4 + 2 Н+ (2)
Как известно, аскорбиновая кислота способна восстанавливать многие электроактивные вещества неорганической и органической природы, которые также способны проявлять как антиоксидантные, так и прооксидантные свойства [14]. К тому же при действии сильных окислителей аскорбиновая кислота может окисляться в треоновую и щавелевую кислоты. Поэтому эквивалент аскорбиновой кислоты может изменяться в зависимости от силы окисляющего ее окислителя [15].
В связи с этим, сумма антиоксидантов, присутствующих в растениях, напитках, продуктах питания по-разному может взаимодействовать с ред-окс системой медиатора, и определить стехиометрические коэффициенты в уравнении (1) взаимодействия антиоксиданта с окисленной формой медиатора, как предлагают авторы [13], практически не представляется возможным. В этом случае потенциал индикаторного электрода в растворе, содержащем медиаторную систему и антиоксиданты, будет представлять аддитивную составляющую различных взаимодействий всех присутствующих в анализируемой пробе компонентов.
Выход из этого положения нам видится в проведении измерения потенциала электрода в анализируемом растворе с последующим его сравнением с условно принятым антиоксидантом-стандартом, например с концентрацией аскорбиновой кислоты 1,0 мг/мл.
Нами исследована зависимость сигнала датчика от концентрации аскорбиновой кислоты в медиаторной системе 0,005М K3 [Fe(CN)6] / 0,0001М K4 [Fe(CN)6].
На рисунке 1 приведена калибровочная зависимость E = f (lgCAK)
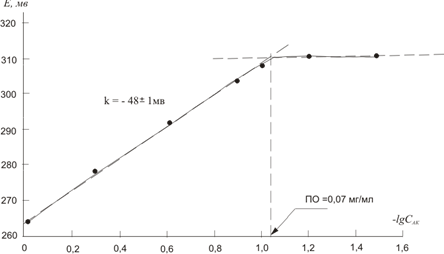
Рис. 1. Калибровочный график для определения аскорбиновой кислоты в модельных растворах.
Из рисунка 1 следует, что график зависимости аналитического сигнала электрохимического датчика от логарифма концентрации аскорбиновой кислоты линеен в диапазоне концентраций 0,1–1,0 мг/мл с предлогарифмическим коэффициентом (наклоном) -48±1 мв на декаду. Предел обнаружения составляет ~ 0,07 мг/мл. Такая чувствительность достаточна для обнаружения потенциально значимой антиоксидантной активности большинства веществ растительного происхождения.
Учитывая линейность зависимости E = f (lgCAK) в диапазоне концентраций аскорбиновой кислоты 0,1 ÷ 1 мг/мл и хорошую воспроизводимость аналитического сигнала, количественное определение антиоксидантной активности образцов проводили без построения калибровочного графика по формуле: 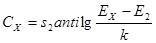 ;
;
где s2 — концентрация стандарта аскорбиновой кислоты, соответствующей верхней границе ожидаемого диапазона анализируемых растворов, т.е 1,0 мг/мл
k — крутизна электродной функции датчика: 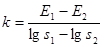 ;
;
где Е1 и Е2 устойчивые показания потенциометра при измерении стандартов растворов аскорбиновой кислоты с концентрациями, соответствующими нижней (s1 = 0,1 мг/мл) и верхней (s2 = 1,0 мг/мл) границе ожидаемого диапазона анализируемых растворов, а ЕХ — показания потенциометра в анализируемом растворе.
В таблице 1 приведены значения антиоксидантной активности водных и спиртовых (водочных) экстрактов растений флоры Ферганской долины.
Таблица 1
Значения антиоксидантной активности водных и спиртовых (водочных) экстрактов растений флоры Ферганской долины
|
№/№ |
Наименование |
Латинское название |
АОА, мг/мл водный экстракт |
АОА, мг/мл(г) спиртовый экстракт (40 % этанол) |
|
1. |
Тысячелистник |
Achillea |
0,097 |
0,216 |
|
2. |
Александрийский лист (сена) |
Folium Sennae |
< П.О.* |
0,171 |
|
3. |
Пижма |
Tanacetum |
0,228 |
0,202 |
|
4. |
Бессмертник |
Hypericum |
0,274 |
0,345 |
|
5. |
Полынь горькая |
Artemisia absinthium |
0,122 |
0,214 |
|
6. |
Солодка |
Glycyrrhizae radices |
0,087 |
0,173 |
|
7. |
Шафран |
Crocus |
< П.О.* |
0,177 |
|
8. |
Аир обыкновенный |
Acorus calamus |
0,110 |
0,171 |
|
9. |
Шиповник |
Rosa |
0,210 |
0,387 |
|
10. |
Чабрец (тимьян) |
Thymus |
0,226 |
0,287 |
|
11. |
Хвощ полевой |
Equisetum arvese |
< П.О.* |
0,189 |
|
12. |
Лисий хвост |
Alopecúrus |
0,080 |
0,149 |
|
13. |
Тмин |
Carum |
0,074 |
0,144 |
|
14. |
Девясил (желтый цвет) |
Inula |
0,237 |
0,255 |
|
15. |
Боярышник |
Crataegus |
0,082 |
0,306 |
|
16. |
Зверобой |
Hypericum |
0,305 |
0,379 |
|
17. |
Ромашка аптечная |
Matricaria chamomila |
0,215 |
0,324 |
|
18. |
Мелисса |
Melissa officinalis |
0,160 |
0,190 |
* П.О. — предел обнаружения
Водные настои александрийского листа, шафрана, хвоща, тмина показали низкую антиоксидантную активность. В то же время спиртовые экстракты, проведенные 40 % этиловым спиртом, показали более значительные антиоксидантные активности для всех исследуемых растений. Объяснение этому можно дать, допуская, что растворы этилового спирта в большей степени извлекают антиоксиданты из растений, причем не только водо-, но и частично жирорастворимые, при этом прямой корреляции не наблюдается.
На рисунке 2 приведена диаграмма антиоксидантной активности водных и спиртовых экстрактов исследуемых растений относительно принятого нами стандарта аскорбиновой кислоты.
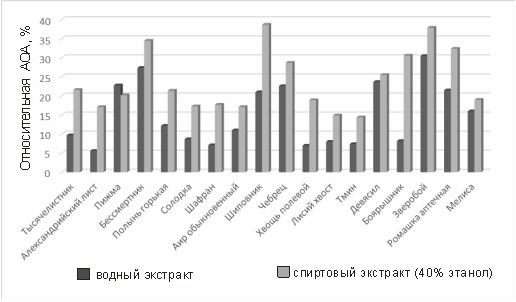
Рис. 2. Сравнительная диаграмма антиоксидантной активности водных и спиртовых экстрактов растений относительно условно принятого стандарта аскорбиновой кислоты (1 мг/мл).
Выводы
1. Исследована суммарная антиоксидантная активность водных и спиртовых (водочных) экстрактов 18 растений, произрастающих в Ферганской долине и признанными народной медициной лекарственными.
2. Все из исследуемых растений обладают в той или иной степени антиоксидантной активностью. При этом водные экстракты бессмертника, шиповника, чабреца, девясила и зверобоя обладают более ярко-выраженной суммарной антиоксидантной активностью, по сравнению с другими исследуемыми растениями.
3. Спиртовые (водочные) экстракты всех исследуемых растений обладают антиоксидантной активностью, превышающую таковую для водных экстрактов в 1,5–2,5 раза, что может быть объяснено лучшей экстрагируемостью биологически активных веществ из биомассы растений.
Литература:
1. Халматов Х. Х. Растения Узбекистана с диуретическим действием. –Ташкент: Медицина, 1979. — 47 с.
2. Камелин Р. В. Флорогенетический анализ естественной флоры горной Средней Азии. — Л:, 1973. — 356 с.
3. Ферганская долина / Википедия.ru.wikipedia.org/wiki/.
4. Арифханова М. М. Растительность Ферганской долины. — Ташкент:, 1967. -294 с.
5. Павлюченко И. И., Юсупов М. Ю., Никитин М. В., Басов А. А. Фитопрофилактика как массовое средство охраны здоровья населения. Окислительный стресс (проблемы мониторинга и коррекции с использованием природных антиоксидантов). — Краснодар: Изд-во Кубанского Гос.Мед.Унив-та / www/fitobfiz.ru/book/info.php#10.
6. Яшин Я. И., Рыжнев В. Ю., Яшин А. Я., Черноусова Н. И. Природные антиоксиданты. Содержание в пищевых продуктах и их влияние на здоровье и старение человека. — М:, 2009.
7. Абдурахманов А. А., Худойбердиев Т. Х, Урманов С. М., Акбаров А. С. Микроэлементный состав некоторых дикорастущих полезных растений южной Ферганы и их фитоиндикационные особенности // XI всесоюзная конф. по биологической роли микроэлементов и их применении в сельском хозяйстве и медицине. Самарканд, 1990. —Т. 2. — С. 160–161.
8. Игамбердиева П. К., Абдурахмонов М. А. Элементный состав растений ферганской долины и перспективы их использования в медицинской практике // «Современная медицина: актуальные вопросы»: материалы межд. заочной научно-практич. конференции. (30 апреля 2012 г.) Россия, г.Новосибирск, 30 апреля 2012 г.
9. Игамбердиева П. К., Ибрагимов А. А. Распространение химических элементов в ферганских видах полыни: Аrtemisia ferganensis, А.annua, А.scoparia.// Cборник «Новые достижения в химии и химической технологии растительного сырья». — Барнаул. — 2009. — С. 236–237.
10. Общие методы анализа. Лекарственное сырье. Настои и отвары // Государственная фармакопея СССР. 11-е изд. Вып. 2. — М:, 1990. — С. 147.
11. Billo E. J. Excel ®for Chemists: A Comprehensive Guide. — N.Y, 2001 by John Wiley & Sons.Inc.
12. Хасанов В. В., Рыжова Г. Л., Мальцева Е. В. Методы исследования антиоксидантов // Химия растительного сырья. — 2004. -№ 3. — C. 63–95.
13. Брайнина Х. З., Иванова А. В., Шарафутдинова Е. Н. Оценка антиоксидантной активности пищевых продуктов методом потенциометрии // Известия высших учебных заведений // Пищевая технология. — 2004. — № 4. — C. 73–75.
14. Рогожин В. В. Пероксидаза как компонент антиоксидантной системы живых организмов. — СПб.: ГИОРД, 2004. — 240 с.
15. Крешков А. П. Основы аналитической химии. Теоретические основы. Количественный анализ. Т.2. — М.: Химия, 1971. –С.276.

