Предлагается амперометрический метод и датчик для измерения суммарной антиоксидантной активности веществ. В основе метода лежит процесс электровосстановления кислорода в отсутствии и при наличии в растворе антиоксидантов различного происхождения. Измерение аналитического сигнала до и после введения в электрохимическую ячейку вещества-антиоксиданта осуществляется с помощью портативного двухэлектродного датчика, типа «карандаш», с посеребряным катодом, на который накладывается потенциал -500 мв от источника постоянного тока (батарейки). В качестве антиоксидантного стандарта условно принят 1 % раствор аскорбиновой кислоты в фосфатном буфере с рН 6,86. Датчик подключен к измерительно-задающему устройству через микросхему — операционный усилитель.
Измеряемый сигнал в условных единицах высвечивается на жидкокристаллическом экране задающе-измерительного прибора и характеризует максимальный ток деполяризации индикаторного электрода. С помощью резисторов измерительного прибора выставляется диапазон 0–100 единиц, для аналита в отсутствии антиоксиданта и в присутствии эталона — 1 % раствора аскорбиновой кислоты, условно принятого за 100 %, соответственно. Таким образом, антиоксидантная активность веществ может быть измерена в процентах относительно аскорбиновой кислоты (или другого антиоксиданта). Приводятся результаты определения суммарной антиоксидантной активности некоторых напитков и водно-спиртовых экстрактов лекарственных растений.
Ключевые слова: вольтамперометрия, электровосстановление кислорода, амперометрический датчик, антиоксиданты
Введение
Интенсивные исследования последних лет по созданию способов оценки антиоксидантных (АО) свойств различных веществ свидетельствуют о том, что проблема разработки новых, экспрессных, универсальных и доступных методик для их определения остается актуальной [1–3].
Существующие способы контроля АО, основаны на применении хроматографических [4–8], спектрофотометрических [9,10] и хемилюминесцентных [11–13] методов, которые характеризуются как трудоемкие, длительные и дорогостоящие. Результаты исследований часто несопоставимы, поскольку получены с использованием различных модельных систем [14]. Остается открытым вопрос: каким должен быть критерий оценки антиоксидантной активности веществ? Что следует принимать за эталон антиоксидантной активности (АОА)? Для ответа на поставленные вопросы необходима адекватная система оценки антиоксидантной активности, позволяющая правильно интерпретировать полученные результаты и проводить их сравнение с разными модельными системами. Таким образом, проблема определения АОА заключается не столько в методическом и инструментальном подходе, сколько в методологическом.
Практически всеми исследователями, занимающимися проблемами определения антиоксидантной активности природных и синтетических антиоксидантов отмечается, что основное свойство АО заключается в их способности легко окисляться и принимать участие в радикальных и окислительно-восстановительных реакциях, что сопровождается передачей электронов. Поэтому определенную перспективу представляют способы определения антиоксидантной активности веществ с помощью электрохимических методов, которые характеризуются низкой себестоимостью, высокой чувствительностью, возможностью анализировать как водные, так и неводные среды.
В настоящее время из способов определения антиоксидантной активности веществ с использованием электрохимических методов анализа можно выделить: кулонометрические [15,16], потенциометрические [18–21], амперометрические [5,17,22], вольт-амперометрические [23,24].
Все эти методы имеют свои достоинства, но и не лишены недостатков. В этих методах суммарная антиоксидантная активность определяется по ингибированию сигнала в присутствии антиоксидантов в модельной или естественной медиаторной системе.
Учитывая, то, что вольтамперометрический метод, как и сами антиоксиданты, весьма чувствителен к наличию в среде растворенного кислорода и его активных радикалов, Томскими учеными Ю. А. Карбаиновым, Е. И. Коротковой др. был предложен новый подход к определению суммарной антиоксидантной активности объектов, используя в качестве модельной медиаторной системы процесс электровосстановления кислорода в отсутствии и при наличии в растворе антиоксидантов различного происхождения [24–26].
Установленные закономерности процесса электрохимического восстановления О2 в присутствии антиоксидантов позволяют более оптимально использовать данный процесс в аналитических целях.
Целью настоящего исследования является развитие вольтамперометрического принципа электрохимического определения суммарной антиоксидантной активности веществ и разработка новых алгоритмов ее определения с использованием разработанного амперометрического датчика.
Материалы иметоды
В работе использовали универсальный полярограф ПУ-1, подключенный к компьютеру посредством 8-ми битной звуковой карты [27]. Вольтамперограммы снимали в стеклянной ячейке по трех- и двухэлектродным схемам подключения. Рабочий электрод представлял собой посеребряную или амальгамированную медную проволоку. Вспомогательный электрод — стержень из углеграфита марки СУ и очищенная медная проволока. В трех-электродной схеме все измерения проводились относительно насыщенного хлорсеребряного электрода ЭВЛ-1М3.
Серебрение рабочего электрода, проводили, опуская очищенную концентрированной азотной кислотой и затем отмытую дистиллированной водой медную проволоку диаметром 1 мм в 0,1 М раствор AgNO3 на 5 минут. Затем электрод высушивали при 1100 С, полировали фильтровальной бумагой, и вновь погружали в раствор азотнокислого серебра. Операцию проводили 3–4 раза до образования на поверхности однородного покрытия серебром.
Амальгамирование проводили аналогичным способом, погружая очищенную медную проволоку в 0,1 М раствор Hg(NO3)2.
В работе также были использованы иономер И-130 М (ЗИП, Гомель, Беларусь), работающий в режиме рН метра, со стеклянным электродом марки ЭСЛ-63Г и кислородомер Tecnomiers 5221 (Польша).
В качестве испытуемых растворов были использованы растворы аскорбиновой кислоты известной концентрации, по 0,2 мл которых вводили в ячейку с фоновым электролитом (0,05 М фосфатный буфер, рН 6,86 и 0,05М тетраборатный буфер с рН 9,18).
Исследованиям на антиоксидантую активность подвергались веществ растительного и животного происхождения, а также некоторые напитки.
Результаты иобсуждение
Известно, что электровосстановление кислорода на электроде идет в несколько стадий с генерацией на поверхности электрода активных форм кислорода [28]:
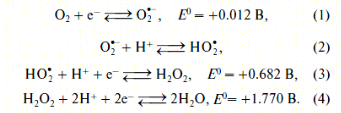
Для определения активности антиоксидантов авторами [28,29] было предложено использовать первую волну электровосстановления О2, соответствующую стадиям (1)–(3), когда на поверхности индикаторного электрода образуются активные кислородные радикалы и перекись водорода как конечный продукт. Однако, при оценке влияния природы антиоксидантов на процесс электровосстановления кислорода было замечено, что они по-разному влияют на данный процесс, при этом сами не являясь электрохимически активными в данной области потенциалов (Е = 0…–1.0 В). Поэтому все известные антиоксиданты разбили на три группы (табл.1.) [29].
Таблица 1
Группы веществ, различающихся по характеру влияния на процесс электровосстановления (ЭВ) кислорода
|
№группы |
Название веществ |
Влияние на ЭВ О2 |
Предполагаемый электродный механизм |
|
1. |
Металлокомплексы: каталаза, фталоцианины, порфирины металлов, гуминовые кислоты |
Увеличение тока ЭВ О2, сдвиг потенциала в отрицательную область |
Механизм ЕС с частичной регенерацией молекулярного кислорода |
|
2. |
Соединения фенольной природы, витамины А, Е, С, В, флавоноиды, убихиноны, глюкоза |
Уменьшение тока ЭВ О2, сдвиг потенциала в положительную область |
Механизм ЕС |
|
3. |
N, S, Se-содержащие соединения, амины, аминокислоты, активные альдегиды |
Уменьшение тока ЭВ О2, сдвиг потенциала в отрицательную область |
Механизм СЕС |
Примечание: Е — электродная стадия процесса, С — химическая реакция
Из указанных групп вторая группа веществ наиболее многочисленная, так как именно эти вещества относят к классическим АО. Вещества этой группы уменьшали ток электровосстановления О2, сдвигая потенциал в положительную область и проявляя механизм ЕС с последующими химическими реакциями взаимодействия АО с активными кислородными радикалами. Предполагается, что вещества третьей группы взаимодействуют преимущественно по СЕ_механизму с молекулярным кислородом, растворенным в электролите, или СЕС_механизму с предшествующей и последующей химическими реакциями взаимодействия АО с О2 и продуктами его восстановления.
Возможная модель этого процесса может быть представлена следующей схемой: [26,29].
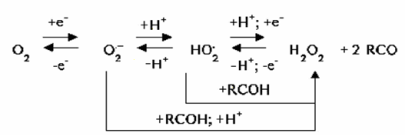
где RCOH и RCO восстановленная и окисленная формы вещества-антиоксиданта, соответственно.
Из предложенной модели следует, что ЭВ О2 — сложный, многостадийный процесс, причем реализация каждой стадии, ее обратимость, кинетические параметры зависят от ряда факторов. Поэтому в данном случае целесообразно рассматривать лишь замедленную стадию катодного восстановления кислорода, что значительно упрощает схему электродного процесса ЭВ О2 для средних значений рН: 3<рН<10 в водных средах:
О2 + е– ![]() О2˙ + R-OH + Н+
О2˙ + R-OH + Н+ ![]() H2O2 + R=O
H2O2 + R=O
Основываясь на этой схеме, нами был исследован электрохимический процесс электровосстановления кислорода на электродах из различных материалов, а также адекватность получаемого аналитического сигнала на наличие в растворе антиоксидантов.
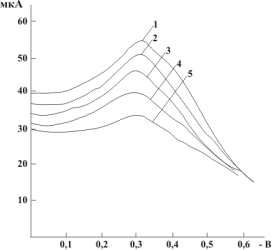
На рисунке 1. представлены вольтамперные зависимости ЭВ О2 на посеребряном и амальгамированном электродах в фоновом электролите без и в присутствии антиоксиданта (аскорбиновой кислоты) на фоне фосфатного и тетраборатного буферных растворов с рН 6,86 и 9,18 соответственно.
Как видно из рисунков потенциал поляризации первой волны электровосстановления растворенного кислорода для амальгамированного электрода смещается в область более отрицательных значений, по сравнению с таковыми для посеребряного электрода. Для посеребряного электрода значения предельного тока также выше, чем для амальгамированного.
|
|
|
|
а |
б |
|
Рис. 1. Поляризационная кривая ЭВ О2 на посеребряном (а) и амальгамированном (б) электроде в фосфатно-буферном растворе с рН 6,86, содержащим различные концентрации аскорбиновой кислоты. 1 — фон; 2–0,25 % аскорбиновой кислоты; 3–0,50 % аскорбиновой кислоты; 4–0,75 % аскорбиновой кислоты; 5–1,0 % аскорбиновой кислоты | |
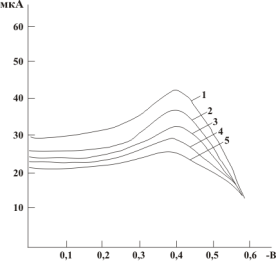
На рисунке 2 представлены поляризационные кривые для этих же электродов на фоне тетраборатного буфера с рН 9,18.
|
|
|
|
Рис 2. Поляризационная кривая ЭВ О2 на посеребряном электроде. (рН 9,18): 1 — фон, 2–0,25 % аскорбиновой кислоты, 3–0,50 % аскорбиновой кислоты, 4–0,75 % аскорбиновой кислоты, 5–1,0 % аскорбиновой кислоты |
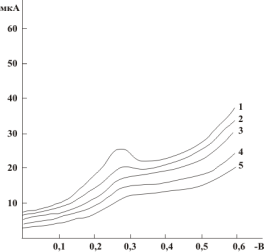
Рис. 3 Поляризационная кривая ЭВ О2 на амальгамированном электроде. (рН 9,18): 1 — фон, 2 — настой зеленого чая. Разбавление 1:4, 3 — настой зеленого чая. Разбавление 1:2, 4 — настой зеленого чая исходной концентрации |
Предельные токи электровосстановления кислорода в присутствии антиоксиданта ниже значений, получаемых на фоне фосфатного буфера с рН 6,86 и значения потенциала поляризации смещаются в менее отрицательную область.
Поляризационные кривые ЭВ кислорода на амальгамированном электроде при рН 9,18, полученные в присутствии антиоксидантов чая показывают явную зависимость величины тока деполяризации индикаторного электрода от концентрации вещества-антиоксиданта.
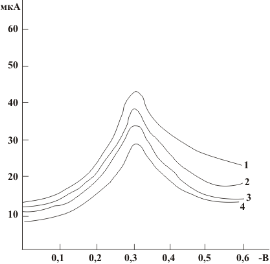
На рис. 4 приведены зависимости величины предельного тока от концентрации раствора аскорбиновой кислоты для посеребряного (1) и амальгамированного (2) электродов. Коэффициенты регрессии R2 для этих зависимостей составляют 0,988 и 0,984 соответственно, что, в принципе, равнозначно. Тангенсы углов наклона градуировочного графика в первом случае несколько больший: tg α1 = 0,3838 и tg α2 = 0,3057 соответственно.
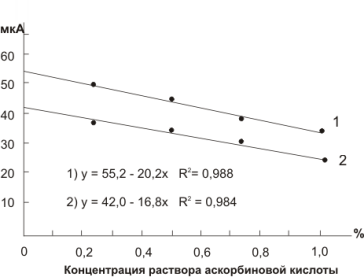
Рис. 4. Концентрационные зависимости предельного тока от концентрации аскорбиновой кислоты для посеребряного (1) и амальгамированного (2) электродов.
Таким образом, проведенные исследования показали, что посеребряный и амальгамированный электроды дают адекватный отклик на присутствие в растворе вещества-антиоксиданта. В то же время посеребряный электрод в большей мере отвечает требованиям экологичности анализа.
Результаты проведенных исследований послужили основанием для разработки портативного амперометрического датчика для измерения суммарной антиоксидантной активности веществ [30].
В основе метода лежит измерение тока деполяризации рабочего электрода, в процессе катодного электровосстановления (ЭВ) растворенного в буферной среде кислорода до и после введения в электрохимическую ячейку вещества-антиоксиданта.
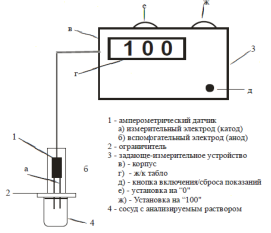
На рисунке 5показаны принципиальная схема (а), общий вид (б) и способ использования амперометрического датчика для определения суммарной АОА.
 а
а
 б
б
 в
в
Рис. 5. Принципиальная схема (а), общий вид (б) и способ использования (в) амперометрического датчика для определения суммарной АОА.
Датчик включает в себя рабочий электрод — катод из посеребряной медной проволоки диаметром 1 мм и вспомогательный электрод из медной проволоки или углеграфитового стержня, диаметром 1–2 мм. На катод накладывается опорное напряжение -500 мв от источника постоянного тока (батарейки). Этот потенциал, соответствует первой волне ЭВ кислорода в слабо протонированных растворах. Датчик подключен к измерительно-задающему устройству через микросхему — операционный усилитель, обеспечивающую индикацию максимального тока деполяризации, а также возможность установления диапазона шкалы.
Перед началом работы датчик калибруют, погрузив его в буферный раствор (0,5 М фосфатный буфер, рН = 6,86). Показания на цифровом табло с помощью резистора на корпусе устройства устанавливают на «0». Затем в буферный раствор вводится дозируемый объем раствора вещества — антиоксиданта, например аскорбиновой кислоты, определенной концентрации, и показания прибора с помощью второго резистора устанавливают на «100». С помощью откалиброванного прибора производят измерения АОА других биопрепаратов. Таким образом, АОА растворов веществ может быть измерена в процентах относительно аскорбиновой кислоты (или другого антиоксиданта).
Небольшие габариты задающе-измерительного устройства позволяют разместить его на запястье правой руки оператора с помощью ремешка-«репейника».
Работоспособность любого аналитического устройства будет характеризоваться воспроизводимостью результатов измерения. В нашем случае этот параметр напрямую связан с характеристиками рабочего электрода. В связи с этим была изучена динамика изменения аналитического сигнала датчика с посеребряным рабочим электродом во времени, позволяющая установить оптимальный срок службы электрода без дополнительной регенерации.
Были проведены серии измерений стабильности показаний датчика по 10 измерениям в каждой серии. За время, ограничивающее службу рабочего электрода, принималось 10 % уменьшение сигнала.
Результаты наблюдения представлены на рисунке 6.

Рис. 6. Динамика изменения аналитического сигнала рабочего электрода (посеребряная медная проволока) во времени.
Как следует из этой диаграммы, ресурс работы индикаторного электрода соответствует не менее 250 измерениям. После этого следует провести очередную регенерацию, заключающуюся в очистке поверхности электрода раствором азотной кислоты и нанесения на нее слоя серебра. Таким образом, при лабораторной эксплуатации датчика ресурс его работы может составить 7–10 суток. Это вполне приемлемо, учитывая тот факт, что регенерация поверхности рабочего электрода не является трудоемкой и сложной операцией.
В ходе лабораторных исследований было проведено измерение антиоксидантной активности водно-спиртовых растворов веществ растительного и животного происхождения, а также некоторых напитков (красное вино). За 100 % АОА принималось значение активности 1 % раствора аскорбиновой кислоты. Были исследованы настои зеленого чая, танина, шалфея, ромашки, пивных дрожжей, вина. Во всех случаях, кроме измерения АОА дрожжей, применялись 1 % растворы указанных веществ. Зеленый чай, ромашку и шалфей (1г сухого веса) настаивали в дистиллированной воде при t = 550 C в течение 30 минут с последующим охлаждением до комнатной температуры. Дрожжи в количестве 100 мг разводили в 10 мл дистиллированной воды.
Нами уже отмечалось, что антиоксидантная активность веществ обусловлена их способностью связывать молекулярный кислород и его радикалы в растворах электролитов. С целью установления адекватности получаемого аналитического сигнала датчика именно с присутствием в растворе вещества антиоксиданта, нами проведено сравнение результатов измерения с помощью электрода Кларка и разработанного амперометрического датчика. Результаты измерений сведены в таблицу 2.
Таблица 2
Результаты оценки антиоксидантной активности некоторых веществ
|
Наименование препарата, обладающего АОА |
Разведение исходного раствора | ||
|
1:10 |
1:4 |
1:2 | |
|
Зеленый чай |
45 |
55 |
65 |
|
Танин |
18 |
24 |
35 |
|
Шалфей |
25 |
35 |
45 |
|
Ромашка |
35 |
45 |
55 |
|
Дрожжи |
55 |
70 |
85 |
|
Красное вино |
64 |
95 |
110 |
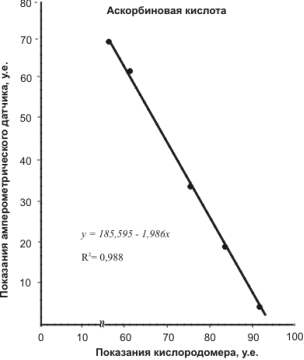
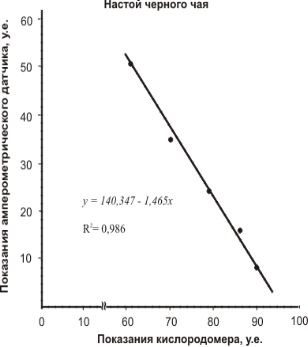
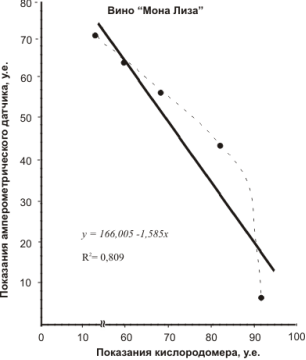
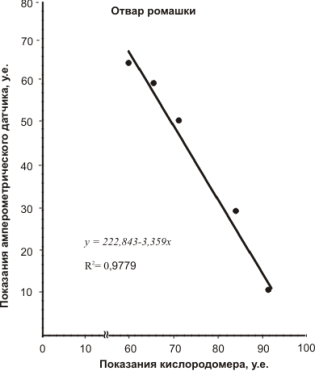
Для этого электрод Кларка, подключенный к соответствующему разъему кислородомера Tecnomiers 5221, погружали в ячейку — стакан с 20 мл дистиллированной воды. На чувствительности «50» измерительной шкалы кислородомера выставляли максимальное значение (у нас это соответствовало «90»). Затем с помощью микропипетки вводили в ячейку раствор вещества-антиоксиданта с шагом 0,1 мл. После каждого добавления записывали показания шкалы кислородомера. Параллельно проводили замеры с помощью амперометрического датчика. Результаты измерений представлены корреляционными зависимостями на рисунках 7.
Как видно из корреляционных зависимостей аналитический сигнал, получаемый с помощью разработанного амперометрического датчика, хорошо согласуется с измерениями концентрации растворенного кислорода.
Коэффициент корреляции, за исключением вина «Мона Лиза» составляет 0,98. Сравнительно низкая корреляция R2 =0,8 для красного десертного вина «Мона Лиза» может быть объяснена, тем, что в вине помимо антиоксидантов фенольной природы содержатся антиоксиданты, относящиеся к 3-ей группе (табл. 1), а именно N, S, Se-содержащие соединения, амины, аминокислоты, активные альдегиды.
|
|
| |
|
|
| |
Рис. 7. Корреляция аналитического сигнала, получаемого различными методами для растворов некоторых антиоксидантов
Разработанный амперометрический датчик был использован в оценке относительной антиоксидантной активности водно-спиртовых экстрактов растений и аптечных сборов. В качестве сравнения был аналитический сигнал датчика в 1 % водном растворе аскорбиновой кислоты, который принимали за 1 (100 %).
Результаты исследований представлены диаграммой на рис. 8.
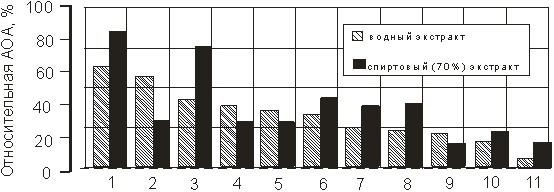
Рис. 8. Относительная антиоксидантная активность водно-спиртовых растворов некоторых растений и аптечных сборов (стандарт 1 % раствор аскорбиновой кислоты): 1- сок алоэ, 2-родиола розовая, 3-облепиха, 4-лист смородины, 5-кора дуба, 6-листья подорожника, 7- корни полыни обыкновенной, 8 — кукурузные рыльца, 9 — цветы тысячелистника обыкновенного, 10-зверобой, 11- цветы одуванчика обыкновенного
Как видно из приведенного рисунка, исследуемые экстракты растений обладают различной антиоксидантной активностью. При этом спиртовые растворы, как правило, имеют большие значения суммарной АОА.
Полученные результаты свидетельствует о том, что предлагаемый способ оценки АОА препаратов может быть использован для скрининга веществ антиоксидантов природного и синтетического происхождения.
Литература:
- Владимиров Ю. А. Свободные радикалы и антиоксиданты // Вестн. АМН РФ. — 1998. — № 7. — С. 43–51.
- Будников Г. К., Зиятдинова Г. Л. Антиоксиданты как объекты биоаналитической химии // Журн. аналит. химии. — 2005. — Т. 60, № 7. — С. 678–691.
- Лапин А. А., Борисенков М. Ф., Карманов А. П. и др. Антиоксидантные свойства продуктов растительного происхождения // Химия растит. сырья. — 2007. — № 2. — С. 79–83.
- Семенистая Е. Н., Ларионов О. Г. Изучение состава и антиоксидантной активности растительных экстрактов методом ВЭЖХ с УФ- и амперометрическим детектированием // Хим.-фарм. журнал. — 2008. — Т. 42. — С. 43–48.
- Яшин Я. И., Яшин А. Я. Анализ пищевых продуктов и напитков методами высокоэффективной жидкостной и ионной хроматографии с электрохимическими детекторами // Журн. аналит. химии. — 2004. — Т. 59, № 12. — С. 1237–1243.
- Кочетова М. В., Семенистая Е. Н., Ларионов О. Г., Ревина А. А. Определение биологически активных фенолов и полифенолов в различных объектах методами хроматографии // Успехи химии. — 2007. — Т. 76, № 1. — С. 89 –100.
- Alonso-Salces R. M., Barranco A., Corta E., Berrueta A., Gallo B. Validated solid–liquid extraction method for the HPLC determination of polyphenols in apple tissues:comparison with pressurized liquid extraction // Talanta. — 2005. — Vol. 65. — P. 654–662.
- Weiss D. J., Anderton C. R. Determination of catechins in matcha green tea by micellarelectrokinetic chromatography // J. Chromatogr. A. — 2003. — Vol. 1011. — P. 173–180.
- Машенцева А. А., Казбекова А. Т., Сейтембетов Т. С. Оптические методы исследования антиоксидантной активности полифенольных соединений и экстрактов на основе растительного сырья in vitro и in vivo // Вестн. КарГУ. Сер. Химия. —2009. — № 1(53). — С. 26–34.
- Горячева Н. Г., Кочетова М. В., Шаненко Е. Ф., Ревина А. А., Ларионов О. Г. Исследование фенольных соединений экстракта хмеля с помощью спектрофотометрического метода и ВЭЖХ // Пиво и жизнь. –2003. — Т.37, № 2. — С. 27–34.
- Теслюк О. И., Бельтюкова С. В., Ливенцова Е. О. Определение кофеина по тушению сенсибилизированной люминесценции комплексного соединения иона Tb(III). // Вісник ОНУ. Сер. Хімія. — 2013, Т. 18, вип.1(45). — С. 57–62.
- Бельтюкова С. В., Бичкова Г. О. Люмінесцентне визначення суми поліфенольних сполук у лікарських рослинах // Фармацевтичний журнал. — 2001. — № 5. — С. 82–86.
- Бельтюкова С. В., Бычкова А. А. Определение катехинов методом твердофазной люминесцентной спектроскопии // Методы и объекты хим. анализа. — 2012. — Т. 7, № 2. — С. 76–81.
- Хасанов В. В., Рыжова Г. Л., Мальцева Е. В. Методы исследования антиоксидантов // Химия растительного сырья. -2004. -№ 3. -C. 63–95.
- Абдуллин И. Ф., Турова Е. Н., Будников Г. К. Кулонометрическая оценка антиоксидантной способности экстрактов чая электрогенерированным бромом // Журн. аналитической химии. -2001. -Т. 56. -№ 6. -С. 627–629.
- Абдуллин И. Ф., Турова Е. Н., Будников Г. К., Зиятдинова Г. К., Гайсина Г. Х. Электрогенерированный бром — реагент для определения антиоксидантной способности соков и экстрактов // Заводская лаборатория. Диагностика материалов. -2002. -Т. 68. -№ 9. -С. 12–15.
- Патент РФ № 2238554. Способ определения суммарной антиоксидантной активности биологически активных веществ / Пахомов В. П., Яшин Я. И., Яшин А. Я., Багирова В. Л., Арзамасцев А. П., Кукес В. Г., Ших Е. В.
- Брайнина Х. З., Иванова А. В., Шарафутдинова Е. Н. Оценка антиоксидантной активности пищевых продуктов методом потенциометрии // Известия высших учебных заведений // Пищевая технология. — 2004. — № 4. — C. 73–75.
- Патент РФ № 2235998 Способ измерения антиоксидантной активности веществ / Брайнина Х. З., Иванова А. В. Заявл.. 14.11.2002. Опубл. 10.09.2004. Бюл. № 25.
- Brainina Kh., Ivanova A., Sharafutdinova E. et al Potentiometry as a method of antioxidant activity investigation // Talanta.— 2007. — Vol. 71. — Issue 1. — P. 13–18.
- Аронбаев Д. М. Апробация метода и прибора для определения антиоксидантной активности лекарственных растений и фитосборов на их основе // Inter-Medical. — 2015. — № 8.–С.17–21.
- Яшин А. Я., Яшин Я. И., Черноусова Н. И., Пахомов В. П. Новый прибор для определения природных антиоксидантов. М.: 2005. — 100 c.
- Короткова Е. И., Аврамчик О. А., Юсубов М. С., Белоусов М. В. Определение антиоксидантной активности экстрактов растительного сырья методом катодной вольтамперометрии // Химико-фарм. журн. –2003. — Т. 37, № 9. — С. 55–58.
- Короткова Е. И. Новый способ определения активности антиоксидантов // Журн. физ. химии. — 2000. –Т.74, № 9. — С. 1704–1706.
- Патент РФ № 2224997. Вольтамперометрический способ определения антиоксидантной активности веществ / Короткова Е. И., Карбаинов Ю. А.
- Аврамчик О. А. Закономерности процесса электровосстановления кислорода в присутствии антиоксидантов и их применение в аналитической практике // Автореф. дис. … канд. хим. наук — Томск, 2006. — 21 с.
- Аронбаев С. Д., Насимов А. М., Аронбаев Д. М., Насыров Р. Х. Компьютеризированный аналитический комплекс для инверсионной вольтамперометрии на базе универсального полярографа ПУ-1. // Научный вестник Самаркандского Государственного Университета.- 2009.- № 1(53). — С.47–50.
- Korotkova E. I., Karbainov Y. A., Shevchuk A. V. Study of antioxidant properties by voltammetry // Journal of Electroanalytical Chemistry. — 2002. — V. 518. — N1. — P. 56–60.
- Короткова Е. И. Вольтамперометрический метод определения суммарной антиоксидантной активности антиоксидантов в объектах искусственного и природного происхождения. // Дисс. …доктора хим.наук. — Томск, 2009. — 399 с.
- Аронбаев Д. М., Тен В. А., Насимов А. М., Аронбаев С. Д., Кабулов Б. А. Амперометрический датчик для измерения суммарной антиоксидантной активности биопрепаратов // Тез.докл.II съезд Аналитика России 23–27 сентября 2013 г. Москва, с.157.