Остеопороз — это многогранная, актуальная и сложная проблема современной медицины, порождающая значительно большее число вопросов, нежели ответов [5,24,35]. По данным Всемирной организации здравоохранения около 35 % переломов кости у женщин и 20 % травм у мужчин связанны с остеопорозом. Остеопорозом страдают около 75 млн. граждан Европы, США и Японии. В Европе в 2000 г количество остеопоротических переломов составило 3,79 млн случаев, из которых 890 тыс. составляли переломы шейки бедренной кости. В Европе летальность, связанная с остеопоротическими переломами, превышает онкологическую (за исключением смертности от рака легкого). Женщины после 45 лет проводят больше времени в больнице с остеопорозом, чем по поводу сахарного диабета, инфаркта миокарда и рака молочной железы. Кроме того, население планеты «стареет». В этой связи к 2050 г ожидается увеличение количества остеопоротических переломов шейки бедренной кости до 1 млн. случаев в год [32, 2].
Костная ткань, несмотря на кажущуюся стабильность, представляет собой метаболически активную, постоянно обновляющуюся систему. На протяжении жизни индивидуума в ней постоянно происходят циклы ремоделирования, включающие два основных процесса: разрушение «старой» кости — «костная резорбция», и последующий процесс формирования новой кости — остеогенез, то есть синтез нового костного матрикса с его последующей минерализацией [3,33,37,28]. Ремоделирование костной ткани, как известно, осуществляют два типа клеток. Процесс резорбции происходит при участии остеокластов (ОК), формирования новой кости — остеобластов (ОБ). Согласно современным представлениям, процесс костного ремоделирования осуществляется следующим образом. Активация образования ОК инициируется при взаимодействии гемопоэтических клеток–предшественников ОК с клетками линии ОБ, в котором, кроме того, участвуют Т–лимфоциты и их цитокины [21, 22]. После формирования ОК наступает ограниченная временными рамками фаза резорбции кости, затем процесс ее разрушения завершается, образовавшаяся полость покрывается слоем мононуклеарных клеток (предшественников ОБ), и начинается фаза формирования новой кости (биосинтез матрикса), которая по времени значительно продолжительнее фазы резорбции. При физиологическом цикле ремоделирования регуляция образования ОК и их резорбирующей активности осуществляется через контакт между клетками остеобластической и остеокластической линий. Моноцитарный–колиниестимулирующий фактор (M–CSF) взаимодействует со своим рецептором на ОК, что вызывает стимуляцию дифференцировки и пролиферации гемопоэтических клеток–предшественников ОК — пре-ОК. [10]. Важную роль в реакциях созревания, дифференцировки и пролиферации ОК играют не только женские половые гормоны (эстрогены) и три члена семейства цитокинов — фактора некроза опухолей (TNF), лиганд рецептора–активатора ядерного фактора NF–kB (RANKL); сам рецептор–активатор ядерного фактора NF–kB (RANK). При чем, RANKL синтезируется в ОБ, RANK — в гемопоэтических клетках, активирующих дифференцировку и поддерживающих функции ОК. Взаимодействие между RANKL и RANK, ведущее к активации NK–kB в клетках–предшественниках ОБ, составляет суть процесса активации образования кость–резорбирующих клеток — то есть ОК, их дифференцировки, пролиферации и созревания [12,13]. В ОБ образуется еще один цитокин-регу-лятор — ОПГ, который блокирует взаимодействие между RANKL и RANK и за счет этого оказывает антирезорбтивный эффект [14,6,20,11]. Нарушение баланса между процессами костного ремоделирования, превалирование костной резорбции над процессом формирования новой кости является центральным звеном патогенеза ОП. Таким образом, в контроле над процессами ремоделирования костной ткани большую роль играет иммунная система посредством иммунокомпетентных клеток и секретируемых ими цитокинов [19].
Известно, что остеопороз долгое время протекает совершенно скрыто. Проблема в первую очередь заключается в отсутствии настороженности, как со стороны пациента, так и врача. Кроме того, обычная рентгенография не выявляет остеопороз в ранней стадии. Остеопороз становится «заметен» на рентгенограмме только при снижении плотности костной ткани на четверть (25 %) и более [8, 9, 26]. Диагностика остеопороза является одной из наиболее актуальных проблем современной медицины. Ранний остеопороз выявляют только при компьютерной томографии или на магнитно-резонансном томографе. Однако, и денситометрия не всегда подтверждает клинический диагноз [24].
Еще одним проявлением нарушения процессов ремоделирования костной ткани является пародонтоз, который нередко называют «спутником» остеопороза [31]. Пародонтоз — тяжелейшее поражение тканей, которые окружают зубы, то есть тканей пародонта. Пародонтоз — одна из важнейших причин потери зубов. По приблизительной оценке Всемирной организации здравоохранения пародонтозом страдает около половины всего взрослого населения планеты [25]. И это страшно, если учесть, что пародонтоз, как и его ближайший «родственник» — остеопороз, долгое время протекает скрыто и проявляется внезапно. Патологический процесс в пародонте развивается медленно и бессимптомн [32].
На пародонте отражаются все изменения, которые происходят в том или ином органе, особенно в органах эндокринной системы [27, 23, 35]. Достаточно часто одновременно с изменениями в деснах пациенты отмечают боли в пояснице, коленях, плохой рост волос и ногтей. То есть при первых признаках пародонтоза имеются и признаки остеопороза. Наличие остеопороза особенно сильно ухудшает здоровье десны и способствует возникновению или обострению уже имеющегося пародонтоза [25]. Но здесь довольно сложно определить, что первично — остеопороз или пародонтоз.
Патогенез пародонтоза довольно сложен. Развивается данное заболевание в течение 10–15 лет, на фоне трофических нарушений центральной и периферической нервной систем, атеросклероза сосудов, задержки синтеза белка, нарушений обменных процессов, неблагоприятной наследственности, системного остеопороза, ряда других заболеваний систем и органов — сахарного диабета, хронических заболеваний почек, печени, нарушений реактивности организма [23, 24, 25]. То есть на фоне иммунодефицитных состояний самого различного генеза [16, 38].
Развившаяся и клинически проявляющаяся стадия пародонтоза, как правило, характеризуется наличием генерализованного гингивита, отечностью дёсен, их кровоточивостью, в большинстве случаев с выделением из них гноя. Другими словами, он манифестирует как обычный воспалительный процесс [27]. При этом отмечается обильное отложение плотного поддесневого камня, плотно прикрепляющегося к корням зубов. Отложение зубного камня в настоящее время рассматривают как один из самых очевидных стоматологических признаков как пародонтоза, так и остеопороза [25].
По всей видимости, в патогенезе пародонтоза большую роль играет вирусно-генетический компонент. Сравнительно недавно был найден ген- регулятор интерферона (фактора-8 или IRF-8), который, как оказалось, связан с развитием таких болезней, как остеопороз, артрит и пародонтоз [15]. Установлено, что при низкой экспрессии гена IRF-8 стимулируется «наработка» остеокластов, ответственных за разрушение костной ткани. Процесс развития остеокластов создаёт в костной и хрящевой тканях каналы, являющиеся характерными для ревматоидного артрита, остеопороза и пародонтоза [4,1,17,18]. Таким образом, как остеопороз, так и пародонтоз, на наш взгляд, являются проявлениями нарушения процессов остеогенеза, приводящих к развитию остеопатии и развивающегося на фоне дефицитности функциональной активности иммунной системы организма. Известно, что одной из важнейших характеристик активности иммунокомпетентных клеток является их способность к миграции как in vivo, так и in vitro. По этой причине была проведена настоящая работа, основной целью которой являлся поиск возможных иммунологических манифестантов развития остеопатии по результатам исследования миграции лейкоцитов крови позвоночных животных in vitro в присутствии тканевого антигена зубочелюстной области.
Материалы и методы исследования. По массе тела были выделены три группы животных — 12,0–15,0 (1 группа); 20,0–25,0 (2 группа) и 30,0–32,0 грамма (3 группа) по 7 животных в каждой группе (всего 21 животное). Животных 1 группы рассматривали как юных (с активным остеогенезом), второй — зрелых (предположительно с завершенным остеогенезом), третьей — старых (с преобладанием процессов остеолиза). Из хвостовой вены животных в гепаринизированные стеклянные капилляры забирали кровь и ставили реакцию торможения миграции лейкоцитов (РТМЛ) в нашей модификации [34]. Результаты выражали в виде индекса миграции лейкоцитов (ИМЛ) в % от уровня контроля (лунки без антигена). Растворимые антигены были приготовлены общепринятым методом водно-солевой экстракции из замороженных-оттаянных тканей пародонта и альвеолярных отростков челюсти здоровых животных — белых нелинейных мышей самцов с массой тела 12,0–15,0; 20,0–25,0 и 30,0–32,0 грамма. Таким образом, было приготовлено три типа антигенов из тканей зубочелюстной системы мышей (аг1, аг2, аг3). Антигены дозировали по белку [29], разливали по 1,0 мл в пластиковые пробирки и хранили при t-20ºС в морозильной камере.
Полученные данные были обработаны при помощи математической программы SPSS statistics.
Результаты исследования.
Исследования показали, что растворимые тканевые антигены зубочелюстной системы (РТАГ ЗЧС) в РТМЛ значительно модулируют миграцию лейкоцитов периферической крови здоровых животных из стеклянного капилляра in vitro (рис.1).
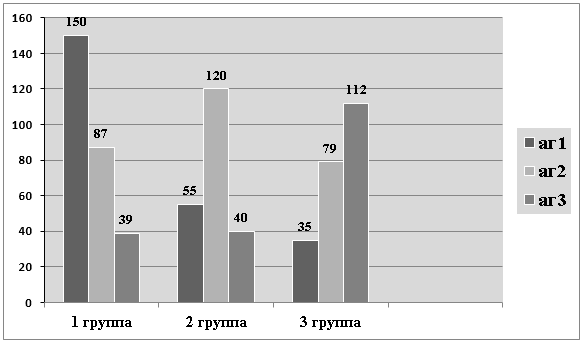
Рис.1. ИМЛ (абсолютные значения даны по вертикальной оси) в присутствии РТАГ ЗЧС в зависимости от возрастной группы животных (юные, зрелые, старые) и вида антигена (от юных, зрелых и старых животных)
Как видно из рисунка, животные всех групп максимально отвечают на антиген «своего возраста» изменением миграции. Причем, «свой» АГ стимулирует миграцию лейкоцитов, в то время как АГ из другой возрастной группы — тормозит. Однако, это среднестатистические данные.
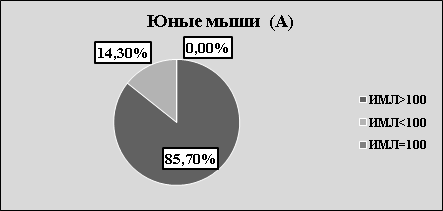
Рис.2. А. Структура значений ИМЛ в зависимости от группы животных и вида антигена
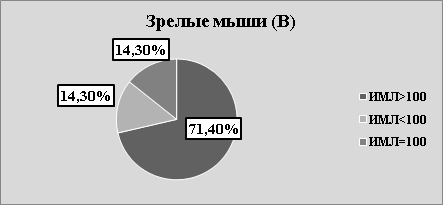
Рис.2. В. Структура значений ИМЛ в зависимости от группы животных и вида антигена
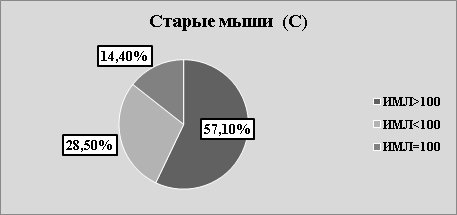
Рис.2. С. Структура значений ИМЛ в зависимости от группы животных и вида антигена
В каждой возрастной группе животных наблюдалась как стимуляция, так и торможение миграции в присутствии АГ (рис.2 А, В, С). Независимо от «знака» миграции, результаты исследования, на наш взгляд, указывают на то, что в периферической крови мышей, независимо от их возраста, циркулируют лейкоциты, специфически сенсибилизированные к растворимым тканевым антигенам зубочелюстной системы. Однако, число сенсибилизированных лейкоцитов зависит от возраста животных. Так, в молодом возрасте оно максимально, в старческом — минимально. На наш взгляд, численность популяции сенсибилизированных лейкоцитов отражает степень сенсибилизации иммунной системы к тканевому антигену ЗЧС и прямо коррелирует с интенсивностью процессов костеобразования.
Результаты, полученные в эксперименте, в первую очередь подтверждают данные литературы об участии иммунной системы организма позвоночных в процессах остеогенеза [1,3,6,10,12, 25,19,21]. Скорее всего, выявленные нами модуляции величины ИМЛ, отражают степень сенсибилизации организма к тканевому антигену зубочелюстной системы, то есть отражают интенсивность процессов ремоделирования костной ткани. Повышение степени сенсибилизации лейкоцитов (увеличение ИМЛ) против популяционной нормы, то есть физиологического уровня, характерного для данного вида и возраста позвоночных, на, наш взгляд, связано с повышением процессов деструкции костной ткани и/или повышенной интенсивности процессов ремоделирования (например, у юных мышей). Низкий, напротив — о склерозировании или изменения антигенной структуры (генотипа?) костной ткани, либо о снижении остеопластических процессов (например, у старых мышей). На наш взгляд, полученные данные позволяют надеяться, что дальнейшие исследования в данном направлении позволят выявить иммунологические манифестанты степени активности процессов ремоделирования костной ткани у человека и разработать на этой основе методы ранней (доклинической) диагностики и профилактики развития патологии костной и зубочелюстной систем, то есть — остеопатии.
Литература:
1. Albagha, OM, et al.(2005) Association of oestrogen receptor alpha gene polymorphisms with postmenopausal bone loss, bone mass, and quantitative ultrasound properties of bone. J. Med. Genet. 42:240–246.
2. American association of endocrinologists (AACE) medical guidelines for the prevention and treatment of postmenopausal osteoporosis: 2001 edition, with selected updates for 2003 // Endocrine Practice. 2003. — V. 9. — N. 6. — P. 544564.
3. Arden N. Osteoporosis/ — London:Remedica,2006.
4. Baldock, PA, Eisman, JA.(2004). Genetic determinants of bone mass. Curr. Opin. Rheumatol. 16:450–456.
5. Bock O., Felsenberg D. Bisphosphonates in the management of postmenopausal osteoporosis — optimizing efficacy in clinical practice. //Clin/Interv.Aging, — 2008.–3(2).– 279–297.
6. Boyle W.,Simonet W., Lacey D. Osteoclast differentiation and activation // Nature.- 2003.-Vol.423.- P.337–341.
7. Cheung AM., Feid D. S., Kapral M. et al. Prevention of osteoporosis and osteoporosis fractures in postmenopausal women: recommendation statement from the Canadian Task Force on Preventive Health Care // CMAJ. 2004. — V. 170.-P. 1503–1513.
8. Clark, P. Prevalence of vertebral fractures in Brazil, Puerto Rico and Mexico. Preliminary report of the Latin American Vertebral Osteoporosis Study LAVOS // Journal of Bone and Mineral Research. 2004. — V. 19(Suppl. 1). — S. 87.
9. Cummings SR, Melton LJ. Epidemiology and outcomes of osteoporotic fractures //Lancet. -2002. -V.359. P. 1761–1767.
10. Gao, Y, et al. Estrogen prevents bone loss through transforming growth factor beta signaling in T cells. Proc. Natl. Acad. Sci. U. S. A. 2004. 101:16618–16623.
11. Garnero, P, Munoz, F, Borel, O, Sornay-Rendu, E, Delmas, PD. Vitamin D receptor gene polymorphisms are associated with the risk of fractures in postmenopausal women, independently of bone mineral density. The OFELY study. J. Clin. Endocrinol. Metab. 2005. 90:4829–4835.
12. Harada S.,Rodan G. Control of osteoblast function and regulation of bone mass // Nature.-2003.- Vol. 423.—P. 349–355.
13. Hofbauer L., KÜhne C.,ierek V., The OPG/RANKL/RANK system in metabolic bone diseases // J. Musculoskel.Neuron.Ineract. — 2004.- Vol.4.-P. 268–275.
14. Kanamaru, F, et al. Expression of membrane-bound and soluble receptor activator of NF-kappaB ligand (RANKL) in human T cells. Immunol. Lett. 2004. 94:239–246.
15. Karsenty G., Wagner E. Reaching a genetic and molecular understanding os skeletal development // Developmental Cell. — 2002.- Vol.2.-P.389–406.
16. Khaitov R. M. Immunology. GEOTAR-Media Publishining Group. 2008,255 p.
17. Kronenberg, H, Kobayashi, T. Transcriptional regulation in development of bone. Endocrinology. 2004. 146:1012–1017.
18. Langdahl, BL, Carstens, M, Stenkjaer, L, Eriksen, EF. Polymorphisms in the osteoprotegerin gene are associated with osteoporotic fractures. J. Bone Miner. Res. 2002. 17:1245–1255.
19. Raisz, LG, et al. Effect of osteoclast activating factor from human leukocytes on bone metabolism. J. Clin. Invest. 1975. 56:408–413
20. Russell R. G. G. Bisphosphonates: mode of action and pharmacology. //Pediatrics.–2007.–119.–S150–S162.
21. Suda, T, et al. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr. Rev. 1999. 20:345–357.
22. Takayanagi, H. Mechanistic insight into osteoclast differentiation in osteoimmunology. J. Mol. Med. 2005. 83:170–179.
23. World Health Organisation. Assessment of fracture risk and its implication to screening for postmenopausal osteoporosis: Technical report series 843. Geneva: WHO, 1994
24. Бартл Р. Остеопороз — профилактика, диагностика, лечение (перевод с немецкого). «ГОЭТАР-Медиа». 2012, 287 с.
25. Ершова О. Б. Современные подходы к профилактике остеопороза/ Качество жизни, Медицина, 2006, № 5(16)- С.69–75
26. Земсков А. М., Земсков В. М., Караулов А. В. Клиническая иммунология. «ГОЭТАР-Медиа». 2008426 с.
27. Зйчик А. Ш., Чурилов А. П., Патохимия. 2007, ЭЛБИ-СПб, 768 с.
28. Иммунологические методы (под ред. Г.Фримеля). 1987. М:Медицина. 472 с.
29. Коротаев Н. В., Ершова О. Б. Этиология и патогенез снижения костной массы у женщин молодого возраста / Остеопороз и остеопатии, 2006 — № 2. — С. 19–25.
30. Меджидов М. Н. Иммуноморфология десны при экспериментальном пародонтите у крыс // Министерство здравоохранения и социального развития РФ. Санкт-Петербургская медицинская академия последипломного образования. Стоматологическая Ассоциация России. Ассоциация стоматологов Санкт-Петербурга. Материалы IX Международной конференции челюстно-лицевых хирургов и стоматологов. Санкт-Петербург, 25–27.V.2004. С.110.
31. Меджидов М. Н. Эспериментальное обоснование и клиническое применение препаратов системы фибринфибронектина и тромбоцитарного фактора роста в комплексном лечении заболеваний пародонта. Автореф. дисс. д.. м. н., Москва, 2007. 30 с.
32. Остеопороз /под ред. О. М. Лесняк, Л. И. Беневоленской. — 2–е изд., перераб. и доп.– М.: ГЭОТАР–Медиа, 2009.– 272с. — (серия «Клинические рекомендации»).
33. Плескановская С. А. Клеточный и гуморальный иммунный ответ при кожном лейшманиозе (экспериментальные исследования и наблюдения на больных). Автореферат дисс. к.м.н., Москва, 1982.
34. Поворознюк В. В., Григорьева Н. В. Менопауза и остеопороз, К.: Здоровье, 2004–356 с.
35. Рожинская Л. Я. Системный остеопороз. Изд.2–е перераб., доп., М.:Изд–во Мокеев, 2000.– 195с.
36. Руденко Э. В. Остеопороз: диагностика, лечение и профилактика, Минск: Бел.наука, 2001–153 с.
37. Хаитов P. M., Пинегин Б. В. Оценка иммунного статуса человека в норме и при патологии // Иммунология 2001 — № 4 — С. 4–6.

