Эндометриоз — по сути эндометриоидная гетеротопия, которая в случаях поражения тела матки называется аденомиозом. Эндометриоз, в том числе и аденомиоз, являются актуальной проблемой современной гинекологии. Больные эндометриозом/аденомиозом составляют от 10 до 50 % общего числа пациенток с гинекологической патологией [21].
Этиопатогенез АМ не совсем ясен, о чем свидетельствует большое число теорий происхождения эндометриоза вообще. Наиболее известны теории — транслокационная, имплантационная, эмбриональная и дизонтогенетическая. А так же, теория целомической метаплазии, гормональная теория и наименее популярная — иммунологическая [15]. Согласно иммунологической концепции нарушения системного и локального иммунитета приводят к развитию иммунодефицита, создающего условия для имплантации и развития очагов ЭМ [10]. Существует мнение, что воспалительная реакция и неразрывно связанный с ней иммунный ответ на антигенный стимул объясняют происхождение эндометриоза дефицитом клеточного иммунитета, допускающего пролиферацию эктопической эндометриальной ткани и избыточного воспаления [8]. Наряду с повышением пролиферативной активности в эндометриоидных клетках ослабевают процессы апоптоза, что в совокупности с ослаблением Т-клеточного иммунитета создает предпосылки для выживания имплантатов вне слизистой оболочки матки. У пациенток с эндометриозом в нормальных эпителиальных и стромальных клетках эндометрия наблюдается угнетение процессов апоптоза [9,10].
Морфологической особенностью АМ является лейомиоматозная перифо-кальная гиперплазия миометрия. Различают три основных типа гиперплазии — простую гиперплазию без атипии, сложную гиперплазию с атипией и сложную атипичную гиперплазию (аденомиоз с атипией). Все эти события становятся возможными в результате торможения процессов апоптоза в очагах гетеротопии. Известно, что процессы апоптоза заблокированы при неоплазиях самой различной этиологии и локализации [1,32]. В этой связи особенно актуальным становится вопрос об онкологической трансформации эндометриоза/аденомиоза. Частота злокачественной трансформации аденомиоза колеблется от 1 до 12 %. Однако некоторые авторы считают, что трансформация аденомиоза встречается значительно чаще, а ее гиподиагностика связана с трудностями дифференциальной диагностики аденомиоз с аденокарциномой [11,23].
Диагностика и дифференциальная диагностика АМ основаны на использовании большого числа тестов, в том числе дорогостоящиех исследований крови на гормоны и онкомаркеры [14,16, 20,22]. В этой связи вопросы совершенствования методов ранней и тем более доклинической диагностики аденомиоза становится все более актуальным. Несмотря на большое число исследований в этом направлении нами не найдено работ по изучению реакции периферической крови больных аденомиозом в контексте их диагностической или прогностической значимости.
Целью настоящей работы являлось изучение возможности использования результатов исследования популяционного состава лейкоцитов крови и соотношения ее поли- и мононуклеаров у больных аденомиозом в качестве предикторов данной патологии.
Методы исследования. При обследовании больных АМ помимо традициионных клинико-инструментальных методов исследования использовали гематологические. Гематологическое исследование включало определение популяционного состава лейкоцитов периферической крови на гемоанализаторе ABX Pentra 80+ (Франция) с последующим вычислением величины гранулоцитарного индекса (ГИ), представляющего собой частное от деления суммы циркулирующих полинуклеаров на сумму мононуклеаров [25].
Кроме того методом ИФА определяли концентрацию сывороточных иммуноглобулинов класов IgG и IgM к СМV, Chlamydia traсhomаtis, HPV, Herpes simplex, Micoplasma hominis.
По специальным вопросникам был тщательно изучен анамнез жизни и заболевания у всех обследованных женщин. Полученные данные математически обработаны при помощи компьютерной программы SPSS.
Дизайн исследования. Обследовано 150 женщин репродуктивного возраста с генитальным эндометриозом (аденомиозом) и 50 условно здоровых женщин в возрасте от 20 до 45 лет (средний возраст составил 32,3±3,6 года).
Диагноз генитального аденомиоза (АМ) был верифицирован на основании данных анамнеза и результатах объективного обследования, включавшего бимануальное исследование матки, эхографию, компьютерную томографию, гистероскопию, а так же результаты морфологического (гистологического) исследования биоптатов эндометрия и материала, полученного при раздельном выскабливании стенок полости матки и цервикального канала.
Критериями исключения из группы обследования являлись наличие миомы матки, наличие острых воспалительных заболеваний матки и ее придатков, наружного эндометриоза, опухоли яичников.
Жалобы больных. Наиболее характерными жалобами, предъявляемыми пациентками, были жалобы на боли внизу живота и в поясничной области, диспареунию, межменструальные кровянистые выделения, дисменорею и менометрорагию (табл.4).
Оценку тяжести болевого синдрома проводили по шкале ВАШ. В зависимости от выраженности болевого синдрома были выделены три группы больных:
1 группа (n=50) — со слабовыраженным болевым синдромом;
2 группа (n=50) — с умеренно выраженным болевым синдромом;
3 группа (n=50) — с резко выраженным болевым синдромом.
Таблица 1
Частота встречаемости основных жалоб у больных АМ в зависимости от выраженности болевого синдрома
|
№ группы п/п |
Жалобы |
Частота встречаемости жалоб в зависимости от группы больных (%) | ||
|
I (n=50) |
II (n=50) |
III (n=50) | ||
|
1. |
Боли внизу живота |
30 |
58 |
82 |
|
2. |
Боли в обл. поясницы |
22 |
42 |
18 |
|
3. |
Дисменоррея |
48 |
72 |
96 |
|
4. |
Диспареуния |
36 |
56 |
78 |
|
5. |
Межменструальные кровотечения |
12 |
64 |
92 |
|
6. |
Менометроррагия |
16 |
72 |
84 |
Из гинекологического анамнеза было установлено, что возраст менархе у женщин с аденомиозом колеблется от 11 до 16 лет. На раннее менархе указали 54 женщины из 150 обследованных. Нормальный возраст менархе с установившимся циклом выявлен у 66 женщин и поздний возраст менархе с длительно не устанавливавшимся циклом — у 30 женщин (Рис.1).
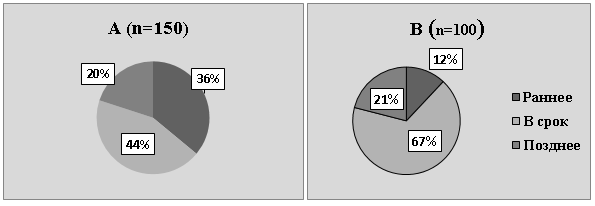
Рис. 1. Структура возраста менархе у женщин, страдающих аденомиозом (А) и здоровых женщин (В)
Как видно из рисунка 1, у подавляющего числа женщин, страдающих АМ, возраст менархе либо ранний (у 20 %), либо физиологический (у 36 %). В группе условно здоровых женщин позднее менархе встречается в одинаковом числе случаев с женщинами, страдающими АМ, но у них на 8 % реже встречается раннее менархе, но более чем на 20 % чаще встречаются физиологические сроки менархе.
Анамнестические данные по паритету у женщин, страдающих АМ, показали, что из числа обследованных женщин с АМ не имели родов в анамнезе — 26, имели 1 самопроизвольные роды — 28, от 2 до 3 родов в анамнезе — 96 женщин. Искусственное прерывание беременности на раннем сроке имели в анамнезе 86 женщин и в поздние сроки гестации — 2 женщины. В таблице 2 представлены данные по паритету у здоровых и страдающих АМ женщин в относительных величинах по отношению к общему числу обследованных.
Как видно из таблицы 2 среди женщин с АМ значительно чаще по сравнению с группой здоровых женщин встречаются указания на бесплодие (17,3 % против 9 % в группе условно здоровых), более чем в 2 раза чаще перенесены арцифициальные аборты в ранние сроки беременности (57,3 % против 20 %).
Таблица 2.
Данные анамнеза по паритету у женщин, страдающих АМ и условно здоровых женщин
|
Группа |
Возраст (лет) |
Не рожали (%) |
1самост. роды (%) |
2–3родов (%) |
Арциф. аборт в ранние сроки (%) |
Арциф.аборт в поздние сроки (%) |
|
Здоровые (n=100) |
33,5±1,7 |
9 |
29 |
68 |
20 |
2 |
|
Больные АМ (n=150) |
32,3±3,6 |
17,3 |
18,6 |
64 |
57,3 |
1,3 |
Женщины с АМ значительно чаще страдают хроническими воспалительными заболеваниями гениталий. Из общего числа обследованных женщин с аденомиозом 60 страдали хроническим эндометритом, 40 — хроническим аднекситом и 50 — хроническим цервицитом (рис.2).
На рисунке 2 хорошо видно, что в группе условно здоровых женщин хронические заболевания гениталий встречаются значительно реже.
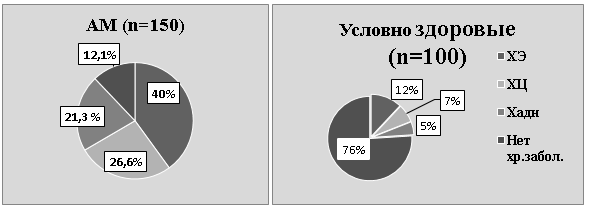
Рис.2. Структура хронических заболеваний в зависимости от группы обследованных женщин
Кроме того, если у 56 % женщин с АМ выявлено сочетание хронических заболеваний гениталий с эктопией шейки матки и спаечным процессом в органах малого таза, то в группе условно здоровых женщин таких сочетаний не выявлено вообще.
Таблица 3
Способы контрацепции в обследованных группах женщин.
|
№ п/п |
Метод контрацепции |
Частота использования метода (%) | |
|
Условноздоровые (n=100) |
Женщины с АМ (n=150) | ||
|
1. |
КОК |
18 |
25,3 |
|
2. |
ВМК |
29 |
46 |
|
3. |
Барьерные |
22 |
8 |
|
4. |
Не пользуются |
31 |
20,7 |
Помимо этого, данные анамнеза позволили установить, что женщины, страдающие АМ, значительно чаще здоровых используют в качестве метода контрацепции ВМК и КОК, но значительно реже барьерные методы.
Таким образом, анализ данных анамнеза обследованных нами женщин показал, что своеобразными предикторами АМ являются ранний возраст менархе, использование в качестве методов контрацепции ВМК и КОК, арцифициальные аборты, наличие хронических заболеваний органов репродукции и особенно хронического эндометрита, что согласуется с данными других авторов [15,19,29].
Гематологическое исследование показало, что в целом по группе условно здоровых женщин ведущей субпопуляцией лейкоцитов периферической крови являются сегментоядерные нейтрофилы. Численность циркулирующих гранулоцитов (сегментоядерных нейтрофилов, эозинофилов, базофилов и палочкоядерных нейтрофилов) почти вдвое превышает общую численность циркулирующих мононуклеаров (лимфоцитов и моноцитов), в результате величина ГИ составляет 1,70±0,09 условных единиц. У женщин с АМ в большинстве случаев в популяции циркулирующих лейкоцитов преобладают мононуклеары (лимфоциты и моноциты) и величина ГИ у них в среднем по группе составляет 1,46±0,1. Различие между группами достоверно (t=3,4, p<0,05). Однако, как в группе практически здоровых женщин, так и больных АМ значения ГИ довольно значительно колеблются — от 0,6 до 2,7. На рис. 3 представлена структура значений ГИ у здоровых и страдающих АМ женщин.
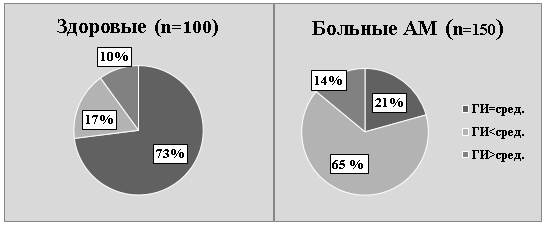
Рис.3. Структура значений ГИ в зависимости от группы обследованных женщин
Из рисунка видно, в группе женщин, страдающих АМ, более чем в половине случаев (65,3 %) выявлен низкий ГИ, значение которого колебалось от 0,6 до 1,3 и в среднем составило 1,0±0,09. Это достоверно ниже уровня популяционного контроля (p<0,01). В группе условно здоровых женщин низкие значения ГИ были выявлены только в 17 % случаев и в среднем составили 1,3±0,07. Различие по отношению к больным АМ достоверно (p<0.05). Однако, среди женщин, страдающих АМ, в 21 % случаев ГИ соответствовал популяционному контролю (1,71±0,06).
Низкие значения ГИ характерны для острых и хронических заболеваний паразитарной, вирусной этиологии и неопластических процессов [7,27,36], а также иммунодефицитных состояний различной этиологии [4,5,6,26,28]. В этой связи представляло интерес определить частоту вирусоносительства среди здоровых и больных АМ женщин. Мы исследовали сыворотку крови женщин обеих групп на наличие антител (IgG) к СМV, Chlamydia traсhomаtis, HPV, Micoplasma hominis, Herpes simplex. Результаты исследования представлены в таблице 4.
Таблица 4
Результаты вирусологического обследования женщин в зависимости от группы
|
№ п/п |
Видовая принадлежность IgG |
Положительные результаты в зависимости от группы женщин (%) | |
|
Условно здоровые |
Больные АМ | ||
|
1. |
Micoplasma hominis |
4 |
24 |
|
2. |
HPV — 16 серотипа |
1 |
17,3 |
|
3. |
HPV — 31–36 серотипов |
2 |
16 |
|
4. |
Chlamydia traсhomаtis |
5 |
28 |
|
5. |
Микст: СМV+ Herpes simplex II типа |
1 |
42,6 |
|
Всего вирусинфицированных: |
13 |
85,3 | |
Как видно из таблицы 4 у 13 % условно здоровых женщин, не находившихся на диспансерном учете у гинеколога, не предъявлявших каких-либо жалоб, не имевших патологии со стороны органов репродукции, в сыворотке крови выявлены антитела класса IgG практически ко всем видам включенных в исследование вирусов. Наибольшее число случаев приходится на Chlamydia traсhomаtis (5 %) и Micoplasma hominis (4 %).
Таблица 5
Значения величины ГИ в зависимости от вида вирусоносительства и группы обследованных женщин
|
№ п/п |
Видовая принадлежность IgG |
Величина ГИ | |
|
Услов.здор. |
Больные АМ | ||
|
1. |
Micoplasma hominis |
1,4±0,1 |
1,2±0,06 |
|
2. |
HPV — 16 серотипа |
1,5±0,09 |
1,1 ±0,07 |
|
3. |
HPV — 31–36 серотипов |
1,6±0,06* |
0,9±0,03 |
|
4. |
Chlamydia traсhomаtis |
1.5±0,1 |
1,0±0,04 |
|
5. |
Микст: СМV+ Herpes simplex II типа |
1,3±0,07* |
0,75±0,03 |
|
Средняя величина по группе |
1,45±0,05° |
0,98±0,04 | |
Примечание: * — p<0,05 по отношению к среднему значению по группе; ° — p<0,05,°°-p<0,01 по отношению к популяционному контролю.
Женщины, страдающие АМ вирусинфицированы в 85,3 % случаев. Наиболее часто в этой группе женщин выявляются сывороточные IgG к Micoplasma hominis, Chlamydia traсhomаtis, HPV — 16 серотипа и HPV — 31–36 серотипов. Почти половина женщин с АМ (42,6 %) имеют микстинфекцию (СМV+ Herpes simplex II типа) (табл.5). Как видно из таблицы, средняя величина ГИ у вирусинфицированных женщин из группы условно здоровых достоверно ниже по сравнению с больными АМ (p<0,001). Что, на наш взгляд, может быть связано с более значительным вирусиндуцированным иммунодефицитом или наличием фоновой (врожденной?) недостаточности противовирусной защиты у женщин с АМ. Косвенным доказательством этого допущения является прогрессивное снижение величины ГИ у женщин с рецидивирующим АМ, отличающимся упорным течением, плохо поддающимся лечению. Важно отметить, что в случае эффективного лечения АМ величина ГИ прогрессивно увеличивается, но крайне редко достигает уровня популяционного контроля. Вместе с этим снижаются титры соответствующих IgG в сыворотке крови.
Прогрессирующее снижение величины ГИ является пессимальным прогнозом в отношении малигнизации очагов АМ. В ряде случаев мы наблюдали, что при снижении величины ГИ на фоне проводимого лечения у пациенток увеличивается число эктопий в теле матки, что было подтверждено данными эхографического исследования матки, компьютерной томографии, гистероскопию, а так же результатам морфологического (гистологи-ческого) исследования биоптатов эндометрия. Кроме того при прогрессивном снижении величины ГИ мы наблюдали повышение до диагностических значения концентраций онкомаркера СА-125 в крови больных АМ. Если в сыворотке крови здоровых лиц концентрация СА-125 по нашим данным составляет в среднем 7,9±0,4 ЕД/мл, то у больных АМ этот показатель поднимается в среднем до 22,5±1,9 ЕД/мл. В случаях прогрессивного снижения ГИ концентрация маркера СА-125 увеличивается до 55–107 ЕД/мл.
Таким образом, при АМ наблюдается существенная перестройка кроветворения, выражающаяся супрессией гранулоцитарного ростка на фоне активации моно- и лимфоидного ростков. Известно, что состав периферической крови определяется запросом, поступившим в мезенхиму костного мозга млекопитающих [2,35]. Кроме того, в костном мозге одновременно пролиферирует только один из ростков кроветворения. Нарушение дифференцировки стволовых элементов костного мозга в том или ином направлении наблюдается, как правило, при лейкозах [3,12,35]. Одной из самых популярных теорий канцерогенеза остается вирусная, предложенная Л. А. Зильбером [18] и находящая все большее число подтверждений в настоящее время [1,24,30]. В этой связи мы допускаем, что полученные нами данные об увеличении численности мононуклеаров в циркуляции больных АМ может быть следствием вирусиндуцированного нарушения процессов дифференцировки и пролиферации гранулоцитарного ростка кроветворения, что соответствует данным литературы [17,24,33,34]. Известно, что на поверхностной мембране гранулоцитов экспрессирован рецептор к CD 16+, общий для NK клеток и Т-киллеров [2], что позволяет причислить гранулоциты к группе клеток с киллерной активностью. Одной из важнейших задач киллерной системы организма является осуществление противовирусной и противораковой защиты [24,31]. Следовательно, снижение численности гранулоцитов в циркуляции больных АМ, на наш взгляд, указывает на вирусную природу заболевания и приобретенную или врожденную супрессию противовирусной (и противораковой?) защиты организма больных. С осторожностью аденомиоз можно назвать болезнью клеток-«киллеров». Данное обстоятельство свидетельствует в пользу целесообразности введения в комплексное лечение АМ противовирусных и иммуномодулирующих препаратов.
В целом, полученные данные позволяют, на наш взгляд, использовать исследование популяционного состава лейкоцитов крови и соотношения ее поли- и мононуклеаров (гранулоцитарного индекса) в качестве критериев определения эффективности проводимой терапии, оценки прогноза и одного из предикторов малигнизации очагов эктопии у больных аденомиозом.
Литература:
1. Current hematology and oncology/ Ed. Virgil F. Fairbanks. YEAR BOOK MEDICAL PUBLISHERS INC. CHICAGO.1984.
2. Khaitov R. M. Immunology, GEOTAR-Media Publishing Group, Moskow, 2008.
3. Mossman K. L., Ashar A. A. “Herpesviruses and the innate immune response”. Viral Immunol 18(2):267–281, 2005.
4. Pleskanovskaya S. A., Charyev A. Peculiarities of hemopoiesis in patients with acute myocardial infarction//23- ncii Ulusal hematoloji congress, 1–5october, 1993, Istambul, Turkiye.
5. Pleskanovskaya S. A. Leishmania and haemapoiesis Proc.the 24-th Congress of the International Soc. оf Hematology –London, August 23–27., 1992. P.1052
6. Pleskanovskaya S. A. Orasualiew A. I., Annaberdyev S. D., Gulgeldyev M., Djumaeva E. O. The hematological criteria of acute odontogenic flegmonas patients’ reactivity determination Proc.XIII congr. of Intern. Soc. Hematol. Istambul, Turkey, 3–8 Sept., 1995. Abstr.№ 712
7. Pleskanovskaya S. A. Regulation of immune system through the regulation of hemopoesis, 23-ncii Ulusal hematoloji congress, 1–5october, 1993, Istambul, Turkiye.
8. Sinaii N, Cleary SD, Ballweg ML et al. High rates of autoimmune and endocrine disorders, fibromyalgia, chronic fatigue syndrome and atopic disease among women with endometriosis: a survey analysis. Hum reprod 2002; 17: 2715–22.
9. Адамян Л. В., Андреева Е. Н. Генитальный эндометриоз: этиопатогенез, клиника, диагностика, лечение. М., 2001.
10. Адамян Л. В., Зайратьянц О. В., Осипова А. А. и др. Роль пролиферации и апоптоза в патогенезе генитального эндометриоза. Спец. выпуск. 3-й Междунар. науч. конгр. «Новые технологии в акушерстве и гинекологии» 2007; с. 123–4.
11. Бохман Я. В. Руководство по онкогинекологии. Л:Наука, 1989. — 464 с.
12. Волегов А. И. Устойчивость организма к злокачественным опухолям, Москва-Медицина, 1987.
13. Волков Н. И., Камилова Д. П., Корнеева И. Е. Акуш. и гин. 2002; 3: 49–50.
14. Гаврилова Т Ю, Волобуев А И, Панов В О, Кулабухова Е А, Селиверстов А А, Ткаченко Э Р Диагностика эндометриоза с помощью МР-томографии // В книге «Новые технологии в гинекологии» -Москва, 2003 — С 51–52
15. Гаврилова Т. Ю. Аденомиоз: патогенез, диагностика, лечение, методы реабилитации. Автореферат дисс. к.м.н. Москва, 2007.
16. Гаврилова Т. Ю. Значение определения уровней онкомаркеров CA -125, СЕА, CA 19–9 при генитальном эндометриозе в ближайшие и отдаленные сроки после оперативного лечения // В материалах V Российского форума «Мать и дитя».- Москва, 2003-С 313–314
17. Земсков А. М., Земсков В. М., Караулов А. В. Клиническая иммунология GEOTAR-Media Publishing Group, Moskow, 2008.
18. Зильбер Л. А. Вирусно-генетическая теория возникновения опухолей. М:Наука, 1975.
19. Кузнецова И. В. Эндометриоз как причина тазовой боли: вопросы диагностики и лечения http://www.dissercat.com/content/otsenka-
20. Кулаков В. И., Адамян Л. В., Волобуев А. И., Демидов В. Н., Панов В. О., Гаврилова Т. Ю., Кулабухова E. H., Панова М. М., Сташук Г. А. Магнитно-резонансная томография в диагностике различных форм эндометриоза // Вестник рентгенологии и радиологии, № 4 Москва, 2003 — С.45–59.
21. Кэмпбелл С., Монг Э. Гинекология. 2003; 141–50.
22. Левитина Е. И. Усовершенствование диагностики аденомиоза при ургентных негравидарных метроррагиях у женщин репродуктивного и перименопаузального возраста. Автореф. дисс. к.м.н. 2005, Санкт-Петербург.
23. Леонов Б. В., Кулаков В. И., Корнеева И. Е. и др.// Акуш. и гин. 2002; 4: 1–4.
24. Нестерова И. В., Ковалева С. В., Чудилова Г. А. и др. Нейтрофильные гранулоциты в реализации противоопухолевого иммунитета. //Аллергология и иммунология 12(1): 16–17, 2011.
25. Плескановская С. А. Клеточный и гуморальный иммунный ответ при кожном лейшманиозе (экспериментальные исследования и наблюдения на больных) Автореферат диссертации к. м.н., Москва, 1982.
26. Плескановская С. А. Гематологические и цитохимические характеристики взаимоотношений паразит — хозяин при кожном лейманиозе Автореферат дис. д.м.н. 1991, Москва
27. Плескановская С. А. Гранулоцитарный индекс как показатель реактивности иммунной системы при воспалении // Материалы 55. конфер. ТГМИ, Ашхабад, 1995, стр. 71.
28. Плескановская С. А., Оразвалиев А. И., Аннабердиев С. Д., Гулгелдиев М., Джумаевa Э. О. Гранулоцитарный индекс в оценке реактивности организма больных с одонтогенными флегмонами челюстно-лицевой области // Материалы 55. конфер. ТГМИ, Ашхабад, 1995, стр. 71.стр. 135–136
29. Подзолкова Н. М., Глазкова О. Л. Симптом. Синдром. Диагноз. Дифференциальная диагностика в гинекологии. 2-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2005.
30. Сейц И. Ф., Князев П. Г. Молекулярная онкология. Москва-Медицина, 1986
31. Сепиашвили Р. И., Балмасова И. П. Физиология естественных киллеров. М:Медицина, 2005.
32. Сорокина А. В. Автореферат диссертации Патогенез, прогнозирование и постге-номная диагностика аденомиоза. Москва, 2011.
33. Файнштейн Ф. Э., Козинец Г. И., Бахрамов С. М., Хохлова М. П. Болезни крови у пожилых. Ташкент, Медицина, 1987.
34. Фридман Д. Б. 2006. Санкт-Петербург
35. Шабалин В. Н., Серова Л. Д. Клиническая иммуногематология. М:Медицина. 1988.
36. Эзимова А. С., Плескановская С. А., Критерии диагностики и прогнозирования неоплазии органов репродуктивной системы женщин // Аллергология и иммунология 12(1): 83,2011.

