Особенностью среднего образования в России состоит в том, что учащиеся, и их учителя, заинтересованы участвовать в олимпиадах. При подготовке к олимпиадам по химии следует учитывать, что школьникам необходимо уметь эффективно решать расчетные задачи. Среди великого множества разнообразных химических задач наибольшие затруднения вызывают задачи, для решения которых помимо прочных химических знаний требуется неплохо владеть материалом курса физики. И хотя далеко не всегда уделяется внимание решению хотя бы простейших задач с использованием знаний двух курсов — химии и физики, задачи такого типа иногда встречаются на олимпиадах по химии. А потому, не разобрав задачи такого типа на уроках, учитель может неумышленно лишить своего ученика шанса на победу в олимпиаде. Необходимо учитывать, что такого типа задачи будут интересны и доступны для восприятия не всем учащимся. Задачи на закон Фарадея усложненные и не являются типовыми для школьного курса химии.
Все задачи разбиты на 3 уровня—очень простой, средний и сложный. Поэтому этот материал предназначен для широкого круга учащихся—от троечников до медалистов. Поскольку разработка ориентирована, в основном, на практическую подготовку, теоретический материал изложен достаточно кратко. Все предложенные задачи имеют подробные решения, что позволит существенно сэкономить бесценное учительское время.
Теоретические основы закона Фарадея
Электролиз — окислительно-восстановительный процесс, происходящий при прохождении электрического тока через раствор или расплав электролита.
Электролиз водных растворов:
При определении продуктов следует помнить, что
1. На катоде восстанавливающийся продукт зависит от положения металла в ряду стандартных электродных потенциалов:
Li Rb K Ba Ca Na Mg Al | Mn Zn Cr Fe Co Pb H | Cu Hg Ag Pt Au
В растворах солей металлов первой группы восстанавливается только водород.
В растворах солей металлов второй группы параллельно протекает два процесса — восстановления водорода и металла. (В задачах часто имеется в виду, что восстанавливается только катионы металла, а восстановление водорода в данном случае не рассматривают) При электролизе растворов солей металлов третьей группы на катоде восстанавливается только металл.
2. На аноде получающийся продукт зависит как от материала анода, так и от природы аниона. На инертном электроде окисляются Cl¯, Br¯, I¯, S2¯ (анионы бескислородных кислот), OH¯ и RCOO¯ (анионы карбоновых кислот до R2 + 2CO2). F¯ и анионы кислородсодержащих кислот (сульфат, нитрат, фосфат-анионы) не подвержены электролизу в водных растворах.
Взаимосвязь между количеством вещества, образовавшегося при электролизе на электроде (катоде или аноде), и количеством электричества, прошедшим через электрическую ячейку, определяется законом Фарадея:
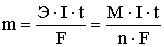
m — масса выделившегося вещества (г);
Э — эквивалентная масса вещества (г/моль), равная отношению молярной массы на количество отдаваемых или принимаемых электронов;
M — молярная масса выделившегося вещества (г/моль);
n — число электронов, принимающих участие в данной реакции;
I — сила тока (А); t — время (c); F — постоянная Фарадея = 96500 Кл/моль.
Условия, ответы и решения задач
Уровень 1
1. Электролиз 100 г водного раствора серной кислоты с мольной долей последней 2.5 % проводили в течении 15 минут. Сила тока была постоянной и равнялась 10 А. Рассчитайте количество электричества, прошедшего через раствор (в Кл).
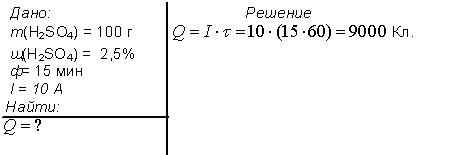
Ответ: 9000 Кл.
2. Электролиз 100 г водного раствора серной кислоты с мольной долей последней 2.5 % проводили в течении 15 минут. Сила тока была постоянной и равнялась 10 А. Рассчитайте количество электронов, прошедших через раствор.
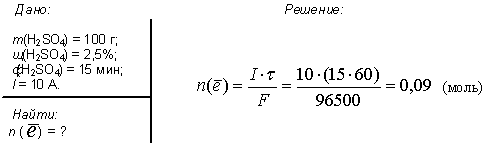
Ответ: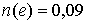 моль.
моль.
3. Вычислите массу ртути, выделившейся на катоде при пропускании тока силой 6 А через раствор хлорида ртути в течение 35 минут.

Уровень 2
4. При пропускании постоянного тока силой в 6,4 А в течение 30 минут через расплав хлорида неизвестного металла на катоде выделилось 1.07 г металла (С.О.=+3). Определите состав соли, который подвергли электролизу.
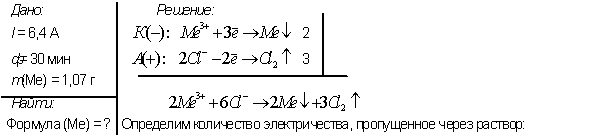
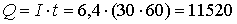 Кл.
Кл.
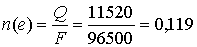 моль
моль
По уравнению реакции, количество выделившегося металла в 3 раза меньше количества электронов: 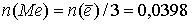 моль.
моль.
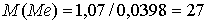 г/моль.
г/моль.
Искомый металл — алюминий.
Ответ:АlСl3.
5. Электролиз 100 г водного раствора серной кислоты с мольной долей последней 2.5 % проводили в течении 15 минут. Сила тока была постоянной и равнялась 10 А. Рассчитайте массовую долю (в процентах) растворенного вещества в конечном растворе.
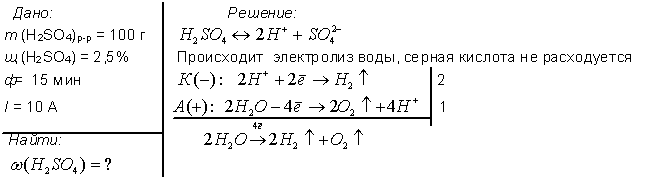
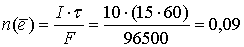 моль;
моль;
По уравнению реакции количество моль разложившейся воды в два раза меньше количества моль электронов, прошедших через электролизёр в ходе разложения воды:
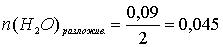 моль.
моль.
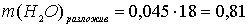 г.
г.
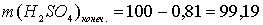 г.
г.
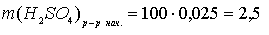 г.
г.
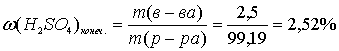
Ответ: ω (H2SO4)=2,52 %
Уровень 3
6. При пропускании через 120 мл раствора, содержащего смесь Au(NO3)3 иHg(NO3)2, сила тока 0,9 А в течение 120 минут на катоде выделилась смесь металлов общей массой 5,99 г. Напишите уравнение электролиза каждой соли и определите молярные концентрации солей в исходном растворе, если известно, что на катоде не выделялись газы, а после окончания электролиза раствор не содержит ионов металлов [1, с 21].

Обозначим количества солей в растворе 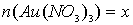 моль, а
моль, а
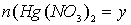 моль. Тогда количества образовавшихся металлов также равны
моль. Тогда количества образовавшихся металлов также равны 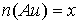 моль,
моль, 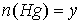 моль.
моль.
По условию масса смеси металлов, выделившихся на катоде,
равна 5,99 г, отсюда: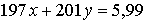 г.
г.
Количество электронов, прошедших через раствор:
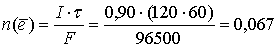 моль.
моль.
Из уравнений восстановления ионов металла следует: 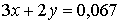 моль.
моль.
Составим систему из двух уравнений:
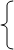
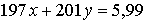
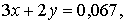
решая которую, находим: 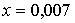 моль,
моль, 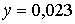 моль.
моль.
Молярные концентрации солей в исходном растворе:
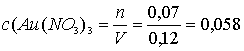 M;
M;
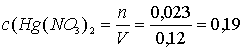 M;
M;
Ответ: 0,058 М Au(NO3)3; 0,19 М Hg(NO3)2 [1, с. 139].
7. Электрохимическое фрезерование сплава (анодную обработку) проводят методом электролиза в водном растворе электролита. Рассчитайте время, необходимое для образования бороздки длинной 10 см, шириной 2 см и глубиной 0,2 см в латуни при токе 100 А и выходе реакции 50 %. Состав латуни: 57 % меди и 43 % цинка (по молям); плотность латуни 8,16 г/см3 [2, с 243].
 При электролизе на аноде протекают процессы:
При электролизе на аноде протекают процессы:
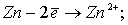
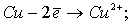
Количество электронов, пошедшее на окисление латуни:
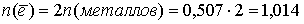 моль
моль
Общее количество электронов, прошедшее через электролизёр:
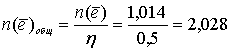 моль.
моль.
По закону Фарадея
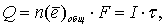
отсюда время, необходимое для образования бороздки:
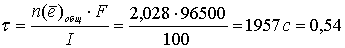 ч.
ч.
Ответ: 0,54 ч [2, с 418].
8. При проведении электролиза водного раствора нитрата ртути, который длился 6 ч 20 минут, силу тока поддерживали постоянной. Через 40 минут с момента начала электролиза на катоде началось выделение газа. Определите массовое содержание соли в исходном растворе, если за время электролиза масса раствора уменьшилась в 1,258 раза [1, с. 84].
 По закону Фарадея:
По закону Фарадея: 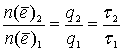 .
.
Отсюда количество моль электронов, прошедших через электролизёр в ходе разложения воды (вторая реакция):
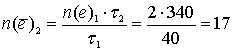 моль.
моль.
Тогда 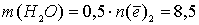 моль, и масса раствора уменьшилась на
моль, и масса раствора уменьшилась на
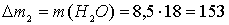 г.
г.
Общее уменьшение массы раствора:
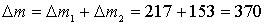 г.
г.
Пусть исходная масса раствора равна x г, тогда
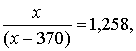 откуда x = 1804 г.
откуда x = 1804 г.
Содержание нитрата ртути в исходном растворе:
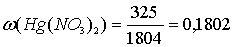 (или 18,0 %).
(или 18,0 %).
Ответ: ω (Hg(NO3)2) = 18,0 % [1, с 281].
9. К 200 г 16 %-ного раствора сульфата меди прилили 200 г 29,8 %-ного раствора хлорида калия и полученный раствор подвергли электролизу с инертными электродами. Электролиз закончили, когда массовая доля сульфат-ионов в растворе стала равна 5,61 %. Рассчитайте массы продуктов, выделившихся на электродах, и количество электричества, прошедшего через раствор.

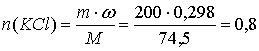 моль;
моль;
Суммарная масса раствора 400 г; электролиз закончили, когда масса конечного раствора, исходя из массовой доли сульфат-ионов, стала равной:
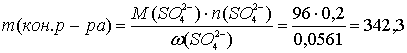 г.
г.
Для полного выделения меди (0,2 моль) из раствора необходимо 0,4 моль электронов, а хлора (0,4 моль) — 0,8 моль электронов.
Рассчитаем массу раствора при прохождении через электролизёр 0,8 моль электронов (так как число молей электронов, прошедших через электроды одинаково, то на катоде, кроме меди, выделилось 0,2 моль водорода):
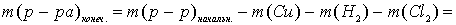
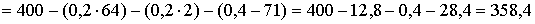 г,
г,
что не соответствует условию задачи (342,3 г). Следовательно, электролиз продолжается с разложением воды на обоих электродах.
Выразим массу конечного раствора:
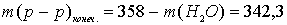 г.
г.
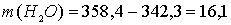 г.
г.
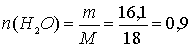 моль, что соответствует 1,8 моль электронов.
моль, что соответствует 1,8 моль электронов.
По уравнению электролиза воды
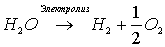
рассчитаем массы водорода и кислорода, образующихся при разложении 0,9 моль воды:
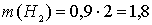 г;
г;
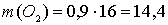 г.
г.
Итак, в целом выделилось 12,8 г меди и 0,4+1,8=2,2 г водорода, на аноде — 28,4 г хлора и 14,4 г кислорода, а через электролизёр прошло 0,8+1,8=2,6 моль электронов.
По закону Фарадея количество электричества, прошедшего через раствор:
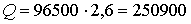 Кл.
Кл.
Ответ: на катоде 12,8 г Cu и 2,2 г H2; на аноде 28,4 г Cl2 и 14,4 г О2;
250900 Кл.
Литература:
1. Кузьменко Н. Е./ Химия: формула успеха на вступительных экзаменах/ Н. Е. Кузьменко, В. И. Теренин, О. Н. Рыжова, О. В. Архангельская, В. В. Еремин, Е. А. Еремина, Н. В. Зык, С. И. Каргов, Л. И. Ливанцова, Г. Н. Мазо, И. В. Морозов, М. В. Обрезкова, Ф. Н. Путилин.—М.: Издательство Московского университета: Наука, 2006.—337 с.
2. Кузьменко Н. Е./ Вступительные экзамены и олимпиады по химии: опыт Московского университета/ Н. Е. Кузьменко, В. И. Теренин, О. Н. Рыжова, Р. Л. Антипин, О. В. Архангельская, В. В. Еремин, Н. В. Зык, С. И. Каргов, Е. В. Карпова, Л. И. Ливанцова, А. Г. Мажуга, Г. Н. Мазо, И. В. Морозов, М. В. Обрезкова, С. Б. Осин, Д. А. Пичугина, Ф. Н. Путилин.—М.: Издательство Московского университета—М. Издательство Московского университета, 2011.—624 с.

