В формировании у учащихся понятия об элементарном электрическом заряде изучение электрического тока в электролитах и законов Фарадея играет существенную роль.
Вместе с тем в методике изложения второго закона Фарадея, принятой в учебнике и в практике работы многих учителей, имеются существенные недостатки. Они сводятся к следующему.
1. Как известно, уже ряд лет в курс химии средней школы отсутсвует понятие о химическом эквиваленте. Между тем в учебнике физики второй закон Фарадея, без каких-либо предварительных объяснений или обоснований, дается в такой формулировке: «Электрохимические эквиваленты веществ прямо пропорциональных их химическим эквивалентом». Таким образом, содержание этого закона дается в формулировке, опирающейся на незнакомое учащимся понятие.
Конечно, учителя физики сообщают учащимся предварительно определение химического эквивалента. Но известно, что понятия формируются не только путем сообщения их определения, а главным образом в процессе их применения.
2. Изложение второго закона Фарадея никак не обосновывается и дается совершенно, догматически. Учащимся предлагают посмотреть таблицы электрохимических и химических эквивалентов, сравнить их отношение для ряда элементов и убедиться в том, что это отношение является постоянным.
При таком методе изложения у учащихся создается формальное представление о постоянстве отношения электрохимического эквивалента к химическому и содержание второго закона не раскрывается для них с достаточной глубиной.
Обращение к таблице электрохимических и химических эквивалентов, конечно, полезно, но только после того, как зависимость электрохимического эквивалента веществ от их атомного масса и валентности (т. е. от химического эквивалента) будет логически обоснована. В этом случае обращение к таблице подтвердит справедливость сделанных выводов.
Второй закон Фарадея, который с очевидностью вытекает из первого закона электролиза — экспериментального и из законов химических соединений, может быть легко обоснован.
Можно предложить следующую методику, проверенную опытом преподавания, позволяющую избежать указанных выше недостатков.
Выяснив при изучении первого закона Фарадея и при постановке лабораторной работы на определение электрического эквивалента какого-либо вещества, что электрохимический эквивалент не является универсальной постоянной и имеет различное значение для разных элементов, ставим перед учащимися задачу: выяснить, от чего зависит величина электрохимического эквивалента вещества.
Допустим, что имеются два вольтаметра, соединенные последовательно. В обоих вольтаметрах содержатся электролиты, состоящие из одновалентных ионов, например, НСl и NaCl. Далее, представим себе, что через вольтаметры проходит 1 кулон электричества, тогда в обоих вольтаметрах на анодах выделяются одинаковые количества хлора, равные его электрохимическому эквиваленту (это следует из первого закона Фарадея). На катодах же в одном вольтаметре выделится водород, а в другом — натрий. Очевидно, числа атомов водорода и натрия будут одинаковыми. Атомов выделится столько, сколько их входит в соединение с хлором. Массы же водорода и натрия будут различны, так как различны их атомные масса. Очевидно, что:
![]()
т. е. массы выделивщихся одновалентных элементов пропорциональных их атомных массам. Поскольку эти количества натрия и водорода выделены при прохождении через вольтаметры одного кулона электричества, можно записать:
![]()
т. е. электрохимические эквиваленты одновалентных элементов пропорциональных их атомным массам[1].
Для того чтобы показать зависимость электрохимического эквивалента вещества от его валентности, возьмем слова для вольтаметра, причем из них пусть будет электролит, в состав которого входят одновалентные положительные ионы, а в другом -электролит с двухвалетными положительными ионами, например, K2SO4 u CuSO4.
Тогда, при прохождении одного кулона электричества через вольтаметры, к анодам подойдет одинаковое число групп SO4, а на катодах выделятся медь и калий, причем столько атомов, сколько их входит в соединение с группами SO4. Таким образом, из законов химических соединений вытекает, что атомов меди выделится в два раза меньше, чем калия; на каждые два атома калия приходится один атом меди.
Отсюда следует, что:
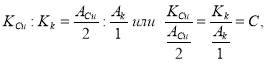
т. е. электрохимические эквиваленты веществ пропорциональны их атомным массам и обратно пропорциональны числам, выражающим их валентность. Коэффициент пропорциональности С, в отличие от, электрохимического эквиваленты, является универсальной постоянной.
В такой формулировке можно сообщить учащимся содержание второго закона Фарадея. Можно, конечно, в заключение, после раскрытия содержания закона, указать, что отношение атомного масса элемента к его валентности называется химическим эквивалентом, и дать формулировку закона и через понятия химического эквивалента.
В этом случае раскрытие содержания второго закона Фарадея не будет зависеть от глубины усвоения понятия о химическом эквиваленте.
Понятие о дискретности электрического заряда о существовании наименьшей (элементарной) порции электричества, вытекающее из законов Фарадея, чрезвычайно важно, так как оно является первым этапом в формировании у учащихся понятия об электроне. Именно этим обстоятельством объясняется стремление дать учащимся возможно более глубокое представление о законах Фарадея и следствиях, вытекающих из них.
Литература:
- Воронков Г. Я. Электричество в мире химии. -Москва: Знание, 1987.
- Манолов К. Великие химики. Перевод с болгарского языка. Т.1. -Москва: Мир, 1985. -С. 262–279.
- Оманов Х. Т., Расулов К. Р. Химический вечер «Фарадей, электричество и химия». //Журнал «Химия в школе». -№ 3, 1991. -С. 66–68.
[1] Поскольку электронные представления о валентности могут быть обоснованы лишь после изучения законов Фарадея, то учащимся напоминается известное им из курса химии следующее определение валентности: если каждый атом какого-либо элемента замещает собой один атом водорода, та такой элемент называется одновалентным.

