В ряду сигнальных молекул не последнее место занимают газообразные трансмиттеры, среди которых все больше внимания уделяется такому соединению, как монооксид углерода (СО) [1, 2, 5].
Сравнительно недавно оксид углерода (II) был известен лишь как токсичный газ. Его присутствие в крови считалось крайне нежелательным, поскольку он легко вытесняет кислород из связи с гемоглобином, что в итоге приводит к гипоксии. Однако исследования последних лет показали важную роль монооксида углерода играет в регуляции многих физиологических параметров и метаболической трансформации организма [4, 5].
Действуя через различные клеточные и молекулярные механизмы оксид углерода (II), индуцирует вазодилатацию. Показано, что монооксид углерода, улучшая кровоснабжение сердечной мышцы, способствует снижению риска развития инфаркта миокарда. СО-индуцированная релаксация сосудов головного мозга препятствует развитию ишемического инсульта [2].
Предполагается наличие взаимосвязи между релаксирующими эффектами СО на сосудистые гладкие мышцы и активацией калиевой проводимости мембраны. Наиболее вероятной мишенью действия монооксида углерода в клетке считают кальций-активируемые калиевые каналы большой проводимости, однако не исключается вклад потенциал-зависимой и АТФ-чувствительной компонент калиевой проводимости мембраны [3, 6].
Несомненная значимость СО в модулировании физиологических процессов и, в частности, сосудистого тонуса, а также отсутствие однозначных данных о механизмах такого регуляторного воздействия, требуют дальнейшего изучения.
Цель исследования. Исследовать роль калиевой проводимости мембраны гладкомышечных клеток аорты крысы в реализации эффектов монооксида углерода.
Материал и методы. Объектом исследования служили изолированные гладкомышечные сегменты грудного отдела аорты крысы. Для экспериментов использовались беспородные самцы белых крыс весом 180-250 г. Выделяли грудной отдел аорты крысы, затем его помещали в физиологически сбалансированный солевой раствор Кребса, отпрепаровывали жировую и соединительную ткань и нарезали сегменты шириной 2-3 мм. Эндотелий удаляли механически, вращением деревянного шпателя в просвете сегмента в течение 1 минуты непосредственно перед выполнением эксперимента.
Для исследования сократительной активности сосудистые гладкомышечные сегменты после предварительной нагрузки 500 мг фиксировали в рабочей камере объемом 10 мл, изготовленной из стекла. Камеру заполняли физиологическим раствором Кребса и термостатировали при 37ºС.
Измерение механического напряжения (МН) сосудистых гладкомышечных клеток проводилось с использованием четырехканальной механографической установки Myobath II и аппаратно-программного обеспечения LAB-TRAX-4/16 (Германия).
Амплитуду контрольных (100%) сократительных ответов сосудистых сегментов на действие гиперкалиевого раствора (эквимолярное замещение 30 мM NaCl на KCl) или фенилэфрина (1 мкМ) регистрировали после 40-50 минут выдерживания в нормальном растворе Кребса.
Физиологический раствор Кребса содержал (мM): 120,4 NaCl, 5,9 KCl, 2,5 CaCl2, 1,2 MgCl2, 5,5 глюкозы, 15 NH2C(CH2OH)3 [tris(hydroxymethyl)-aminomethane] (pH 7,4; 316,4 мосМ). В качестве донора монооксида углерода применялся tricarbonyldichlororuthenium(II)-dimer (CORM II) [3].
Используемые реактивы: 4-аминопиридин (Sigma), тетраэтиламмония хлорид (Sigma), фенилэфрин (Sigma).
Анализ полученных экспериментальных данных проводили при помощи программы Statistica 7.0 for Windows фирмы Statsoft. Результаты представлены в виде «среднее ± ошибка среднего» (X±m). Для определения характера распределения данных использовали критерий нормальности Колмогорова-Смирнова. Сформированные выборки не подчинялись закону нормального распределения, поэтому для проверки статистических гипотез был использован непараметрический критерий Манна-Уитни (Mann-Whitney U test). Достоверными считали различия при значении р<0,05.
Результаты и их обсуждение. Главенствующая роль ионов кальция в цикле сокращение-расслабление гладких мышц в настоящее время не вызывает сомнений. Ионы Ca2+ могут поступать из внеклеточной среды через Ca2+-каналы, а также освобождаться из внутриклеточных депо. Для активации потенциал-зависимого входящего кальциевого тока проводилось предсокращение гладкомышечных клеток (ГМК) аорты крысы 30 мМ раствором хлорида калия. Добавление CORM II в концентрациях от 1 до 1000 мкМ на фоне гиперкалиевой контрактуры приводило к дозозависимому снижению механического напряжения гладкомышечных сегментов. При этом расслабление близкое к полумаксимальному наблюдалось в ответ на добавление CORM II в концентрации 100 мкМ: механическое напряжение составило 56,4±6,7% (n=6, p<0,05) от контрольного гиперкалиевого сокращения (рис. 1, а).
Для изучения механизмов влияния монооксида углерода на регуляцию сократительной активности ГМК аорты крысы, вызванную стимуляцией α1-адренергических рецепторов, применяли фенилэфрин (ФЭ). Амплитуда сокращений гладких мышц аорты в ответ на добавление 1 мкМ фенилэфрина в раствор Кребса была сравнима с ответной реакцией на действие 30 мМ гиперкалиевого раствора.
На фоне сокращения, вызванного фенилэфрином, добавление CORM II в концентрациях от 1 до 1000 мкМ также приводило к дозозависимому расслаблению гладкомышечных сегментов. Полумаксимальный релаксирующий эффект наблюдался при добавлении CORM II в концентрации 10 мкМ: механическое напряжение составило 57,8±4,8% (n=6, p<0,05) от контрольного фенилэфрин-индуцированного сокращения (рис. 1, б).
В последующих экспериментах с применением тестирующих растворов использовалась концентрация CORM II, вызывающая расслабление гладкомышечных клеток аорты крысы близкое к полумаксимальному.
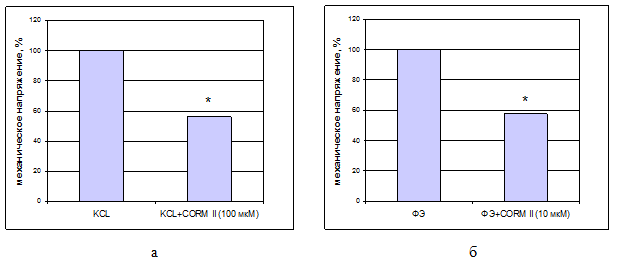 Рис.
1. Влияние CORM
II
на механическое напряжение гладкомышечных сегментов,
Рис.
1. Влияние CORM
II
на механическое напряжение гладкомышечных сегментов,
предсокращенных
гиперкалиевым (30 мМ) раствором (а) и фенилэфрином (1 мкМ) (б)
*-достоверные различия (p<0,05)
Взаимодействие монооксида углерода с ионными каналами рассматривается как важнейший механизм реализации СО-индуцированного расслабления гладких мышц сосудов. В частности, предполагается, что релаксирующее влияние монооксида углерода может быть связано с повышением калиевой проводимости мембраны ГМК [3, 4, 6].
Для изучения влияния СО на проницаемость мембраны сосудистых гладкомышечных клеток для ионов калия использовали неизбирательный блокатор калиевых каналов - тетраэтиламмония хлорид (ТЭА).
Добавление 10 мМ ТЭА в раствор Кребса не влияло на исходный уровень МН гладкомышечных клеток и не изменяло амплитуду гиперкалиевого (30 мМ KCl) сокращения. Однако добавление CORM II в концентрации 100 мкМ на фоне действия ТЭА приводило к статистически значимому уменьшению расслабления гладкомышечных сегментов: величина механического напряжения составила 91,8±2,1% (n=6, p<0,05) от контрольного гиперкалиевого сокращения.
Присутствие 10 мМ ТЭА в растворе Кребса не влияло на исходный уровень механического напряжения гладкомышечных клеток, но приводило к увеличению амплитуды сократительного ответа в ответ на действие фенилэфрина (1 мкМ) на 16,2% (n=6, р<0,05) по сравнению с контрольным ФЭ-индуцированным сокращением. Добавление CORM II в концентрации 10 мкМ на фоне действия ТЭА приводило к статистически значимому снижению релаксирующего эффекта гладкомышечных клеток: величина механического напряжения составила 93,3±3,8% (n=6, p<0,05) от контрольного фенилэфрин-индуцированного сокращения.
Уменьшение расслабляющего действия монооксида углерода на фоне действия ТЭА при гиперкалиевом и фенилэфрин-индуцированном сокращениях может служить свидетельством вовлечения калиевой проводимости мембраны в реализацию релаксирующих эффектов СО.
Для изучения роли потенциал-чувствительного компонента калиевой проводимости мембраны в реализации релаксирующего влияния монооксида углерода на ГМК аорты крысы использовали избирательный блокатор Кv-каналов - 4-аминопиридин.
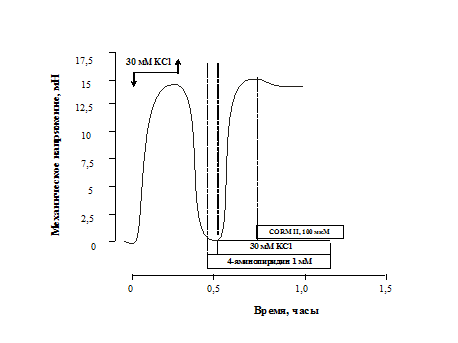
После предобработки гладкомышечных сегментов 4-аминопиридином (1мМ, 10 минут) расслабление, вызванное CORM II в концентрации 100 мкМ на фоне гиперкалиевой контрактуры, достоверно угнеталось: величина механического напряжения составила 95,5±4,5% (n=6, p<0,05) от контрольного гиперкалиевого сокращения, по сравнению с 56,4±6,7% (n=6, p<0,05) в отсутствии блокатора (рис. 2).
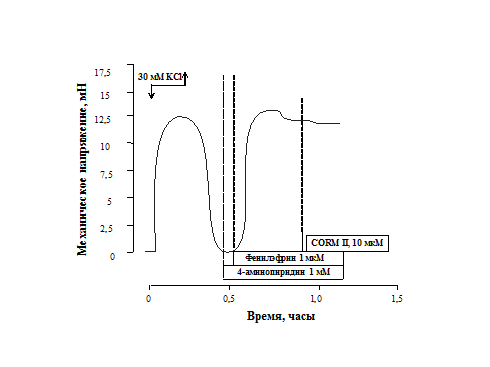
Аналогичный эффект после предобработки 4-аминопиридином наблюдался при действии CORM II в концентрации 10 мкМ на ФЭ-индуцированное сокращение: МН составило 96,4±1,9% (n=6, p<0,05) от контрольного сокращения, по сравнению с 57,8±4,8% (n=6, p<0,05) в отсутствии блокатора (рис. 3).
Полученные результаты, свидетельствуют о том, что потенциал-зависимый компонент калиевой проводимости мембраны вносит существенный вклад в СО-индуцированное расслабление сосудистых ГМК.
Рис. 2. Влияние 1 мМ 4-аминопиридина на релаксирующие эффекты 100 мкМ CORM II при действии гиперкалиевого (30 мМ) раствора
По оси ординат – механическое
напряжение (мН), по оси абсцисс – время (часы).
Стрелками
показано добавление и удаление соответствующих растворов
Рис. 3. Влияние 1 мМ 4-аминопиридина на релаксирующие эффекты 10 мкМ CORM II при действии фенилэфрина (1 мкM)
По оси ординат – механическое
напряжение (мН), по оси абсцисс – время (часы).
Стрелками
показано добавление и удаление соответствующих растворов
Заключение. Модулирование сократительных свойств гладкомышечных клеток, и в частности сосудистых ГМК, требует детальных знаний о механизмах регуляции развития и поддержания сокращения. Монооксид углерода относится к классу газовых сигнальных молекул, выполняющих в клетке регуляторную функцию.
Изучение механизмов влияния CO на функциональную активность клеток может иметь значение не только с позиции фундаментального знания о принципах регуляции внутриклеточных сигнальных систем, но и с позиции возможной терапевтической и профилактической значимости. Вазодилатирующие свойства монооксида углерода позволяют рассматривать его как потенциальное антигипертензивное средство.
При исследовании влияния монооксида углерода на сократительную активность сосудистых гладкомышечных клеток было установлено, что CO вызывал уменьшение величины механического напряжения как при гиперкалиевом, так и при фенилэфрин – индуцированном сокращениях.
Такая картина ответной реакции на действие монооксида углерода, очевидно, связана с вовлечением нескольких звеньев сети внутриклеточных регуляторных систем. При сокращении, индуцированном ФЭ, вероятно, происходит дополнительное вовлечение в реализацию эффектов монооксида углерода рецептор-управляемого входа ионов кальция и/или С – киназной ветви кальциевой сигнальной системы.
Предполагается, что одним из механизмов реализации релаксирующего эффекта СО является повышение калиевой проводимости мембраны. Проведенные исследования с применением блокатора калиевых каналов ТЭА показали, что на фоне его действия происходило достоверное снижение релаксирующего действия монооксида углерода как в случае гиперкалиевого, так и индуцированного фенилэфрином сокращений.
Существуют данные о способности СО напрямую воздействовать на кальций-активируемые калиевые каналы большой проводимости, его влиянии на АТФ-чувствительный компонент калиевой проводимости мембраны гладкомышечных клеток сосудов [3, 4, 6]. Наши исследования с использованием селективного блокатора потенциал-зависимых калиевых каналов 4-аминопиридина показали, что значительный вклад в реализацию расслабления СО сосудистых ГМК вносит и потенциал-чувствительный компонент калиевой проводимости мембраны.
Таким образом, монооксид углерода оказывает релаксирующее влияние на сократительную активность сосудистых гладких мышц путем активации калиевой проводимости мембраны, причем преимущественно за счет ее потенциал-чувствительного компонента.
Литература:
- Загоскин, П. П. Новые данные о физиологической роли монооксида углерода / П. П. Загоскин // Нижег. мед. журнал. – 2008. – № 3. – С. 103-110.
- Coceani, F. Carbon monoxide in vasoregulation: the promise and the challenge / F. Coceani // Circ. Res. – 2008. – 86. – P. 1184-1186.
- Heme is a carbon monoxide receptor for large-conductance Ca2+-activated K+ channels / J. H. Jaggar, A. Li, H. Parfenova et al. // Circ. Res. – 2007. – Vol. 97. – P. 805-812.
- Peers, Ch. Ion channels as effectors in carbon monoxide signaling / Ch. Peers, M. L. Dallas, J. L. Scragg // Comm. Integ. Biol. – 2009. – Vol. 2 – P. 241-242.
- Stec, D. E. Role of carbon monoxide in blood pressure regulation / D. E. Stec, H. A. Drummond, T. Vera // Hypertension. – 2008. – 51. – P. 597-604.
- Wang, R. The chemical modification of K channels by carbon monoxide in smooth muscle cells // R. Wang, L. Wu / J. Biolog. Chem. – 2005. – Vol. 207, N 13. – P. 8222-8226.