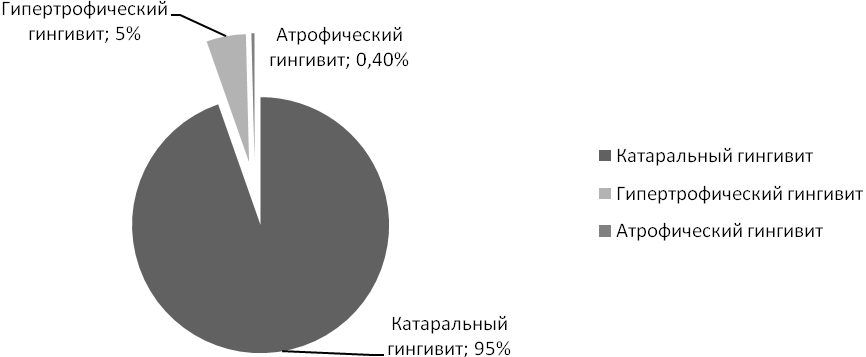Заболевание пародонта занимает одно из первых мест по частоте и распространенности среди стоматологических заболеваний. По данным ВОЗ, основанным по статистике 53 стран мира, в различных возрастных группах заболеваемость гингивитом и пародонтитом достигает 80-100% [1].
Современная отечественная классификация, принятая на заседании Президиума секции пародонтологии Стоматологической Ассоциации России (СТАР) в 2001 г., дает следующие определения и характеристики заболеваний пародонта:
- гингивит-воспаление десны - обусловленное неблагоприятным воздействием местных и общих факторов, которое протекает без нарушения целостности зубодесневого прикрепления и проявления деструктивных изменений в других отделах пародонта.
Формы: катаральный, язвенный, гипертрофический.
Течение: острое, хроническое.
Фазы процесса: обострение, ремиссия.
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтит - воспаление тканей пародонта, характеризующееся деструкцией связочного аппарата периодонта и альвеолярной кости.
Течение: хроническое, агрессивное.
Фазы процесса: обострение (абсцедирование), ремиссия.
Степень тяжести определяется по клинико-рентгенологической картине. Основным ее критерием является степень деструкции костной ткани альвеолярного отростка (на практике она определяется по глубине пародонтальных карманов (ПК) в миллиметрах).
Степень тяжести: легкая (ПК не более 4 мм), средняя (ПК 4-6мм), тяжелая (ПК более 6 мм).
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтоз - дистрофический процесс, распространяющийся на все структуры пародонта. Его отличительной чертой является отсутствие пародонтальных карманов и воспалительных явлений в десневом крае.
Течение: хроническое.
Степень тяжести: легкая, средняя, тяжелая (в зависимости от степени обнажения корней зубов-до 4 мм, 4-6 мм, более 6 мм).
Распространенность процесса: только генерализованный.
- синдромы, проявляющиеся в тканях пародонта - эта группа обозначалась ранее как идиопатические заболевания пародонта с прогрессирующим лизисом кости ( синдром Иценко-Кушинга, Элерса-анлоса, Шедиака-игаши, Дауна, болезнях крови и др.)
Пародонтомы- опухолеподобные процессы в пародонте (фиброматоз десен, пародонтальная киста, эпулис, эозофильная гранулема) [2].
Ранние проявления заболеваний пародонта воспалительного характера регистрируются в возрасте от 10-20 лет, 80% детей страдает гингивитом.
Эпидемиологические исследования населения различных регионов нашей страны свидетельствуют о высокой распространенности воспалительных изменений пародонта в различных возрастных группах (80-100%), например, среди школьников Москвы в возрасте 10 лет гингивит выявлен у 69%, 12 лет - у 77%, 15 лет – у 87% обследованных. Пародонтит средней тяжести выявлен в возрасте 12 лет – у 3%, в 15 лет - у 12%, в 16 лет - у 18% обследованных [3]. При обследовании 4947 детей Риги и других городов Латвии в возрасте от 7 до 14 лет Г.И. Кадникова выявила гингивит. Распределение по нозологическим формам представлено на диаграмме [4].
Диаграмма. Распределение гингивита по нозологическим формам
Выраженные деструктивные изменения в пародонте с вовлечением в процесс костной ткани наиболее часто выявляются у лиц старше 40 лет.
Многими исследователями показана полиэтиологическая природа заболеваний пародонта, причем большая роль в их развитии принадлежит воспалительным реакциям, спровоцированным микрофлорой ротовой полости. В связи с этим исследование микробиологических факторов патогенеза заболеваний пародонта следует признать одной из актуальных проблем современной стоматологии [1].
В состав постоянной микрофлоры полости рта входят представители нескольких групп микроорганизмов: бактерии, грибы, спирохеты, простейшие, вирусы.
Количество бактерий в полости рта по числу видов и содержанию в единицы материала конкурирует с составом желудочно-кишечного тракта. Бактерии в полости рта представлены разнообразными видами кокков, палочек и извитых форм. Содержание микроорганизмов в смешанной слюне составляет от 4 млн. до 5 млрд., в зубном налете – от 10 до 1000 млрд. в 1 г. сухого остатка. Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами. Относительная концентрация аэробных аэробных и факультативных бактерий в 1мл. слюны составляет 107, анаэробных – 108 [5].
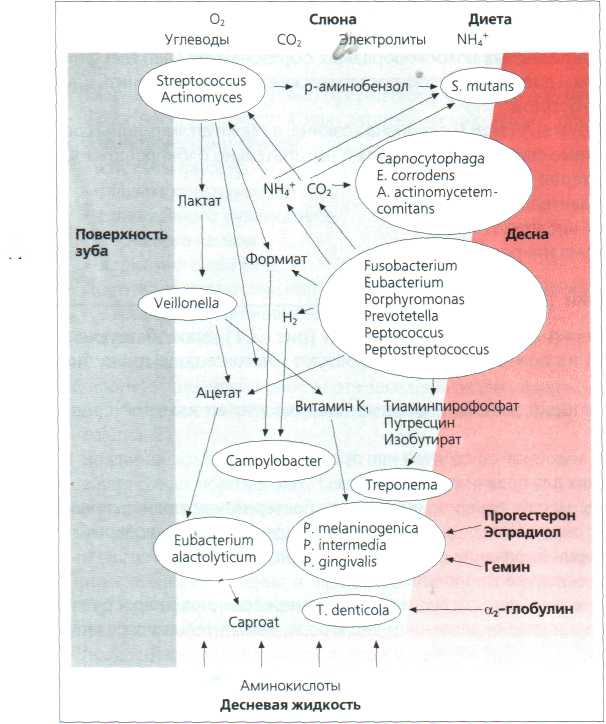
Среди разных видов бактерий существует метаболизм, способствующий тому, что микроорганизмы на поверхности зуба образуют многокомпонентную биопленку (Рис.1) [6].
Рис. 1. Метабиоз бактерий поддесневого участка
Совершенствование методов диагностики в микробиологии позволили более полно и точно изучить микробный спектр в норме и при патологии. Это дало возможность выявить наиболее патогенные виды микроорганизмов, характерных для того или иного заболевания. Изучением микрофлоры пародонтальных карманов занимались многие авторы. Исследования проводились с помощью фазовой контрастной и темнопольной микроскопии, бактериального культивирования, ферментативных, иммунодиагностических и молекулярных методов. Были выявлены три вида «маркерных» микроорганизмов, присутствие которых в пародонтальных карманах коррелирует с тяжестью или агрессивностью пародонтита. К ним относятся: Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis и Bacteroides forsythus.
В 1996 г. на Всемирном конгрессе по периодонтологии они были строго ассоциированы со статусом пародонтальной болезни и определены как «пародонтальные патогены».
Однако дальнейшие исследования позволили разделить обнаруженные в пародонтальных карманах микроорганизмы уже на шесть основных комплексов- «красный», «оранжевый», «голубой», «зеленый», «желтый», «пурпурный». При этом было доказано, что в пародонтальных карманах по мере углубления процесса грамотрицательные анаэробные микроорганизмы преобладают над другими видами. Было установлено, что наивысшей патогенностью для тканей пародонта обладают представители так называемого «красного комплекса»: Porphyromonas gingivalis, Bacteroides forsytus или Tannerella forsythia, Treponema denticola. «Оранжевый» комплекс также обладает высокой патогенностью. К нему относятся: Campylobacter rectus, Campylobacter showae, Eubacterium nodatum, Fusobacterium nucleatum, Prevotella intermedia, Prevotella nigrescens, Peptostreptococcus micros. «Голубой» комплекс включает в себя представителей рода Actinomyces. В «зеленый» комплекс входят:Actinobacillus actonomycetemcomitans, Capnocytophaga, Campilobacter concisus, Eikenella corrodens. actonomycetemcomitans, Capnocytophaga, Campilobacter concisus, Eikenella corrodens. Пятая, «желтая», группа состоит з стрептококков. В «пурпурную» группу входят Actinomyces odontoliticus и Veilonella parvulla [2].
Мюллер указал на то, что огромное значение для колонизации микробного пейзажа поддесневого пространства имеют синергизм и антогонизм между пародонтальными патогенами и другими бактериями полости рта. Микрофлора начинает обладать особыми патогенными свойствами, когда действует в ассоциациях. Большинство инфекционных процессов, возникающих в челюстно-лицевой области, носят эндогенный характер. Сам факт возникновения эндогенных инфекций отражает нарушение эволюционно сложившегося баланса между организмом и его микрофлорой, с одной стороны, и нарушением равновесия внутри микробных ассоциаций, с другой.
Т.к. большинство бактерий во всех природных экосистемах существуют в биопленках, сообщества микрооранизмов отличаются особым характером взаимодействия. В частности, они могут быть особо устойчивы к защитной реакции макроорганизма, резистентны к антибиотикам и выносливы в стрессовых для микроорганизмов ситуациях- повышение температуры, кислотности, обезвоживания. Неспорообразующие анаэробы зубодесневых карманов отличаются полиморфизмом, обладаютразличной степенью ферментативной активности. Факторами их патогенности являются: способность к колонизации, наличие капсулы, инактивирующих ферментов, инвазивность, токсигенность, способность к длительному выживанию в организме. Эти факторы способствуют, с одной стороны, проникновению в зараженный организм, а с другой стороны, противодействуют его защитным реакциям [7].
Анаэробные инфекции развиваются в некротизированной ткани в условиях нарушения кровоснабжения, а также при снижении окислительно-восстановительного потенциала, возникающего вследствие жизнидеятельности аэробов и факультативных анаэробов [8].
Опираясь на данные проведенных исследований появились основания к использованию на практике противомикробных препаратов местного и общего назначения. Например, препараты группы детергенты: этоний, хлоргексидина биглюконат, роккал, декаметоксин. Они устойчивы в водных растворах, обладают низким поверхностным натяжением. Вследствие денатурации белковых фракций бактерий они оказывают антисептическое, бактерицидное и фунгицидное действие даже на антибиотикорезестентные штаммы микроорганизмов [9].
Биглюконат хлоргексидина (ХГБ) - используют 0,05% раствор, оказывает быстрое и сильное антибактериальное действие в отношении большинства (до 99%) грамположительных и грамотрицательных аэробов и анаэробов, в т.ч. спирохет, спороцидное в отношении спор бактерий (только при высокой температуре), противогрибковое (фунгицидное), в т.ч. в отношении C. albicans, противопротозойное в отношении трихомонад, прочно связывается с поверхностными слоями слизистой оболочкой, поверхностью зубов, антисептический эффект сохраняется в течении 12 часов, не вызывает развития устойчивых штаммов микроорганизмов; сохраняет активность в присутствии крови, физиологических жидкостей и органических жидкостей [10]. Также применяют группу галоидов (хлорамин Б, йодинол, хлорид йода), кислоты и щелочи (натрия тетраборат, натрия гидрокарбонат), производные хиноксалина (диоксидин), производные фторхинолона (пефлоксацин, офлоксацин, ципрофлоксацин, норфлоксацин).
По мере развития воспаления в пародонте происходят глубокие расстройства механизмов регуляции и снижение компенсаторно-приспособительных возможностей системы микроциркуляции. Вслед за сосудистой реакцией активизируется неспецифическая защита: система комплемента и фагоцитоз; в зоне повреждения увеличивается количество нейтрофилов и эозинофилов. Однако возбудители инфекционного воспаления противодействуют защитным механизмам организма хозяина. Происходят разнообразные мутации, чтобы избежать фагоцитоза. Все эти эффекты затягивают течение воспаления, способствует его хронизации и не позволяют уничтожить флогогенный агент. На повреждающее действие микробов организм также отвечает комплексом реакций защиты и поддержания гомеостаза. Иммунная защита в тканях пародонта не ограничивается врожденными механизмами иммунитета, а переходит к адаптивным иммунным реакциями с участием антител и экспансией клонально-специфических лимфоцитов. Однако именно система иммунобиологического надзора является одним из ключевых звеньев патогенеза хронического воспалительного процесса в пародонте [2]. Обладая свойствами антигенов, микроорганизмы при участии местных антигенов, представляющих макрофагальные клетки полости рта, сенсебилизируют лимфоциты MALT-системы. Клоны, специфичные по отношению к антигенам микробов, экспансируют и осуществляют в полости рта иммунный ответ против возбудителей. Но усиленная альтерация пародонта ведет к образованию тканевых неоантигенов, образуются иммунные комплексы. В свою очередь, эти иммунные комплексы и неоантигенов, образуются иммунные комплексы и неоантигены также становятся объектами иммунной атаки. Все это приводит к присоединению аутоаллергического компонента к антимикробному иммунному ответу и способствует самоповреждению тканей пародонта. Иммунологические исследования в пародонтологии напрямую связаны с микробиологическими, а точнее с невозможностью во многих случаях объяснить разнообразие ответной реакции тканей пародонта на действие идентичных микроорганизмов или их скоплений [9]. По мере развития заболевания, иммунная система и ее эффекторы оказывают на тканевые структуры все более повреждающее действие, эффекты которого, в том числе разрушение зубодесневого соединения и периодонтальной связки, резорбция альвеолярной кости, становятся основой грубых функциональных нарушений. В связи с этим ключевую роль в развитии типичных клинических проявлений пародонтита играют разрушение зубодесневого соединения и формирование пародонтальных карманов. Это сопровождается образованием в их стенках очагов гранулематоза, деструкцией круговой связки и проникновением воспалительного инфильтрата вглубь с развитием и нарастанием резорбтивных изменений в альвеолярной кости [2].
Генерализованный пародонтит сопровождается ослаблением клеточного звена иммунитета: уменьшается число Т-лимфоцитов и угнетается их функциональная активность. Нарушается хемотаксис гранулоцитов, ослабевает их способность к фагоцитозу. Гранулоциты при генерализованном пародонтите тяжелой степени имеют низкую активность ферментов гликолиза и тканевого дыхания. Способность фибробластов к пролиферации при прогрессировании пародонтита снижается, волокнистый компонент соединительной ткани образуется ими в недостаточном количестве. Эти изменения расцениваются как недостаточность репаративного компонента воспалительной реакции.
Таким образом, пародонтит развивается как незавершенное хроническое воспаление без естественного устранения флогогенного агента и «правильного» репаративного конца [9]. Отмечена связь эффективности лечения воспалительных заболеваний пародонта с нормализацией местных и иммунологических показателей. Целесообразно проводить лечение с обязательной консультацией у иммунолога. При соблюдении пациентом адекватных и своевременных профилактических мер, можно избежать начала или обострения заболеваний пародонта. При проведении профессиональной гигиены полости рта средняя интенсивность хронического гингивита снижается на 38,7%. Индивидуальная гигиена полости рта 3 раза в день после еды в сочетании с профессиональной гигиеной полости рта каждые 3 месяца является надежным средством профилактики воспалительных заболеваний пародонта. Рациональный прием пищи, завершающийся твердыми овощами и фруктами, благотворно влияет на ткани пародонта.
- Литература:
- Григорьян А.С., Рахметова С.Ю., Зырянова Н.В. «Микроорганизмы в заболеваниях пародонта: экология, патогенез, диагностика», 2007 г., «Гэотар-Медиа», Москва
- Цимбалистов А.В., Сурдина Э.Д., Шторина Г.Б., Жидких Е.Д. «Комплексное лечение генерализованного пародонтита тяжелой степени с применением депульпирования зубов», 2008 г., «СпецЛит», Санкт-Петербург
- Курякина Н.В. «Заболевания пародонта», 2007 г., НГМА, Н.Новгород
- Иванов В.С. «Заболевания пародонта», 1998 г., «Медицинское информационное агентство», Москва
- Грудянов А.И., Дмитриева Н.А., Фоменко Е.В. « Применение пробиотиков в комплексном лечении воспалительных заболеваний пародонта», 2006 г., «Медицинское информационное агентство», Москва
- Мюллер Х.-П. «Пародонтология», 2004 г., «ГалДент», Львов
- Козинец Г.И., Высоцкий В.В., Погорелов В.И. «Кровь и инфекция», 2001 г., «Триада-Фарм», Москва
- Баумгартнер Дж.К. «Антибиотики в лечении заболеваний пульпы», 2004 г., «Азбука», Москва
- Долгих В.Т. «Клиническая патофизиология для стоматолога», 2000 г., «НГМА», Н.Новгород
- Яснецова В.В., Ефремова Г.Н. «Лекарственные препараты, применяемые в стоматологии», 2004 г., «Гэотар-Медиа», Москва