С момента открытия феномена апоптоза, или запрограммированной клеточной гибели началась эра активного его изучения. Проблема исследования молекулярных механизмов апоптоза стала в последние годы одной из самых трудных и актуальных в фундаментальной медико-биологической науке.
Формирование и поддержание структурно-функционального постоянства тканей и органов биологических систем определяются сбалансированностью процессов отмирания и обновления клеток. Учитывая значимость динамического баланса массы клеток для обеспечения полноценности функционирования любого органа и организма в целом, ученые предполагают, что в процессе эволюции выработались универсальные, надежные и разнообразные в иерархическом построении механизмы регулирования клеточной гибели и регенерации. Существование различных механизмов (вне- и внутриклеточных), обеспечивающих данный биологический феномен, позволяет надеяться на осуществление возможности избирательной регуляции клеточной смерти, что, несомненно, имеет огромное общемедицинское значение.
Апоптоз в клетках здорового организма является повсеместным и постоянно проходящим процессом. Клеточный обмен в тканях, иммунологические реакции, циклическая регрессия и возрастная инволюция некоторых тканей и органов – далеко не полный перечень физиологических процессов, сопровождающихся апоптозом. Нарушение процессов клеточной гибели может приводить к возникновению патологических состояний и заболеваний. Повышенная активность апоптоза является звеном патогенеза СПИД, ишемических повреждений разных органов [8,7].
Период жизни зрелых клеток периферической крови ограничен. В основе их обновления лежит взаимодействие коммитированных клеток – предшественников (ККП) с гемопоэтическими факторами роста. Причем высокая пролиферативная активность ККП обычно перекрывается физиологической гибелью (апоптозом) избыточного потомства. Гибнуть могут как делящиеся (на любой стадии клеточного цикла), так и зрелые клетки (например, лимфоциты, нейтрофилы). Апоптоз активное удаление ненужных клеток: механизм сдерживания амплификации дефектной ДНК. Программа этого типа гибели клеток состоит в том, что различные биохимические сигналы сходятся в общий метаболический путь летальных изменений морфологии: «цейозис», ломка цитоскелета, конденсация цитоплазмы с сохраненными органеллами, ядрышковая сегрегация, пикноз и кариорексис ядра, образование фагоцитируемых апоптозных тел. Модуляции сигнальных путей апоптоза кроветворных элементов играют ведущую роль в патогенезе гемобластозов, и детальное изучение процессов физиологической гибели клеток полезно для улучшения дифференциальной диагностики и развития принципиально новой терапии болезней системы крови [1].
Именно поэтому проблема клеточной альтерации и смерти приобретает с каждым годом все больший интерес.
Цель исследования: изучить протекторное действие α-токоферола на физиологический апоптоз и апоптоз вызываемый стрессом, клеток белой крови, а также изменения в лейкоцитарной формуле под влиянием стресса и витамина Е у старых самцов мышей.
Задачи исследования:
1. Выявить особенности влияния α-токоферола и стресса (водной депривации) на уровень апоптоза нейтрофилов и лимфоцитов у старых самцов мышей.
2. Исследовать отклонение от нормы в лейкоцитарной формуле мышей при действии стресса и α-токоферола.
Материалы и методы
В эксперименте использовались 55 мышей – самцов 15 месячного возраста со средней массой тела 30 г., по 13-14 животных в группе. Мыши содержались в стандартных условиях вивария.
Животные были подразделены на следующие экспериментальные группы:
1. Интактные животные (контрольная группа)
2. Животные, подвергшиеся воздействию дегидратации в течение четырех дней.
3. Мыши получавшие масляный 10% раствор D,L α-токоферолацетата per os в течении 14 дней, в дозе 0,5 мг./100г. массы тела, и подвергнутые в течение 4 дней дегидратационному стрессу.
4. Мыши, не подвергшиеся стрессированию и получавшие α-токоферол per os в той же дозе в течении 14 дней.
По окончанию опытов мышей декапитировали, под рауш- наркозом. Материалом для приготовления мазков служила кровь из хвостовой вены. Мазки крови окрашивали по Гимза-Романовскому.
В мазках крови определяли лейкоцитарную формулу – на основании дифференциального подсчета 200 лейкоцитов в окрашенном мазке крови и последующего вычисления их процентного содержания.
В тех же мазках подсчитывали количество нейтрофилов и лимфоцитов с признаками апоптоза разной степени.
Удобной моделью для исследования механизмов гибели клеток при действии разнонаправленных факторов служат лейкоциты, так как они легко подвергаются апоптозу.
Морфологические изменения лейкоцитов (уменьшение размеров клетки, вакуолизация, уменьшение ядра с конденсацией и грануляцией хроматина по периферии), характерные для апоптоза оценивали методом световой микроскопии (микроскоп МИКМЕД –2) в мазках крови. Мазки крови готовили сразу после декапитации животных. Подсчитывали количество клеток с признаками апоптоза в процентах от доли нейтрофилов и лимфоцитов в общей лейкоцитарной формуле.
Полученные данные были подвергнуты статистической обработки с использованием критерия Стьюдента [3].
Результаты исследования.
Исследование действие витамина Е и стресса на апоптоз клеток белой крови.
В мазках крови наблюдались нейтрофилы с морфологическими признаками, характерными для клеток крови, подвергшихся апоптозу. Нейтрофилы с признаками апоптоза имели округлую форму, но меньшего размера, иногда в цитоплазме выделялось несколько вакуолей. Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Изменения ядерного вещества выражалось в уменьшении ядра с конденсацией и грануляцией хроматина по периферии. Конденсация хроматина обусловлена расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов [4,1,6].
В лимфоцитах наблюдалась выраженная фрагментация хроматина на несколько частей. Иногда можно было заметить образование вакуолей, что также свидетельствовало об усилении апоптоза клеток.
Влияние витамина Е и водной депривации на апоптоз клеток крови старых самцов мышей
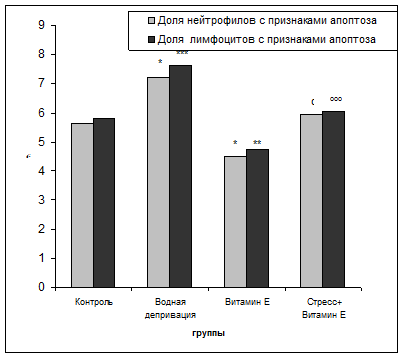
*p <0.05; ** p<0.01; *** p< 0.001.
оp<0.05; oo p<0.01; p< 0.001.
Под влиянием стресса происходит усиление апоптоза в сравнение с контролем (контроль – 5,64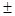 0,359 нейтрофилы и 5,83 ± 0,371 лимфоциты, стресс 7,21 ± 0,402 нейтрофилы, 7,64 ± 0,332 лимфоциты). Усиление апоптоза лейкоцитов при действии стресса может быть связано с интенсификацией процессов ПОЛ и увеличением содержания в крови его активных продуктов, вызывающих нарушение целостности мембран и развития признаков апоптоза. Биоантиоксидант - витамин Е привел к снижению апоптоза по сравнению с контролем (витамин Е – 4,52 ± 0,261 нейтрофилы, 4,77 ± 0,189 лимфоциты). Витамин Е снизил стрессорное воздействие, и приблизили показатели апоптоза к контролю (Стресс + витамин Е - 5,97 ± 0,338 нейтрофилы, 6,05±0,216 лимфоциты). Т.о. витамин Е привел к снижению апоптоза клеток крови животных подвергнутых стрессу, проявив свое стресс протекторное действие.
0,359 нейтрофилы и 5,83 ± 0,371 лимфоциты, стресс 7,21 ± 0,402 нейтрофилы, 7,64 ± 0,332 лимфоциты). Усиление апоптоза лейкоцитов при действии стресса может быть связано с интенсификацией процессов ПОЛ и увеличением содержания в крови его активных продуктов, вызывающих нарушение целостности мембран и развития признаков апоптоза. Биоантиоксидант - витамин Е привел к снижению апоптоза по сравнению с контролем (витамин Е – 4,52 ± 0,261 нейтрофилы, 4,77 ± 0,189 лимфоциты). Витамин Е снизил стрессорное воздействие, и приблизили показатели апоптоза к контролю (Стресс + витамин Е - 5,97 ± 0,338 нейтрофилы, 6,05±0,216 лимфоциты). Т.о. витамин Е привел к снижению апоптоза клеток крови животных подвергнутых стрессу, проявив свое стресс протекторное действие.
Влияние витамина Е и водной депривации на лейкоцитарную формулу молодых самцов мышей.
В нормальных условиях лейкоцитарная формула довольно постоянна. Количественный и качественный состав крови очень чутко реагирует на изменение физических параметров и отражает общее состояние организма. Незначительное отклонение от нормального состояния организма вызывает изменения морфологических показателей крови [5,2].
В ходе опыта нами было изучено изменение лейкоцитарной формулы под влиянием дегидратационного стресса, биоантиоксиданта витамина Е, а также комплексное воздействие этих факторов. Анализ полученных экспериментальных данных свидетельствует о том, что при действии водной депривации и α -токоферолацетата произошли характерные изменения лейкоцитарной формулы.
При действии дегидратационного стресса изменилось процентное соотношение в лейкоцитарной формуле: уменьшилось по сравнению с контролем число эозинофилов, базофилов, палочкоядерных нейтрофилов (p<0.01), лимфоцитов, моноцитов (p<0.001), таким образом, дегидратационный стресс вызвал четко выраженную лейкопению (Контроль: эозинофилы – 1,052±0,135, базофилы – 0,824±0,054, палочкоядерные нейтрофилы – 1,547±0,177, сегментоядерные нейтрофилы – 40,007±0,078, лимфоциты – 53,609±2,351, моноциты – 2,931±0,408; стресс (водная депривация): эозинофилы-0,534±0,055, базофилы – 0,601±0,056, Палочкоядерные нейтрофилы – 0,921±0,042, сегментоядерные нейтрофилы – 55,477±3,715, лимфоциты – 41,144±2,218, моноциты –1,327±0157).
Напротив, α-токоферолацетат способствовал формированию эозинофилии, существенно не изменив процентное содержание других форм лейкоцитов (эозинофилы-1,921±0,163, базофилы – 0,787±0,037, палочкоядерные нейтрофилы – 1,273±0,144, сегментоядерные нейтрофилы – 36,601±1,864, лимфоциты – 55,133±2,027, моноциты –2,684±0,157).
При комплексном воздействии (стресс + Витами Е) витамин Е проявил свое стресс-протекторное действие, тем самым, снизив влияние стресса (эозинофилы-1,375±0,061, базофилы – 0,862±0,098, палочкоядерные нейтрофилы – 1,343±0,138, сегментоядерные нейтрофилы – 44,174±1,821, лимфоциты – 49,831±2,106, моноциты – 2,418±0,301).
Литература:
1. Апоптоз в системе крови /В.М. Погорелов, А. Луговская, И.М. Федорова, Г.И. Козинец //Клиническая медицина.-1997.-№4.-с. 64.
2. Дубинина Л.Т. Лейкоциты крови человека. М.: Наука, 1975
3. Козак М.Ф. Биометрия. Астрахань АГПИ., 1995.- 164с.
4. Новиков В.С. Программированная клеточная гибель. – СПб.: Наука, 1996.
5. Общий курс физиологии человека и животных. В 2-х книгах. // под ред. А.Д. Ноздрачева. – М.: Высшая школа, 1991. – с. 139-147.
6. Петряева А.Т. Лейкоциты периферической крови// Вопросы охраны материнства и детства. 1976. Т.21, №12. С. 38-43.
7. Суханов Г.А., Акбашева О.Е. Апоптоз. - Томск.: ТПУ, 2006
8. Черных Е.И., Языков К.Г., Семке В.Я.. Апоптоз лейкоцитов периферической крови, индуцированный действием гипертермии и преднизолона, у лиц с расстройствами адаптации //Бюллетень экспериментальной биологии и медицины. 2002. Т. 134, № 12. С.617-619.

