Тромбофилия — повышенная склонность к тромбозам и тромбоэмболическим осложнениям, которая может быть вызвана приобретенными или генетическими дефектами гемостаза, а также их сочетанием[1]. Вовлеченность тромбофилии в патогенез различных заболеваний является основанием для ее исследования и поисков причин повышенного тромбообразования[5]. Одной из генетически обусловленных причин тромбофилии является мутация в гене метилентетрагидрофолатредуктазы( MTHFR), кодирующем соответствующий фермент, который является ключевым в фолатном цикле и катализирует реакцию превращения гомоцистеина в метионин.
Ключевые слова:тромбофилия, MTHFR
Введение. В последние два десятилетия интерес к изучению тромбофилий неуклонно возрастает. В настоящее время термин «тромбофилия» применяют для выделения группы людей, у которых венозные тромбозы возникают в молодом возрасте и имеют тенденцию к повторению. В большинстве своем у таких лиц имеется семейная предрасположенность к тромбообразованию и отсутствует какая-либо иная патология, способная стимулировать возникновение тромбозов. Исследование полиморфизма гена метилентетрагидрофолатредуктазы (MTHFR) имеет прогностическое значение и позволяет определить риск развития онкологических и сердечно-сосудистых заболеваний, а также дефектов внутриутробного развития во время беременности из-за нарушения обмена фолиевой и кислоты и гипергомоцистеинемии, оценить вероятность патологии у потомства[2].
Изучение MTHFR началось в 1970-е годы, когда Кутцбах и Стокстад выделили этот фермент. Исследования выявили связь наследственного дефицита указанного фермента с нарушениями обмена гомоцистеина. Примерно в те же годы было показано, что повышение уровня гомоцистеина является независимым фактором риска развития сосудистых осложнений. Начались попытки выяснения генетической природы дефицита MTHFR. Клонирование гена MTHFR в 1993 г. стало основой для определения мутаций, связанных с различными степенями дефицита фермента[3]. К настоящему времени в гене MTHFR выявлено 9 мутаций[5].
Ген MTHFR и его полиморфизм
Ген MTHFR у человека расположен на коротком плече первой хромосомы (1p36.3).
Длина всего кодирующего региона составляет около 1980 п.н. с расчетной молекулярной массой продукта 74,6 кДа. Он состоит из 11 экзонов длиной от 102 до 432 п.н. и интронов длиной от 250 до 1500 п.н., за исключением одного интрона длиной 4200 п.н.
 |
Рис.1 Локализация гена MTHFR[4]
Описано две разновидности гена MTHFR. Наиболее изученным является вариант, в котором нуклеотид цитозин (C) в позиции 677, относящейся к 4-му экзону, заменен на тимидин (T), что приводит к замене аминокислотного остатка аланина на остаток валина в сайте связывания фолата. Такой полиморфизм MTHFR обозначается как мутация C677T[3]. У лиц, гомозиготных по указанному варианту (генотип Т/Т), фермент MTHFR проявляет чувствительность к температуре (термолабильность) и теряет свою активность примерно на 65%. Вариант Т связан с четырьмя группами многофакторных заболеваний: сердечно-сосудистая патология, дефекты развития плода, колоректальная аденома и рак молочной железы и яичников. У женщин с генотипом Т/Т во время беременности дефицит фолиевой кислоты может приводить к дефектам развития плода, в том числе, незаращению нервной трубки. У носителей этого генотипа высок риск развития побочных эффектов при приеме некоторых лекарственных препаратов, используемых в раковой химиотерапии, например, метотрексата. Неблагоприятное воздействие варианта Т полиморфизма сильно зависит от внешних факторов – низкого содержания в пище фолатов, курения, приема алкоголя.
Варианты заключения:
C/C - нормальный вариант полиморфизма в гомозиготной форме;
C/T - гетерозиготная форма полиморфизма;
T/T - мутантный вариант полиморфизма, связанный с увеличением риска заболеваний, в гомозиготной форме
Частота встречаемости варианта Т полиморфизма в популяции: Т/Т - 10-16%, С/Т - 56%. Преобладающий генотип в популяции: (С/Т)[2].
Другим вариантом полиморфизма гена MTHFR является замена нуклеотида аденина (A) на цитозин (C) в позиции 1298. Это приводит к замене остатка глутамина на остаток аланина в регуляторном домене фермента, что сопровождается небольшим снижением его активности. У лиц, гомозиготных по мутации А1298C, отмечается снижение активности MTHFR примерно до 60% от нормы. Предполагается, что снижение активности фермента связано с изменением его регуляции ингибитором S-аденозилметионином[3]. Это снижение обычно не сопровождается изменением уровня гомоцестеина в плазме крови, однако сочетание мутантного аллеля E429C с аллелем 677T приводит к уменьшению уровня фолиевой кислоты. При этом риск дефектов развития невральной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно обе мутации, также снижена.
Варианты заключения:
А/А - нормальный вариант полиморфизма в гомозиготной форме;
А/С - гетерозиготная форма полиморфизма;
C/C - мутантный вариант полиморфизма, связанный с увеличением риска нарушений, в гомозиготной форме
Частота встречаемости варианта С полиморфизма в популяции: С/С - 3-13%, А/С - 45-55%. Преобладающий генотип в популяции: (А/А)[2].
В отличие от полиморфизма C677T, гетерозиготность и гомозиготность по мутации А1298C не сопровождается ни повышением концентрации общего гомоцистеина, ни снижением уровня фолата в плазме. Однако комбинация гетерозиготности аллелей 677T и 1298C сопровождается не только снижением активности фермента, а также повышением концентрации гомоцистеина в плазме и снижением уровня фолата, как это бывает при гомозиготности 677T.
Диагностика гомо- и гетерозиготности по аллелям 677T и 1298C производится методом полимеразной цепной реакции (ПЦР)[3].
Метилентетрагидрофолатредуктаза — ключевой фермент фолатного цикла
Фермент 5,10-метилентетрагидрофолат-редуктаза относится к группе флавопротеинов и состоит из двух одинаковых субъединиц с молекулярной массой около 70 кДа. MTHFR и является ключевым ферментом фолатного цикла. Фолат и фолиевая кислота (синтетический витамин, отсутствующий в естественных продуктах) представляют собой две формы семейства веществ, связанных с птероилглютаминовой кислотой (ПтеГлу). Указанная кислота является сложной молекулой, состоящей из птероидной кислоты и одного (моноглютаматы) или нескольких (до 9, полиглютаматы) остатков глютаминовой кислоты (см. рис. 2). Пища (особенно свежая зелень, печень, дрожжи и некоторые фрукты) в основном содержит восстановленные полиглютаматы, которые должны быть гидролизованы с помощью фермента птероилполиглютамат-гидролазы до моноглютамата, чтобы они могли быть абсорбированы в проксимальном отделе тонкого кишечника. После всасывания фолат-моноглютамат быстро восстанавливается до тетрагидрофолата, поскольку только восстановленные формы фолата обладают биологической активностью. После метилирования фолаты поступают в кровь в виде 5-метилтетрагидрофолата. Помимо пищевых продуктов, постоянное поступление 5-метилтетрагидрофолата обеспечивает кишечно-печеночный цикл: птерил-моноглютамат всасывается из кишечника и поступает в печень, где он восстанавливается и метилируется до 5-метилтетрагидрофолата. Образовавшийся 5-метилтетрагидрофолат выделяется с желчью в кишечник, где он затем всасывается и разносится с кровью по всему организму.
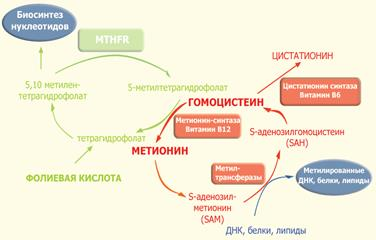 |
Рис. 2. Фолатный цикл и цикл метионина.
В ткани поступление 5-метилтетрагидрофолата внутрь клетки происходит с помощью эндоцитоза при участии специфических фолатных рецепторов. Внутри клетки 5-метилтетрагидрофолат служит донором метильных групп и основным источником тетрагидрофолата. Последний выступает в качестве акцептора большого числа моноуглеродных групп, превращаясь в разные виды фолатов, служащих в свою очередь специфическими коферментами в целом ряде внутриклеточных реакций. К ним относятся 5-формилтетрагидрофолат (фолиниевая кислота, лейковорин), 10-формилтетрагидрофолат и 5,10-метилентетрагидрофолат.
Одной из реакций, требующих наличия 5,10-метилентетрагидрофолата и 5-метилтетрагидрофолата, является синтез метионина из гомоцистеина (путь реметилирования). В указанной реакции MTHFR играет ключевую роль, восстанавливая 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата, и, соответственно, выступает в роли катализатора единственной внутри клетки реакции образования 5-метилтетрагидрофолата. Несмотря на то, что в сыворотке и других тканевых жидкостях обнаруживаются разные формы фолатов, главной формой фолата в плазме является 5-метилтетрагидрофолат, несущий на себе метильную группу, необходимую для превращения гомоцистеина в метионин. В этой реакции метильная группа вначале переносится на коб(I)аламин (форма витамина B12), превращая его в метилкобаламин, который затем отдает метильную группу гомоцистеину, образуя метионин с помощью фермента метионин-синтазы. Однако в некоторых случаях коб(I)аламин может окисляться до коб(II)аламина, что приводит к подавлению метионин-синтазы. Для поддержания активности фермента необходимо восстановительное метилирование, которое осуществляется с помощью фермента метионин-синтаза-редуктазы.
Поскольку кобаламин (витамин B12) служит акцептором метильной группы 5-метилтетрагидрофолата, дефицит этого витамина выступает в роли "ловушке для фолата". Это тупиковый путь метаболизма, поскольку метилтетрагидрофолат не может при этом восстанавливаться до тетрагидрофолата и возвращаться в фолатный пул. Неспособность регенирировать метионин приводит к истощению запаса метионина и выбросу в кровь избытка гомоцистеина.
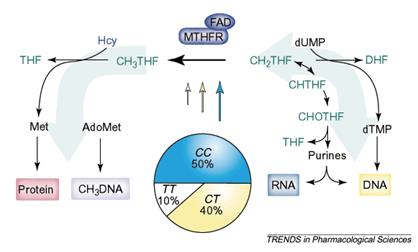 |
Рис. 3 C677T-полиморфизм 5,10 метилентетрагидрофолат-редуктазы (MTHFR) влияет на распределение соединений фолиевой кислоты (выделены зеленым цветом), используемых для синтеза ДНК и РНК, и 5-метилтетрагидрофолата, необходимого для реметилирования гомоцистеина (Hсy), а, значит, — для синтеза белка. Секторная диаграмма показывает распределение генотипов, типичное для европейских популяций, а размеры стрелок показывают относительную ферментную активность MTHFR[3].
ЗАКЛЮЧЕНИЕ
Изучение проблемы тромбофилии активно продолжается. Можно полагать, что утверждения о том, что семейная тромбофилия – олигогенная патология, будут не такими категоричными, так как возможности человеческого организма практически безграничны. В то же время следует считать, что генетический подход поможет идентифицировать те генетические дефекты, которые сегодня только предполагаются. Сложные лабораторные исследования, в том числе иммуноферментные, позволяющие обнаружить молекулярные маркеры тромбофилии, и методы ДНК-диагностики, направленные на уточнение ее природы, дают возможность своевременно диагностировать гиперкоагуляционное состояние, определить подходы к его лечению.
Литература
5 Баранов В.С. // Генетическийпаспорт — основа индивидуальной и предиктивной медицины /— Спб.: Изд-во Н-Л, 2009. — 328 с.

