В данной работе изучена кинетика электроосаждения золота из электролита, содержащего золотохлористоводородную и соляную кислоту и предназначенного для получения золотого осадка, обладающего пористой структурой с высокоразвитой поверхностью. Предложен метод анализа данного электролита.
Ключевые слова: золотохлористоводородная кислота, гальваническое золочение, пористое золото.
Электрохимическое золочение широко применяется в современной промышленности. Золото наносится на медь, медные сплавы, серебро и никель. Золотом покрываются различные изделия с целью улучшения внешнего вида, для придания изделиям красивого внешнего вида, для защиты изделий от коррозии [1]. Для радиоэлектронной аппаратуры применяют толщину от 0,5 до 5 мкм.
Для изготовления чувствительных сенсоров для электрохимических газоанализаторов кислорода необходимо создание электродов из золота. Для хорошей адсорбции кислорода на электроде золото должно быть пористым и иметь развитую свободную поверхность. Такие электроды можно изготавливать методом электролитического нанесения золота.
Наиболее распространенными на практике являются токсичные щелочные цианистые электролиты золочения. Они содержат до 15 г/л золота в пересчете на металл, а также до 90 г/л свободного цианида. Так же они требуют нагревания до 55–70°C и постоянного перемешивания. Их преимуществами является возможность получения золота высокой чистоты, возможность работы с растворимыми анодами. Покрытия, получаемые из подобных электролитов, осаждаются матовыми, блестящими при добавлении ПАВ. Однако такие покрытия не являются пористыми, обладают неразвитой удельной поверхностью. Так же известны электролиты, содержащие золотохлористоводородную кислоту. Подобные электролиты применяются для специальных целей, и помимо золотохлористоводородной кислоты содержит большое количество железистосинеродистого калия и прочие компоненты [2].
Предложенный в данной работе электролит является не таким токсичным, как цианистые, однако за счет высокого содержания кислоты данный электролит является агрессивным. Процесс протекает при комнатной температуре, с растворимым анодом. Режим электролиза — катодная плотность тока 6–7 мА/см2, периодическое перемешивание электролита. Покрытия, получаемые из данного электролита в предложенном режиме характеризуются матовостью, пористостью, хорошим сцеплением с поверхностью, имеют цвет от светло-коричневого до черного. При работе в данных электролитах наблюдается значительное выделение водорода на поверхности подложки. Составы предложенных электролитов представлены в таблице 1.
Таблица 1
|
Компонент |
Концентрация, г/л | |
|
Электролит 1 |
Электролит 2 | |
|
HAuCl4, в пересчете на золото |
1,1 |
3,85 |
|
HCl |
12 |
12 |
Для анализа данного электролита целесообразно использовать гравиметрический метод. Золото осаждается путём добавления к электролиту восстановителя, например сульфата железа (II), после чего отстаивается до полного осаждения и многократно промывается водой. При необходимости на этом этапе удаляются примеси, после чего осадок золота осушается и взвешивается.
Изучение кинетики выделения золота проводилось с использованием потенциостата IPC-2000 и трехэлектродной ячейки, при линейной развертке потенциала со скоростью 2 мВ/с. Рабочий электрод — золотая пластина, площадью 0,7 см2, вспомогательные электроды — платиновые. Электрод сравнения — насыщенный хлоридсеребрянный. При получении катодных поляризационных кривых потенциал смещался в отрицательную область на 800 мВ. При это на рабочем электроде протекает процесс восстановления золота, и процесс восстановления водорода. Полученные кривые приведены на рисунке 1.
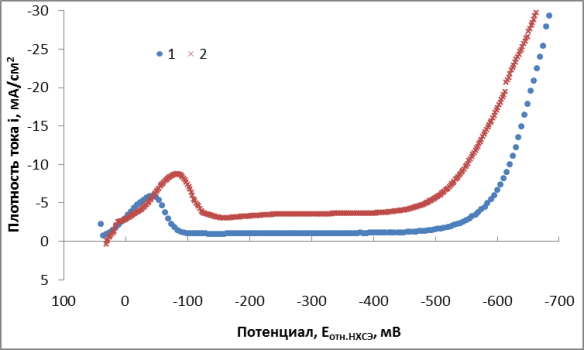
Рис. 1. Катодные кривые выделения золота из электролитов различной концентрации
Как видно из рисунка 1, процесс осаждения золота в золотохлористоводородном электролите лимитируется диффузией [2]. Предельный ток наступает при перенапряжении 110–120 мВ, и увеличивается с ростом концентрации золотохлористоводородной кислоты. При дальнейшем смещении потенциала в отрицательную область (при потенциале 540–560 мВ) наблюдается экспоненциальное увеличение плотности тока. Подобный рост плотности тока можно объяснить активным при данных потенциалах процессом выделения водорода.
Таким образом, осаждение пористого золота производится на плотностях тока выше предельной. Несмотря на снижение выхода по току золота, выделяющийся при электролизе водород способствует получению пористого покрытия с развитой поверхностью. Золотые покрытия с подобными свойствами могут применятся в тех областях промышленности, где необходима способность к сорбции кислорода, например при производстве сенсоров электрохимических датчиков кислорода.
Литература:
- Буркат Г. К. Серебрение золочение, палладирование и родирование. — Л: Машиностроение, 1984. — 86 с.
- Электролит для осаждения сплава золото-бор [Текст]: пат. 2347858 Российская Федерация: МПК C 25 D 3 62
- Теоретическая электрохимия: Учебник для вузов по направлению подготовки «Химическая технология» / А. Л. Ротинян [и др.]. — 2-е изд., перераб. и доп. — М.: Студент, 2013. — 496 с.

