Получение и исследование наноматериалов — важный этап в создании техники нового поколения. Нанопорошки перовскитов (в частности, CrFeO3) и твердые растворы на их основе вызывают большой интерес, благодаря своим уникальным физическим и химическим свойствам. Эти соединения с ромбоэдрической структурой являются перспективными материалами для применения в качестве катализаторов [1–3].
Синтез нанопорошков методом Печини привлек к себе внимание в связи с низкой температурой и высокой однородностью получающихся частиц [1–2].
Помимо окисления алкоголя, является важным процессом в органическом синтезе, и продукты в процессе окисления алкоголя являются важным сырьём, необходимым для химической промышленности, косметики, медицины.
При окислении алкоголя в газовой фазе существуют некоторые недостатки, такие как: температура реакции часто бывает очень высокой, время контакта между реагентами и катализатором короткое, так что новое направление исследования в этой
реакции ‑окисление в жидкой фазе. Сегодня выбирают реагенты, способные окислить высокоактивно, но, что более важно, не загрязнить окружающую среду, так используется H2O2 для реакции окисления алкоголя [4].
Цель настоящей работы — синтез нанопорошков CrMnxFe(1-x)O3 (x=0; x=0,2) методом Печини и исследование их каталитической активности в реакции окисления C6H5CH2OH в C6H5CHO пероксидом водорода.
Экспериментальная часть
Синтез нанопорошков CrMnxFe(1-x)O3: К 50 мл водного раствора, содержащего 0,4 М Cr(NO3)3, 0,4 x M Mn(NO3)2 и 0.4(1-x) М Fe(NO3)3 (x = 0; 0,2) добавляли 20 мл раствора, содержащего 8,406 г лимонной кислоты и 20 мл абсолютного этанола. Полученный раствор нагревали до 60°C 4 ч при перемешивании, чтобы получить гель. Гель сушили сначала при 70°С в течение 24 ч, затем прокаливали гель в муфельной печи при температуре 700°С в течение 5 ч.
Фазовые и структурные исследования проводились при комнатной температуре на рентгеновском дифрактометре Simens D5000 с фокусировкой по Бреггу-Брентано на CuKα-излучении. Полученные дифрактограммы анализировали с использованием базы данных JCPDS [5].
Размер частиц определяли методом высоковольтной просвечивающей электронной микроскопии (ПЭМ).
Реакцию окисления осуществляют в жидкой фазе, в 3-горлой колбе с обратным холодильником, капельной воронкой Н2О2 и магнитной мешалкой с нагревом при 60°С. Реакция протекает в течение 5 ч.
Образцы после окисления анализировали с использованием газовой хроматографии — масс-спектрометрии (ГХ/МС) приборных комплексов Hewlett HP 6890, Mass selective detector Hewlett HP 573.
Для оценирования каталитической активности проводят эксперименты с 3 образцами: образец 1 ‑ не использовали катализатора перовскита; образец 2 ‑ использовали катализатор CrFeO3; образец 3 ‑ катализатор CrMn0,2Fe0,8O3.
Степень превращения реакции окисления C6H5CH2OH в C6H5CHO определяется из результатов ГХ/МС.
Обсуждение результатов
По данным РФА (рис. 1, 2), образцы перовскитов номинального состава CrMnxFe(1-x)O3 (x = 0; 0,2), термообработанные при 700oC в течение 5 ч, являются однофазными и имеют ромбоэдрическую структуру (такую же, как у перовскита CrFeO3). Основные пики соответствуют ромбоэдрической структуре CrFeO3 (Card No: 35–1112 [5]).
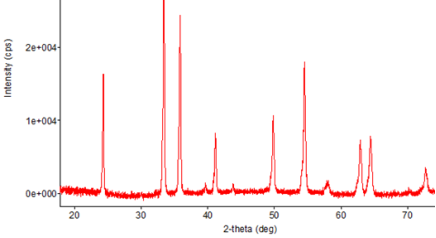
Рис. 1.Дифрактограмма образца CrFeO3 после отжига при 700oC
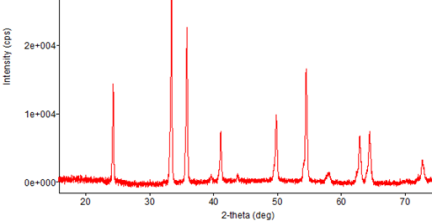
Рис. 2. Дифрактограмма образца CrMn0,2Fe0,8O3 после отжига при 700oC
На рис. 3 представлены ПЭМ изображения порошков CrFeO3 после отжига при 700oC. Из рис. 3 видно, что частицы имеют разные формы: приблизительно круглую, круглую со слабо выраженной огранкой и квадратную. Каждая частица связана с несколькими соседями контактными перешейками. Средний размер частиц составляет 40 нм.
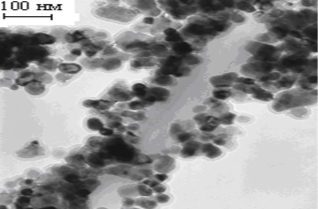
Рис. 3. ПЭМ ‑ изображения образцов CrFeO3
Из результатов ГХ/МС получили содержание C6H5CH2OH и C6H5CHO в образцах и рассчитали степень превращения C6H5CH2OH в C6H5CHO и другие продукты. Все результаты приведены в таб. 1.
Таблица 1
Содержание продуктов истепень превращения бензилового спирта
|
Катализатор |
Содержание продуктов |
Степень превращения бензилового спирта (%) | |
|
Бензальдегид |
Бензиловый спирт | ||
|
Нет катализатора |
0 |
100 |
0 |
|
CrFeO3 |
25,34 |
73,52 |
26,48 |
|
CrMn0,2Fe0,8O3 |
30,38 |
63,99 |
36,01 |
По данным таблицы видно, что в случае «Нет катализатора» в продуктах реакции не получили бензальдегида, т. е превращение C6H5CH2OH в C6H5CHO не происходит.
При использовании катализатора CrFeO3 степень превращения бензилового спирта — 26,48%, из которых 25,34% преобразуется в бензальдегид.
При замещении части Fe на Mn (CrMn0,2Fe0,8O3) степень превращения увеличилась с 26,48% до 36,01%, и соответствующее содержание бензальдегида увеличилось с 25,34% до 30,38%.
При этом экспериментальные результаты показывают, что катализатор CrMn0,2Fe0,8O3 придает степень превращения выше, чем CrFeO3. Это можно объяснить присутствием марганца в катализаторе CrMn0,2Fe0,8O3. Mn является металлом с несколькими степенями окисления, и его ионы способны к высокому окислению. А также при замещении части Fe на Mn (CrMn0,2Fe0,8O3) может вызвать деформацию структуры, образуя пустую полость, приводит к увеличению каталитической активности.
Заключение
Таким образом, методом Печини синтезированы нанопорошки CrFeO3 и CrMn0,2Fe0,8O3 средним размером 40 нм. По данным РФА, образцы являются однофазными и имеют ромбоэдрическую структуру.
Рассмотрели каталитическую активность перовскитов CrFeO3 и CrMn0,2Fe0,8O3 для реакции окисления C6H5CH2OH в C6H5CHO пероксидом водорода. Установлено, что использование катализаторов приводит к увеличению степени превращения бензилового спирта, из которых катализатор CrMn0,2Fe0,8O3 придает степень превращения выше, чем CrFeO3.
Литература
- Гусев, А. И. Наноматериалы, наноструктуры. ‑ М., 2007.
- Гусева, А. Ф.; Нейман, А. Я.; Нохрин, С. С. Методы получения наноразмерных материалов. ‑ Екатеринбург. УрГУ., 2007.
- Jiguang Deng, Lei Zhang. Insitu hydrothermally synthesized mesoporous LaCoO3/SBA-15 catalysts: high activity for the complete oxidation of toluene and ethyl acetat. // Applied Catalysis A: General. — 2009. — Vol. 352. — P. 43–49.
- Sotelo J. L., Ovejero G., Martinez F. Catalytic wet peroxide oxidation of phenolic solutions over a LaTi1−xCuxO3 perovskite catalyst. // Applied Catalysis B: Environmental. -2004. – Vol. 47. — P. 281–294.
- Powder Diffraction File. Swarthmore. Joint Committee on Powder Diffraction Standards. – 1976.

