Окисление люминола пероксидом водорода в присутствии сульфата меди в качестве катализатора, который доказал, что его присутствие в реакционной смеси дали период полураспада взаимодействия, является приемлемым по сравнению с литературой, которая была получена с помощью величины кинетики реакции и постоянного учета взаимодействия.
Люминол и его производные могут быть окислены в присутствии катализаторов и энхансеров, что приводит к хемилюминесценции (ХЛ) [1]. Основными областями применения этой реакции являются определение количественного пероксида водорода, анализа следов металлов, как Cu(II), определение восстановителей и антиоксидантов, а также определение меченых антител в иммунологических [1, 2]. CuSO4 широко используется в качестве катализатора для окисления люминола пероксидом водорода [3,4]. Он представляет собой стабильный и дешевый миметик металлопрофиля, такие как пероксидаза хрена (HRP), обеспечивая воспроизводимые результаты в нескольких аналитических методах [5]. Свойства хемилюминесценции, такие как начальная интенсивность света (I0), площадь эмиссии (S) и констант, наблюдаемые скорости (Кнабл) изучаются изменением концентрации всех реагентов с использованием многомерного факторного подхода.
В этой работе прослеживается четкое влияние концентрации катализатора на свободу реакции люминола в присутствии пероксида водорода окислителем, чтобы получить лучшую интенсивность хемилюминесценции.
Экспериментальная часть
Исследование градуировочной зависимости реакции люминола с перекисью водорода от концентрации катализатора (сульфата Cu) на старом приборе.
Провели измерение интенсивности люминисценции для реакции люминола при добавлении различной концентрации сульфата Cu.
Готовим раствор смешанного реагента: смешиваем 15 мл 0,1% раствора люминола в 0,67% гидроксиде натрия с 15 мл 3% раствора перекиси водорода. Смешанный реагент настаивается 30 мин до появления крупных пузырьков. Готовим растворы CuSO4:
При концентрациях меди (моль/л): 0.07, 0.1, 0.2, 0.3, 0.4, 0.5
Проводим исследования интенсивности сигнала от различной концентрации сульфата Cu в реакции люминола с пероксидом водорода. К 1 мл смешанного реагента добавляли 1 мл раствора сульфата Cu.
Кинетика реакции зарегистрирована теоретически на основе блока для концентрации различных сульфата меди в зависимости от времени реакции.
Результаты иобсуждения
Механическое взаимодействие описано ниже, показывает окисление люминола пероксидом водорода в присутствии сульфата меди в качестве катализатора, что позволило увеличить уязвимость к окислительному стрессу люминола, который, следовательно, дает высокую интенсивность хемилюминесценции.
Выбранной лимитирующей стадией к скорости реакции была стадия (3), из которой был получен при постоянной скорости взаимодействия и периодом полураспада взаимодействия.
Из рассмотрения концентрации и логарифмирования концентрации со времени реакции можно сделать вывод, что концентрация и логарифмирование концентрации зависит от времени реакции.
В то же время отмечаем, что самая высокая концентрация была в обмен на меньшее время реакции, и это ожидается для таких реакций кинетики (Таблица 1).
Таблица 1
Влияние времени на кинетику реакции вприсутствии сульфата меди катализатора
|
Время |
Концентрация |
ln (концентрация) |
|
25 |
0.07 |
-2.65926 |
|
20 |
0.1 |
-2.30259 |
|
16 |
0.2 |
-1.60944 |
|
12 |
0.3 |
-1.20397 |
|
9 |
0.4 |
-0.91629 |
|
6 |
0.5 |
-0.69315 |
Rate α [Cu+2]
Rate= -d [Cu+2]/dt
—d [Cu+2]0 / [Cu+2]t = K dt
Где, [Cu+2]0 = [A]0, [Cu+2] = [A]t
![]()
ln [A]0 — ln [A]t = Kt
—ln [A]t = -0.65
[A]t = 10–0.65 = 3.16*10–7моль/л
Slop = K= 0.210 моль.л.с-1
t1/2 = 0.693/K = 3.292 секунда.
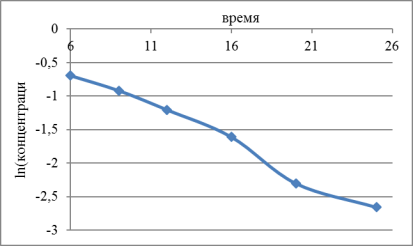
Рис. 1. Зависимость логарифмирования концентрации от увеличения времени реакции
Из рис. (1) видно, что логарифм концентрации с увеличением времени реакции уменьшается, это также подтверждается предыдущими исследователями.
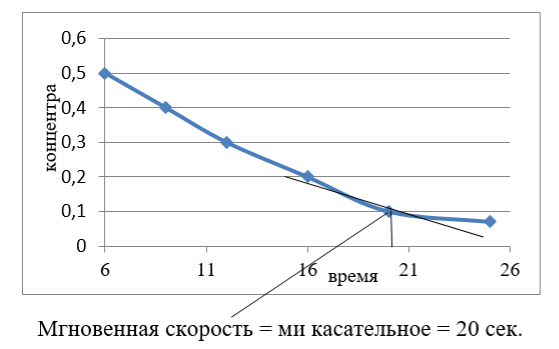
Рис. 2. Зависимость концентрации от увеличения времени реакции
На рис. (2) заметно, что концентрация смеси уменьшается в обмен на увеличение времени реакции, Для того, чтобы получить в линии контакт, измеренный с помощью мгновенной скорости реакции, которая происходит 20 секунд, достаточно получить более высокую хемилюминесценцию для реакции, где сульфат меди используется в качестве катализатора.
Литература
- Baader, W. J. Chemiluminescence of organic peroxides. In The Chemistry of Peroxides/ W. J. Baader, C. V. Stevani, E. L. Bastos // R appoport Z(ed.). Wiley: Chichester.‑ 2006. ‑ P. 1211–1278.
- Garcia-Campana, A. M. Potential of chemiluminescence and bioluminescence in organic analysis/ A. M. Garcia-Campana, W.RG. Baeyens, L. Cuadros-Rodriguez, F. A. Barrero, J. M. Bosque-Sendra, L. Gamiz-Gracia //Curr.Org. Chem. ‑ 2002.‑ V. 6.‑ P.1–20.
- Ewetz,L. Factors affecting specificity of luminolreactionwithhematin compounds/ L. Ewetz, A.Thore // Anal.Biochem.1976; 71: 564–570.
- Jones,P. Kinetics and mechanism of catalysis by ferrihaems in the chemiluminogenic oxidation of luminol by hydrogen peroxide/P. Jones, N. R. Scowen //Photochem.Photobiol.‑ 1987. ‑V. 45. ‑ P. 283–289.
- Zhang, XR. Recent developments of luminol-based chemiluminescence analysis/ X. R. Zhang, W.RG. Baeyens, A. M. García Campaña// Biomed.Chromatogr. ‑ 1999. ‑ V. 13. ‑ P.169–170.

