При изучении механизма электродного процесса электроокисления используемых реагентов, прежде всего, необходимо было определить значения числа электронов, отдаваемых при их электроокислении. Как известно, в электрохимии число электронов, принимающих участие в окислении одной молекулы электроактивного вещества на платиновом вращающемся микродисковом электроде, можно было бы определить на основе теоритического уравнения математического описания процесса [1] для предельного тока:
I=0,62 ·n·F·s·D2/3·γ-1/6· ώ1/2 ·C
где n- число электронов; F-константа Фарадея, кл/моль-1; s-площадь поверхности платинового диска, см2, D—коэффициент диффузии деполяризатора, см2/c; γ– кинематическая вязкость раствора фонового электролита, см2/c; ώ-угловая скорость, с-1; С-концентрация деполяризатора, моль/ см3; I- величина тока, А.
Однако, для применения такого способа расчета предельного тока требуется знание коэффициента диффузии электроактивного вещества в исследуемом неводном растворе, содержащем различные по природе фоновых электролитов. Между тем, значения коэффициента диффузии исследованных деполяризаторов в используемых неводных растворах в литературе отсутствуют. Применение же для этой цели приближенного значения коэффициентов диффузии используемых реагентов, рассчитанных по формуле Стокса-Эйнштейна, мало надежно, в особенности для многоэлектронных процессов [2]. Расчет числа электронов по уравнению волны, как известно, может дать правильное значение только в случае хорошо обратимых процессов, в которых ограничивающей стадий является доставка деполяризатора к поверхности электрода, а не стадия разряда, а как правило, подавляющее же большинства органических соединений окисляется на платиновом аноде необратимо, поэтому и этот прием также непригоден.
В связи с этим было решено определить числа электронов, участвующих в электроокислении одной молекулы винилморфолина (ВМ) ивинилпиридина (ВП) в неводных растворах в присутствии различных фоновых электролитов кулонометрическим методом [3]. Как известно, число электронов рассчитывают непосредственно по формуле Фарадея:
![]()
где Q-количество электричества, затраченного на электродную реакцию, Кл; M-молярная масса определяемого компонента, г/моль; Р-масса определяемого компонента, г; F- константа Фарадея, равная 96500 Кл; n-число электронов, участвующих в электрохимической реакции.
Массу электроокисленного реагента находили по разности между взятым и оставшимся его количеством после проведении исследования, пользуясь формулой:
![]()
где С0-концентрация реагента во взятом растворе, (моль/л); V0- объем раствора реагента в электролизере (мл); Ck–концентрация реагента в растворе, полученном при количественном перенесение его из электролизера (после проведения исследования) в мерную колбу и разбавлении раствора титранта водой до метки (моль/л); Vk –объем этого раствора, (мл).
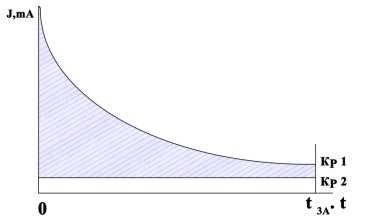
Рис. Потенциостатическое определение числа электронов: Кр 1- кривая электролиза реагента; Кр 2 — кривая электролиза фонового электролита
Количество электричества находили графическим интегрированием значений тока, исправленных на ток фона, в пределах от нуля до конца времени проведения электролиза, т. е. путем определения площади фигуры, ограниченной между кривыми зависимости величины тока от времени при проведении электролиза раствора реагента (кривая 1 на рис.) и электролиза фона (кривая 2 на рис.) и ординатами t=0 иt=tэл где tэл — время проведения электролиза (на рис это площадь заштрихована). Обозначая площадь указанной фигуры через S1 (мм2), масштабы для величин тока и времени, выраженные в мА/мм и с/мм, соответственно через “a” и “b” для вычисления количества затраченного электричества, то получим формулу:
Q=S1·a·b
в которойQ-выражается мКл. Поставляя выражение для Р и Q в общее уравнение получим окончательную формулу для определения числа электронов:![]()
Значения S1,a, b, С0, V0, Ck, Vk и найденные по ним числа электронов исследованных реагентов представлены в таблице.
Было установлено, что при электроокислении этилендиаминтетроацетата (ЭДТА) на платиновом дисковом микроаноде на различных по кислотно-основным свойствам фоновых электролитах и изученных протолитических средах число электронодонорства близко к четырем, что согласуется с данными [4]. Для ВМ и ВП оно равно двум. Эксперименты показали, что в отличие от изученных реагентов число электронов, отдаваемых при электроокислении диэтилдитиокарбаминат натрия (ДДТКNa) на платиновом дисковом микроаноде близко к единице. Поскольку число электронодонорства исследованных реагентов на различных по природе фоновых электролитах и во всех протолитических средах неодинаково, то для получения полной информации в таблице приведены данные, обнаруженные во всех исследованных фонах только в безводной уксусной кислоте.
Таблица
Результаты определения числа электронов, принимающих участие вокислении одной молекулы ЭДТА, ВМ, ВП иДДТКNa вуксусной кислоте на платиновом микродисковом аноде вприсутствии различных по природе фоновых электролитов (V0 =80 мл, Vk=250 мл, a=12,5 с/мм, b=0,047мА /мм)
|
Природа иконц. фона, |
Реагент |
S1, мм2 |
С0, моль/л |
Ckмоль/л |
n |
|
0,25 СН3СООК |
ЭДТА |
21991 |
0,8047 |
0,7702 |
3,99 |
|
0,15 LiNO3 |
13576 |
0,4247 |
0,4028 |
3,91 | |
|
0,20LiClO4 |
5828 |
0,4318 |
0,4224 |
4,02 | |
|
0,25 СН3СООК |
ВМ |
1036 |
0,0935 |
0,0875 |
1,97 |
|
0,15 LiNO3 |
1176 |
0,1048 |
0,0931 |
2,01 | |
|
0,20LiClO4 |
1093 |
0,1126 |
0.0736 |
1.95 | |
|
0,25 СН3СООК |
ВП |
1034 |
0,0933 |
0,0874 |
1.98 |
|
0,15 LiNO3 |
1169 |
0,1123 |
0,0739 |
2.02 | |
|
0,20LiClO4 |
1088 |
0,1052 |
0,0933 |
1,92 | |
|
0,25 СН3СООК |
ДДТКNa |
9534 |
0.1662 |
0,1041 |
0.94 |
|
0,15 LiNO3 |
11384 |
0,1394 |
0,0691 |
0,97 | |
|
0,20LiClO4 |
11050 |
0,1543 |
0,0863 |
0,99 |
Установлено, что при электроокислении натриевых солей дитиокислот стадия анодного процесса сопровождается образованием димера. В частности, окисление ДДТКNa выражается уравнением:
![]()
![]()
![]()
![]()
![]()
![]() 2(C2H5)2N-C=S — 2e- → (C2H5)2N — C — S — S — C — N — (C2H5)2 + 2Na+
2(C2H5)2N-C=S — 2e- → (C2H5)2N — C — S — S — C — N — (C2H5)2 + 2Na+
S — NaS S
что согласуется с данными [5].
Для оптимизации условий амперометрического титрования ионов металлов наряду с остальными факторами, влияющими на форму кривых и результаты титрований, также необходимо было установление природы анодных токов окисления используемых титрантов.
![]()
![]()
Литература:
- Я.Гейровский, Я.Кута Основы полярографии. М.: Мир. — 1965. — 559 с.
- А. И. Фрумкин Электрохимические процессы с участием органических веществ. М.: Наука. — 1970. — 195 с.
- В. Г. Левич Физико-химическая гидродинамика. М.: Изд.АН СССР.-1952. -392 с.
- М.Дж.Аллен Электродные процессы в органической химии. Л.: Госхимиздат. -1961. — 289 с.
- Б. Б. Дамаскин, О. А. Петрий Введение в электрохимическую кинетику. М.: Высшая школа. 1983. -399 с.

