Инфекция Helicobacter pylori (НР) считается важнейшим этиопатогенетическим звеном развития хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы и некардиального рака желудка [7, 15, 5, 12, 19].
За последние годы эффективность стандартной тройной схемы эрадикационной терапии первой линии в силу различных причин прогрессивно снижается и уже давно не превышает рекомендованного Маастрихтским соглашением 80 % уровня [14, 5, 6].
Одним из наиболее эффективных (15–20 %) и доступных способов оптимизации лечения инфекции НР является включение висмута трикалия дицитрата в состав схем эрадикационной терапии [6, 4, 15, 5]. Кроме того, Киотский консенсус по хроническому НР-ассоциированному гастриту (Киото, февраль 2014) постулирует необходимость расширенного применения эрадикационной терапии с «усиленной надежностью»: добавление препаратов висмута, схемы с удвоенной дозой ИПП и преимущественное использование ИПП второго поколения [13]. Способности солей висмута обеспечивать защиту СОЖ известны с клинических позиций [4, 7]. В соответствии с рекомендациями Российской Гастроэнтерологической Ассоциации после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута до 4–8 недель для обеспечения защиты СОЖ [4]. Последнее требует проведения исследований, позволяющих обеспечить дифференцированный подход к ведению больных хроническим НР-ассоциированным гастритом.
При хроническом HР-ассоциированном гастрите повреждение эпителия слизистой оболочки желудка (СОЖ) может быть индуцировано самой бактерией, продуктами ее жизнедеятельности и клетками воспалительного инфильтрата СОЖ, прежде всего, — нейтрофильными лейкоцитами, индуцирующими процессы перекисного окисления липидов на мембране эпителиальной клетки продуктами происходящего в них «кислородного взрыва». Свободные радикалы способны приводить к двунитевым разрывам ДНК, ассоциированным в том числе с возникновением нелетальных мутаций генома и индукцией опухолевого роста [11].
Существует представление о цитопротективных свойствах солей висмута, при этом непосредственный механизм действия ионов висмута на желудочный эпителий изучен только в культуре клеток (Кононов А. В., 2006). 15 лет назад появились работы, в которых в культуре клеток был обнаружен феномен связывания ионами висмута свободных радикалов — торможения перекисного окисления липидов на мембранах эпителиальных клеток [9; 18]. Примечательно, что клинических оценок именно этого эффекта препаратов на основе висмута нет, и назначение препаратов висмута (в том числе и в составе схем эрадикационной терапии) основано, прежде всего, на доказанной антибактериальной активности висмута трикалия дицитрата [15, 5], что обосновывает необходимость дальнейшего изучения клеточных «мишеней» цитопротективных свойств препарата висмута.
Цель исследования
Обосновать клинико-морфологические критерии эффективности продолженной терапии висмута трикалия дицитратом при хроническом НР-ассоциированном гастрите с синдромом диспепсии для дифференцированного подхода ведения больных.
Материалы и методы исследования
Исследование проводилось на базе БУЗ ОО «Городская клиническая больница № 1 имени Кабанова А. Н».. В исследовании принимало участие 62 пациента с хроническим НР-ассоциированным гастритом с синдромом диспепсии, средний возраст которых составил 46,4±15,9 года, среди них 32 (51,6 %) женщины и 30 (48,4 %) мужчин.
Критерии включения: мужчины и женщины в возрасте от 20 до 65 лет;наличие клинических симптомов диспепсии, которые явились поводом назначения фиброэзофагогастродуоденоскопии (ФЭГДС) с биопсией СОЖ; морфологически верифицированный диагноз хронического гастрита; наличие HР, подтвержденное быстрым уреазным «Хелпил»-тестом, гистобактериоскопическим исследованием гастробиоптатов и иммуногистохимическим методом (поликлональные антитела к HР);отсутствие острых или обострения хронических воспалительных заболеваний на момент начала исследования; информированное согласие пациента на участие в исследовании.
Критерии исключения: возраст моложе 20 лет и старше 65 лет; прием в течение 4 недель до включения в исследование ИПП/антибактериальных препаратов; развитие побочных эффектов на фоне лечения; аллергические реакции в анамнезе на препараты, входящие в состав эрадикационной терапии; низкая комплаентность (нарушение режима лечения и/или отказ от эндоскопического контроля после проведенной терапии); обострение хронических или появление острых воспалительных заболеваний на момент включения в исследование; синдром раздраженного кишечника, сахарный диабет, злокачественные новообразования; тяжелая почечная, печеночная, сердечная и дыхательная недостаточность; прием лекарственных препаратов, способных повлиять на результаты исследования (нестероидные противовоспалительные препараты, глюкокортикостероиды, цитостатики);отказ пациентов от участия в исследовании.
Для количественной оценки выраженности жалоб со стороны желудочно-кишечного тракта на фоне лечения у больных хроническим НР-ассоциированным гастритом с синдромом диспепсии использован опросник SODA — SeverityOfDyspepsiaAssessment [10, 16].
В соответствии с рекомендациями Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции НР у взрослых и Европейскими рекомендациями — Маастрихт IV [4, 15, 7] при хроническом НР-ассоциированном гастрите назначалась схема эрадикационной терапии первой линии, включающая Омепразол 20 мг 2 раза в день за 30 минут до еды, Амоксициллин 1000 мг 2 раза в день и Кларитромицин 500 мг 2 раза в день в течение 10 дней.
Пациенты методом «лотерейной» рандомизации были разделены на две группы:
группа с продолженной терапией препаратом висмута (1 группа) — пациенты, которые кроме эрадикационной терапии первой линии, продолжали лечение препаратом висмута (Де-Нол) в дозе 120 мг по 2 табл. 2 раза в день за 30 минут до еды до 4-х недель — 28 (45,2 %) пациентов;
группа сравнения (2 группа) — пациенты, которым назначалась только схема эрадикационной терапии первой линии в течение 10 дней — 34 (54,8 %) пациента.
Расчет минимального числа пациентов в выборке производился исходя из нескольких переменных интереса. Переменной интереса проводимого исследования, отражающей клинические параметры исследуемой группы и группы сравнения, являлся уровень снижения интенсивности болевого синдрома, оцененного по шкале SODA.
Основной показатель результата для определения объема выборки — лечение считается более эффективнымпри наличии разницы в 35 % (0,35 от 1) между средним баллом снижения выраженности оцененной по шкале SODA интенсивности болевого синдрома у пациентов исследуемой группы (группа с продолженной терапией препаратом висмута) и в группе сравнения после проведения эрадикационной терапии. При этом в группе, имеющей менее успешное лечение, аналогичный показатель был принят за 10 % (0,1 от 1). Вопрос относительно объема выборки — сколько требуется пациентов, чтобы иметь 80 % мощность обнаружения клинически важной разницы в величине успеха в 35 % между двумя группами при 5 % уровне значимости и величине успеха в 10 % в группе менее успешного лечения.
Ниже приведен расчет стандартизованной разности при приведении значений в долях от единицы:
p2 — p1= 35 %, p1= 10 %, тогда p2=35 % + 10 %=45 %, так что
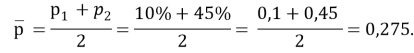
Поэтому стандартизованная разность равна
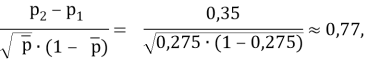
где р1 — значение переменной интереса в группе с ожидаемым меньшим значением показателя успешного лечения; р2 — значение переменной интереса в группе с ожидаемым большим значением того же показателя; p2-p1 — наименьшая разность в долях (пропорциях) успеха в двух группах, которая клинически важна.
По номограмме Альтмана [Altman D. G., 1983] линия, соединяющая значение стандартизованной разности 0,77 и мощности 80 % пересекают ось объема выборки в точке со значением 54 при уровне значимости 0,05, указывая на N/2 наблюдений (27) в каждой из сравниваемых групп. Таким образом, необходимо минимальное наличие 27 пациентов в каждой из сравниваемых групп, чтобы иметь 80 %-й шанс обнаружения значимой разницы при 5 %-м уровне значимости.
Переменной интереса проводимого исследования, отражающей морфологические параметры исследуемой группы и группы сравнения, являлся уровень снижения индекса метки Р53 (маркер повреждения ДНК) в гастробиоптатах пациентов после проведения эрадикационной терапии.
Основной показатель результата для определения объема выборки — лечение считается более эффективным при наличии разницы в 30 % (0,3 от 1) между средним индексом снижения метки Р53 у пациентов исследуемой группы (группа с продолженной терапией препаратом висмута) и в группе сравнения после проведения эрадикационной терапии. При этом в группе, имеющей менее успешное лечение, аналогичный показатель был принят за 1 % (0,01 от 1).
Вопрос относительно объема выборки — сколько требуется пациентов, чтобы иметь 80 % мощность обнаружения клинически важной разницы в величине успеха в 30 % между двумя группами при 5 % уровне значимости и величине успеха в 1 % в группе менее успешного лечения.
Ниже приведен расчет стандартизованной разности при приведении значений в долях от единицы:
p2 — p1= 30 %, p1= 1 %, тогда p2=35 % + 1 %=36 %, так что
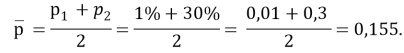
Поэтому стандартизованная разность равна
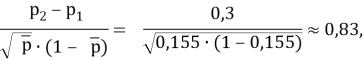
где р1 — значение переменной интереса в группе с ожидаемым меньшим значением показателя успешного лечения; р2 — значение переменной интереса в группе с ожидаемым большим значением того же показателя; p2-p1 — наименьшая разность в долях (пропорциях) успеха в двух группах, которая клинически важна.
По номограмме Альтмана [Altman D. G., 1983] линия, соединяющая значение стандартизованной разности 0,83 и мощности 80 % пересекают ось объема выборки в точке со значением 48 при уровне значимости 0,05, указывая на N/2 наблюдений (24) в каждой из сравниваемых групп. Таким образом, необходимо минимальное наличие 24 пациентов в каждой из сравниваемых групп, чтобы иметь 80 %-й шанс обнаружения значимой разницы при 5 %-м уровне значимости.
Следующим этапом расчета выборки являлась необходимость корректировки минимального числа исследуемых пациентов исходя из ожидаемой возможности последующих потерь, например, неудачи эрадикации. Для расчета была взята наибольшая величина из двух ранее рассчитанных — 27 пациентов. Предполагаемый уровень потерь (r %) был определен исходя из среднего значения частоты успеха эрадикационной терапии в 80 % и, соответственно составил величину 20 %. Скорректированный объем выборки был получен путем умножения нескорректированного объема (27) на величину 100/(100-r), т. е. 1,25. Таким образом скорректированным объем выборки составил 34 пациента.
До и через 4 недели после окончания лечения проводилось эндоскопическое исследование: ФЭГДС с биопсией СОЖ из пяти точек согласно современному подходу — модифицированному варианту OLGA system — Российскому пересмотру классификации хронического гастрита, который был утвержден III Съездом Российского общества патологоанатомов [17, 1].
Полученные при биопсии фрагменты (1–5) СОЖ (2 — из тела, 2 — из антрального отдела желудка, 1 — из угла желудка) фиксировали в 10 %-ном нейтральном забуференном формалине (рН 7,2–7,4) в течение 12 часов и заливали в парафин по общепринятой методике. Наличие HР-колонизации СОЖ проводили до и через 4 недели после окончания лечения гистобактериоскопически (окраска 0,1 % толуидиновым синим), с использованием иммуногистохимического метода (поликлональные антитела к HР, SpringBioscience, США) и быстрого уреазного «Хелпил»-теста (ООО «AMA», Санкт-Петербург).
Иммуногистохимическое исследование выполняли на кафедре патологической анатомии ГБОУ ВПО «ОмГМУ» Минздрава России (зав. кафедрой, заслуженный деятель науки РФ, д.м.н., профессор А. В. Кононов) на парафиновых срезах. В качестве маркера повреждения ДНК эпителиальной клетки СОЖ использовали мышиные моноклональные антитела к Р53 (клон DO-7, DAKO, Дания). Оценивали индекс метки Р53 путем оценки доли (в процентах) положительно окрашенных Р53-позитивных ядер эпителиоцитов СОЖ в 10-ти случайно выбранных полях зрения (≥1000 клеток) в генеративном компартменте — зоне перешейка желез, которую маркировали путем детекции гладкомышечного актина (SMA, клон 1А4 DAKO, Дания) в миофибробластах, ассоциированных с генеративной зоной СОЖ.
В процессе статистической обработки данных применены методы описательной статистики и графического анализа данных [8, 2, 3]. Характер распределения величин определен визуально и методом Шапиро-Уилка. В связи с тем, что распределение большинства изучаемых параметров отличалось от нормального, полученные данные представлены в виде медианы и верхнего и нижнего квартиля — Ме (Р25; Р75). Для расчета достоверности различий между счетными признаками использовали непараметрические критерии: для сравнения двух независимых групп — критерий Манна-Уитни (z), для сравнения двух связанных групп — критерий Вилкоксона (Z). Причинно-следственные связи определялись в ходе корреляционного анализа Спирмена (rs). Расчеты и графический анализ данных проводился на базе пакетов прикладных программ Microsoft Excel 7 и STATISTICA 6.0 (русифицированная версия). Значимость результатов выражалась в виде р=0,000… Результаты считались значимыми при р<0,05.
Результаты исследования и их обсуждение
Оценка клинических симптомов синдрома диспепсии при хроническом НР-ассоциированном гастрите
На момент включения в исследование все пациенты с хроническим НР-ассоциированным гастритом имели клинические симптомы, характерные для синдрома диспепсии. При анализе результатов опросника SODA до лечения было установлено, что у пациентов с хроническим НР-ассоциированным гастритом с синдромом диспепсии в обеих группах имели место как болевые, так и неболевые признаки диспепсии. Проявления диспепсии в группе с продолженной терапией препаратом висмута и в группе сравнения в начале наблюдения оказались сопоставимы по всем шкалам опросника SODA: шкала «Болевые признаки» диспепсии (р=0,754) и шкала «Неболевые признаки» диспепсии (р=0,525). Установлено, что до лечения, по данным опросника SODA, в группе с продолженной терапией препаратом висмута и в группе сравнения отмечалось более высокое значение показателей шкалы «Болевые признаки» диспепсии (в группе с продолженной терапией препаратом висмута 37,0 (24,0; 41,0) баллов, а в группе сравнения — 35,0 (21,0; 41,0) баллов) в сравнении с показателями шкалы «Неболевые признаки» диспепсии (в группе с продолженной терапией препаратом висмута 13,0 (10,0; 16,0) баллов и в группе сравнения 14,0 (12,0; 17,0) баллов). Преобладание болевых признаков диспепсии и наличие неболевых признаков диспепсии у пациентов с хроническим НР-ассоциированным гастритом с синдромом диспепсии в обеих группах закономерно привело к низкому уровню показателя «Удовлетворенности лечением диспепсии» по данным опросника SODA.
Морфологическая характеристика хронического НР-ассоциированного гастрита по Модифицированному варианту OLGA-system
В группе с продолженной терапией препаратом висмута было 28 (45,2 %) пациентов, женщин — 17, мужчин — 11. Средний возраст составил 49,4612,3 лет. В группу сравнения вошло 34 (54,8 %) пациента, женщин — 15, мужчин — 19. Средний возраст составил 42,4715,5 лет.
При исследовании гастробиоптатов в зависимости от основных морфологических вариантов хронического гастрита в группе с продолженной терапией препаратом висмута были выявлены следующие данные: поверхностный гастрит — у 6 (21,4 %) пациентов, атрофический гастрит — у 22 (78,6 %) пациентов, а в группе сравнения: поверхностный гастрит — у 8 (23,5 %) пациентов, атрофический гастрит — у 26 (76,5 %) пациентов.
Морфологические признаки воспаления при хроническом НР-ассоциированном гастрите до лечения, определяемые поМодифицированной Сиднейской классификации и Российскому пересмотру Международной классификации хронического гастрита OLGA-system, представлены в табл. 1, где в ячейках отражено абсолютное количество случаев наблюдения с наличием определенной степени выраженности признака в антральном отделе, в угле и теле желудка.
Таблица 1
Морфологические признаки воспаления при хроническом НР-ассоциированном гастрите до лечения в антральном отделе, угле и теле желудка (абсолютные значения)
|
Степень выраженности признака |
Антральный отдел желудка | |||||
|
Малая кривизна |
Большая кривизна | |||||
|
Степень воспаления |
Активность воспаления |
НР |
Степень воспаления |
Активность воспаления |
НР | |
|
Отсутствует (0) |
0 |
16 |
0 |
0 |
16 |
10 |
|
Слабая (1) |
9 |
40 |
37 |
7 |
37 |
36 |
|
Умеренная (2) |
52 |
5 |
21 |
54 |
8 |
13 |
|
Выраженная (3) |
1 |
1 |
0 |
1 |
1 |
3 |
|
|
Угол желудка | |||||
|
Степень воспаления |
Активность воспаления |
НР | ||||
|
Отсутствует (0) |
1 |
20 |
8 | |||
|
Слабая (1) |
10 |
39 |
28 | |||
|
Умеренная (2) |
49 |
3 |
25 | |||
|
Выраженная (3) |
2 |
0 |
1 | |||
|
|
Тело желудка | |||||
|
Малая кривизна |
Большая кривизна | |||||
|
Степень воспаления |
Активность воспаления |
НР |
Степень воспаления |
Активность воспаления |
НР | |
|
Отсутствует (0) |
1 |
23 |
9 |
1 |
22 |
13 |
|
Слабая (1) |
26 |
32 |
34 |
34 |
34 |
31 |
|
Умеренная (2) |
33 |
6 |
18 |
25 |
5 |
17 |
|
Выраженная (3) |
2 |
1 |
1 |
2 |
1 |
1 |
При поверхностном гастрите железы сохраняли нормальное строение и гистохимические свойства. Выявленное в нескольких биоптатах разрушение желез было обусловлено высоким уровнем инфильтрации нейтрофильными лейкоцитами, а также картинами лейкодиапедеза. Поверхностный эпителий характеризовался как высокий цилиндрический, ядра округлой формы располагались в базальной части клетки. Главные и париетальные клетки сохраняли свое строение и гистохимические характеристики.
Выраженность нейтрофильной инфильтрации собственной пластинки СОЖ, отражая активность воспаления, определяла подразделение его на степени. При первой степени имелась умеренная лейкоцитарная инфильтрация собственной пластинки СОЖ; при второй степени происходила инфильтрация поверхностного и ямочного эпителия с усилением лейкодиапедеза и поступлением воспалительных клеток в просвет желудка. При третьей степени гастрита наряду с выраженной инфильтрацией собственной пластинки и эпителиального пласта встречались так называемые «внутриямочные абсцессы». Образование их связано с массивным лейкодиапедезом сквозь толщу эпителия в просвет ямок, а также сопровождалось массивным разрушением эпителиального пласта, в том числе в области генеративной зоны — перешейка желез.
По интенсивности мононуклеарной инфильтрации (степень воспаления) можно было определить слабые, умеренные и выраженные воспалительные изменения СОЖ. При этом наряду с нарастанием плотности инфильтрата, вплоть до формирования скоплений, раздвигающих железы, отмечалось распространение его вглубь СОЖ, вплоть до базальных отделов. Скопления лимфоцитов в собственной пластинке СОЖ были разнообразны по объему, плотности клеток, строению и глубине залегания. При минимальном объеме наблюдалось образование небольших групп лимфоцитов в базальных отделах СОЖ. Увеличение объема мононуклеарного воспалительного инфильтрата в собственной пластинке слизистой оболочки происходило за счет формирования фолликулов. Они представляли собой узелки овальной или круглой формы, состоявшие из плотно прилегающих друг к другу лимфоцитов.
Уровень колонизации НР слизистой оболочки прямо коррелировал с показателями активности и степени воспаления. Причем для антрального отдела желудка была обнаружена средняя прямая корреляционная связь между степенью НР-колонизации и активностью воспаления как по малой (rs=0,60; р<0,05), так и по большой кривизне (rs=0,55; р<0,05), и аналогичная связь между показателем НР-колонизации и степенью воспаления как по малой (rs=0,58; р<0,05), так и по большой кривизне (rs=0,57; р<0,05).
Уровень колонизации НР слизистой оболочки в угле желудка прямо коррелировал с показателями активности (средняя корреляционная связь — rs=0,55; р<0,05) и степени воспаления (средняя корреляционная связь — rs=0,52; р<0,05).
Уровень колонизации НР слизистой оболочки в теле желудка также прямо коррелировал с показателями активности (средняя корреляционная связь по малой кривизне (rs=0,51; р<0,05), умеренная корреляционная связь по большой кривизне (rs=0,45; р<0,05)) и степени воспаления (средняя корреляционная связь по малой кривизне (rs=0,54; р<0,05) и умеренная корреляционная связь по большой кривизне (rs=0,34; р<0,05)).
При оценке одного из интегральных показателей хронического гастрита (степени) по Модифицированному варианту OLGA-system — Российскому пересмотру классификации хронического гастрита были получены следующие результаты: слабая (I) степень суммарно нейтрофильной и лимфоплазмоцитарной инфильтрации в биоптатах слизистой оболочки из антрального отдела (3 биоптата) и тела желудка (2 биоптата) встречается в 4,9 % случаев, умеренная (II) степень воспаления — в 41 % случаев, а у 44,3 % больных отмечается выраженная (III) степень воспаления СОЖ. При этом у 9,8 % пациентов во всех биоптатах СОЖ была выявлена резко выраженная (IV) инфильтрация нейтрофильными лейкоцитами.
Таким образом, у пациентов с хроническим НР-ассоциированным гастритом преобладали умеренная и выраженная степень воспаления СОЖ (85,3 %). Кроме того, следует обратить внимание на тот факт, что у 10 % пациентов выявлена тяжелая степень воспаления СОЖ вследствие наличия во всех гастробиоптатах большого количества нейтрофильных лейкоцитов, инфильтрирующих собственную пластинку слизистой оболочки и располагающихся интраэпителиально. Это сопровождается высоким уровнем продукции реактивных форм кислорода (оксидативный стресс), активирующих перекисное окисление липидов. Но существует и скрытая угроза, так как оксидативный стресс, оказывающий достаточно длительное воздействие (персистенция НР — персистенция инфильтрации нейтрофильными лейкоцитами), приводит к повреждению продуктами «кислородного взрыва» ДНК эпителиальных клеток генеративных зон СОЖ. Следствием этого повреждения является клональная альтерация гена, то есть возникает «стартовая площадка» опухолевого роста.
При сопоставлении степени инфильтрации нейтрофильными лейкоцитами собственной пластинки СОЖ (активности воспаления) по Модифицированной Сиднейской системе в каждой точке забора биопсийного материала (1–5) между группой с продолженной терапией препаратом висмута и группой сравнения достоверных отличий выявлено не было, что наглядно представлено на рис. 1.
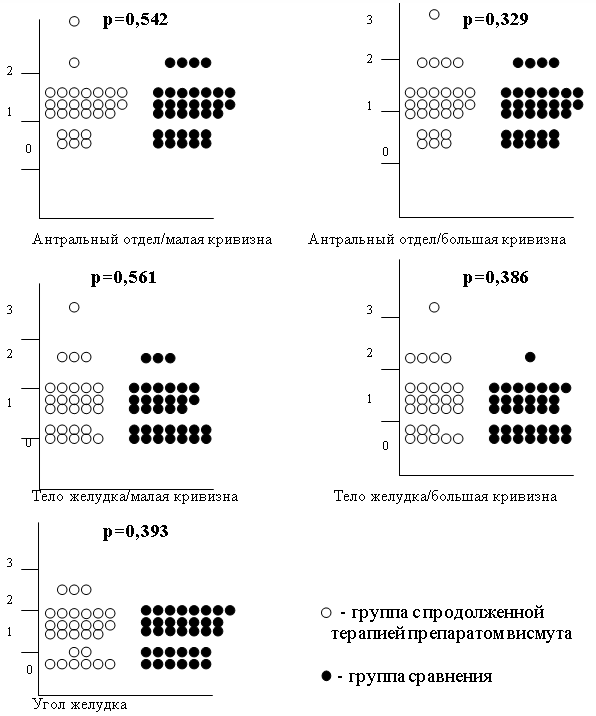
Рис. 1. Сопоставление активности воспаления в каждой точке забора биопсийного материала (1-5) между группой с продолженной терапией препаратом висмута и группой сравнения
При сопоставлении степени мононуклеарной воспалительной инфильтрациисобственной пластинки СОЖ (степени воспаления) по Модифицированной Сиднейской системе в каждой точке забора биопсийного материала (1–5) между группой с продолженной терапией препаратом висмута и группой сравнения также достоверных отличий выявлено не было, что наглядно представлено на рис. 2.
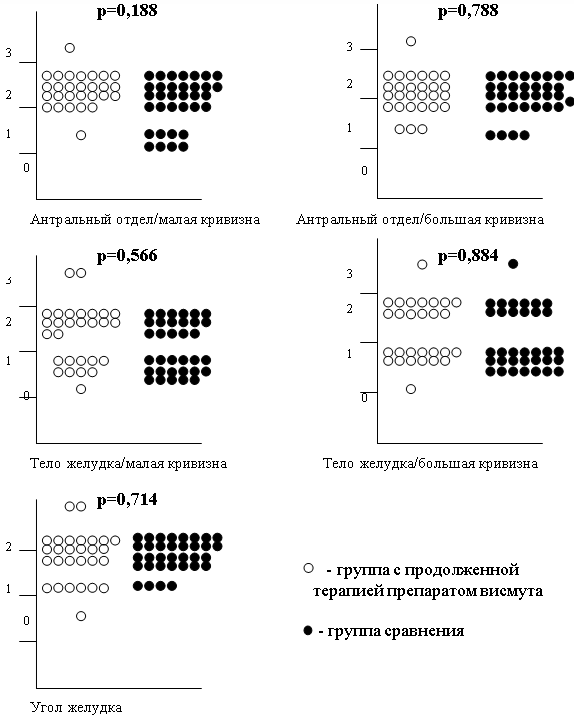
Рис. 2. Сопоставление степени воспаления в каждой точке забора биопсийного материала (1-5) между группой с продолженной терапией препаратом висмута и группой сравнения
Динамика клинических симптомов синдрома диспепсии при хроническом
HР-ассоциированном гастрите на фоне разных схем лечения
На фоне лечения у больных хроническим гастритом с синдромом диспепсии, по данным опросника SODA, в обеих группах интенсивность болевых и неболевых симптомов диспепсии уменьшалась, что сопровождалось повышением уровня удовлетворенности больных лечением диспепсии.
Однако, интенсивность болевых симптомов диспепсии через 4 недели после окончания лечения в группе с продолженной терапией препаратом висмута уменьшилась с 37,0 (24,0; 41,0) до 33,0 (25,0; 35,0) баллов (различия статистически значимы Z=3,07; р=0,002), тогда как в группе сравнения этот показатель уменьшился лишь с 35,0 (21,0; 41,0) до 34,0 (28,0; 38,0) баллов (различия статистически незначимы Z=1,68; р=0,093), что наглядно представлено на рис. 3.
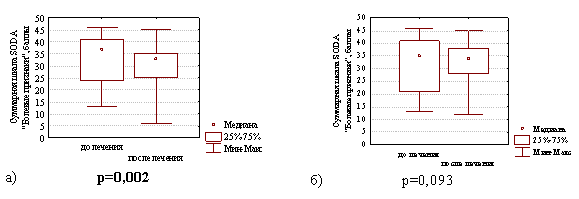
Рис. 3. Суммарная шкала баллов по опроснику SODA «Болевые признаки» диспепсии в группе с продолженной терапией препаратом висмута (а) и в группе сравнения (б) на фоне лечения
Интенсивность неболевых симптомов диспепсии через 4 недели после окончания лечения в группе с продолженной терапией препаратом висмута уменьшилась с 13,0 (10,0; 16,0) до 12,0 (9,0; 15,0) баллов (различия статистически незначимы Z=1,75; р=0,079) и в группе сравнения этот показатель уменьшился с 14,0 (12,0; 17,0) до 13,0 (11,0; 15,0) баллов (различия статистически незначимы Z=1,11; р=0,267), что наглядно представлено на рис. 4.
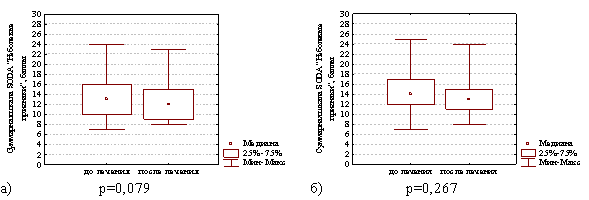
Рис. 4. Суммарная шкала баллов по опроснику SODA «Неболевые признаки» диспепсии в группе с продолженной терапией препаратом висмута (а) и в группе сравнения (б) на фоне лечения
Через 4 недели после окончания лечения в группе с продолженной терапией препаратом висмута уровень удовлетворенности больных лечением диспепсии увеличился с 7,0 (5,0; 10,0) до 9,0 (6,0; 11,0) баллов (различия статистически значимы Z=3,01; р=0,003) и в группе сравнения этот показатель увеличился с 7,0 (4,0; 9,0) до 8,0 (5,0; 10,0) баллов (но различия статистически незначимы Z=1,73; р=0,084). Таким образом, установлено, что удовлетворенность больных проводимым лечением диспепсии была достоверно выше у больных из группы с продолженной терапией препаратом висмута по сравнению с больными из группы сравнения (рис. 5).
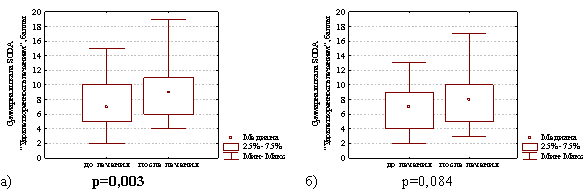
Рис. 5. Суммарная шкала баллов по опроснику SODA «Удовлетворенность лечением диспепсии в группе с продолженной терапией препаратом висмута (а) и в группе сравнения (б) на фоне лечения
Морфологическая характеристика слизистой оболочки желудка при хроническом HР-ассоциированном гастрите на фоне разных схем лечения
Через 4 недели после успешной эрадикации НР в обеих группах имело место снижение таких морфологических показателей хронического гастрита как активность и степень воспаления. Продолженная терапия висмута трикалия дицитратом оказала наиболее благоприятный эффект на выраженность и активность воспаления в антральном отделе желудка. Уже на ранних стадиях постэрадикационного периода (через 4 недели после эрадикации НР) в группе с продолженной терапией препаратом висмута отмечено значительное снижение плотности мононуклеарной воспалительной инфильтрации собственной пластинки СОЖ. Полученный результат свидетельствует о том, что продолженная терапия висмута трикалия дицитратом (табл. 2) статистически значимо снижает не только активность (р=0,0002 — малая кривизна; р=0,0001 — большая кривизна), но и степень воспаления (р=0,016 — малая кривизна; р=0,033 — большая кривизна) в антральном отделе желудка, что позволяет достичь редукции воспалительных изменений СОЖ и замедлить прогрессирование гастрита.
Таблица 2
Динамика морфологических признаков воспаления при хроническом гастрите в группе с продолженной терапией препаратом висмута на фоне лечения (абсолютные значения)
|
Степень выраженности признака |
Антральный отдел желудка до/через 4 недели после лечения | |||
|
Малая кривизна |
Большая кривизна | |||
|
Степень воспаления |
Активность воспаления |
Степень воспаления |
Активность воспаления | |
|
Отсутствует (0) |
0/0 |
6/25 |
0/0 |
6/24 |
|
Слабая (1) |
1/9 |
20/3 |
3/12 |
17/4 |
|
Умеренная (2) |
26/19 |
1/0 |
24/16 |
4/0 |
|
Выраженная (3) |
1/0 |
1/0 |
1/0 |
1/0 |
|
|
Угол желудка До/через 4 недели после лечения | |||
|
Степень воспаления |
Активность воспаления | |||
|
Отсутствует (0) |
1/0 |
8/21 | ||
|
Слабая (1) |
6/11 |
17/6 | ||
|
Умеренная (2) |
19/17 |
3/1 | ||
|
Выраженная (3) |
2/0 |
0/0 | ||
|
|
Тело желудка До/через 4 недели после лечения | |||
|
Малая кривизна |
Большая кривизна | |||
|
Степень воспаления |
Активность воспаления |
Степень воспаления |
Активность воспаления | |
|
Отсутствует (0) |
1/0 |
9/26 |
1/1 |
8/26 |
|
Слабая (1) |
9/20 |
15/2 |
13/21 |
15/2 |
|
Умеренная (2) |
16/8 |
3/0 |
13/6 |
4/0 |
|
Выраженная (3) |
2/0 |
1/0 |
1/0 |
1/0 |
В группе сравнения (табл. 3) через 4 недели после лечения также отмечалась тенденция к уменьшению активности и выраженности воспаления в СОЖ. Однако, в группе сравнения было отмечено снижение, прежде всего, активности гастрита (антральный отдел желудка: р=0,019 — малая кривизна, р=0,008 — большая кривизна) при достоверно более низких темпах редукции мононуклеарной воспалительной инфильтрации (антральный отдел желудка: р=0,208 — малая кривизна, р=0,078 — большая кривизна), чем в группе с продолженной терапией препаратом висмута. Это свидетельствует о персистенции воспалительного инфильтрата в условиях элиминации инфекта и, следовательно, о сохранении риска опосредованного через цитокины повреждения СОЖ, что служит фактором риска развития рака желудка.
Таблица 3
Динамика морфологических признаков воспаления при хроническом гастрите в группе сравнения на фоне лечения (абсолютные значения)
|
Степень выраженности признака |
Антральный отдел желудка До/через 4 недели после лечения | |||
|
Малая кривизна |
Большая кривизна | |||
|
Степень воспаления |
Активность воспаления |
Степень воспаления |
Активность воспаления | |
|
Отсутствует (0) |
0/0 |
10/32 |
0/0 |
10/33 |
|
Слабая (1) |
8/12 |
20/2 |
4/12 |
20/1 |
|
Умеренная (2) |
26/22 |
4/0 |
30/22 |
4/0 |
|
Выраженная (3) |
0/0 |
0/0 |
0/0 |
0/0 |
|
|
Угол желудка До/через 4 недели после лечения | |||
|
Степень воспаления |
Активность воспаления | |||
|
Отсутствует (0) |
0/0 |
12/32 | ||
|
Слабая (1) |
4/11 |
22/2 | ||
|
Умеренная (2) |
30/23 |
0/0 | ||
|
Выраженная (3) |
0/0 |
0/0 | ||
|
|
Тело желудка До/через 4 недели после лечения | |||
|
Малая кривизна |
Большая кривизна | |||
|
Степень воспаления |
Активность воспаления |
Степень воспаления |
Активность воспаления | |
|
Отсутствует (0) |
0/4 |
14/32 |
0/0 |
14/33 |
|
Слабая (1) |
17/21 |
17/2 |
21/26 |
19/1 |
|
Умеренная (2) |
17/9 |
3/0 |
12/8 |
1/0 |
|
Выраженная (3) |
0/0 |
0/0 |
1/0 |
0/0 |
Оценка цитопротективного эффекта препарата висмута трикалия дицитрата в генеративной зоне слизистой оболочки желудка при эрадикации HР и продолженном (4 недели) приеме препарата
Для идентификации клеточной «мишени» цитопротективного эффекта препарата висмута необходимо было выявить клетки генеративного компартмента СОЖ. В норме он расположен в области перешейка желез, но изменяет свои границы в фовеолярном направлении при воспалении, вызванном HР. Неопределенность границ пролиферативного компартмента увеличивается в результате большого количества тангенциальных срезов, полученных из нечетко ориентированных фрагментов СОЖ. Чтобы избежать произвольной трактовки границ генеративной зоны, в качестве маркера ее границ использовали определение миофибробластов, плотно прилежащих к базальной мембране исключительно генеративного эпителия. Для идентификации популяции миофибробластов применили иммуногистохимическое определение в них белка SMA — гладкомышечного актина. Получив таким образом границы пролиферативного компартмента желез на серийных срезах, в этих зонах оценивали количество клеток, экспрессирующих белок Р53 в разных группах до и через 4 недели после лечения. Чтобы исключить фактор неопределенности, обусловленный мозаичной топографией поражений СОЖ, были сопоставлены попарно показатели генеративных клеток, имеющих поврежденные ДНК, в каждой из 5 точек взятия материала до и через 4 недели после лечения в исследуемой группе и группе сравнения (рис. 6).
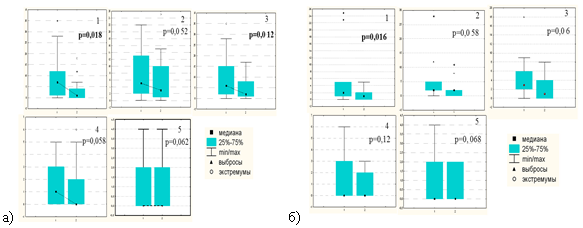
Рис. 6. Показатели повреждения ДНК (маркер Р53) в генеративном компартменте слизистой оболочки желудка до и через 4 недели после лечения в каждой точке (1–5) взятия биопсийного материала в группе с продолженной терапией препаратом висмута (а) и в группе сравнения (б)
Достоверное снижение экспрессии Р53 клетками генеративной зоны СОЖ в группе с продолженным приемом препарата висмута имели место в точках 1 и 3, при этом в точке 2 обнаруживалась тенденция к снижению индекса экспрессии Р53 при показателе р=0,052, близком к выбранному пороговому значению. В группе сравнения статистически значимые отличия со снижением экспрессии Р53 выявлены только в точке 1.
Такая ассоциация выявленных статистических различий именно в точках антрального отдела не удивительна. При сопоставлении показателей повреждения ДНК в антральном отделе (точки 1, 2, 3) и в теле желудка (точки 4, 5) оказалось, что в обеих группах в антральном отделе («стартовой площадке» HР-колонизации) индекс метки Р53 гораздо выше, чем в теле желудка. Собственно, кумулятивный показатель повреждения ДНК и определяется, главным образом, показателями экспрессии Р53 именно в антральном отделе желудка. Вполне допустимо предположить, что в этом же отделе желудка максимально проявляется и цитопротективный эффект препарата висмута (клеточная «мишень» терапии).
Таким образом, на основании проведенного исследования на уровне целостного организма удалось продемонстрировать эффект связывания свободных радикалов ионами висмута, то есть получить на тканевом уровне (in vivo) феномен цитопротекции, который до этого в работах [9, 18] был обнаружен исключительно в культуре эпителиальных клеток желудка (in vitro). Детекция поврежденной ДНК в клетках генеративной зоны СОЖ путем иммуногистохимического определения Р53-позитивных клеток позволяет установить достоверное снижение их числа в биоптатах СОЖ в группе с продолженной терапией препаратом висмута, что может быть интерпретировано как проявление эффекта защиты клеток генеративной зоны СОЖ — цитопротективная «мишень» препарата висмута.
Выводы:
- Клиническими и морфологическими критериями формирования потребности в продолженной терапии висмута трикалия дицитратом при хроническом НР-ассоциированном гастрите с синдромом диспепсии являются: боль в подложечной области, активность воспаления II-IIIи/или степень гастрита II-IV, повреждение ДНК в клетках генеративной зоны слизистой оболочки желудка.
- Продолженная терапия висмута трикалия дицитратом у больных хроническим НР-ассоциированным гастритом с синдромом диспепсии, по данным опросника SODA, статистически значимо снижает выраженность болевых симптомов диспепсии (Z=3,07; р=0,002), что приводит к повышению удовлетворенности больных проводимым лечением (Z=3,01; р=0,003) — клиническая «мишень» препарата висмута.
- При хроническом НР-ассоциированном гастрите продолженная терапия висмута трикалия дицитратом статистически значимо снижает не только активность (р<0,001), но и степень воспаления в антральном отделе желудка как по малой (р=0,016), так и по большой кривизне (р=0,033), что приводит к редукции воспалительных изменений слизистой оболочки желудка и замедлению прогрессирования гастрита — морфологическая «мишень» препарата висмута.
- Повреждение ДНК в эпителиоцитах генеративной зоны слизистой оболочки желудка носит вариабельный характер. В связи с этим оценка цитопротективного эффекта висмута трикалия дицитрата должна проводиться путем определения интегрального показателя — числа клеток с поврежденной ДНК, в первую очередь, в антральном отделе желудка.
- У больных хроническим НР-ассоциированным гастритом продолженная терапия висмута трикалия дицитратом приводит к статистически значимому снижению числа клеток с поврежденной ДНК в генеративной зоне слизистой оболочки антрального отдела желудка (малая кривизна р=0,018; большая кривизна р=0,052; угол желудка р=0,012), что может быть интерпретировано как проявление эффекта защиты этих клеток — цитопротективная «мишень» препарата висмута.
Литература:
- Аруин Л. И. Международнаяклассификацияхроническогогастрита: чтоследуетпринятьи чтовызываетсомнения / Л. И. Аруин,А. В. Кононов,С. И. Мозговой// Архив патологии. — 2009. — № 4. — С. 11–18.
- Гланц С. Медико-биологическая статистика: пер. с англ. / С. Гланц. — М.: Практика. — 1998. — 459 с.
- Гудинова Ж. В. Дружелюбная статистика: статистический анализ, прогнозирование: пошаговые инструкции: свидетельство № 72200800023 от 19.05.08 / Ж. В. Гудинова; ФГУП Всероссийский научно-технический информационный центр. — 2008–78 с.
- Ивашкин В. Т. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых / В. Т. Ивашкин, И. В. Маев, Т. Л. Лапина, А. А. Шептулин // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2012. — № 1. — С. 87–89.
- Кучерявый Ю. А. Лечение инфекции Helicobacterpylori в России: с какими трудностями сталкивается практикующий врач? / Ю. А. Кучерявый, Е. В. Баркалова // ConsiliumMedicum. Гастроэнтерология (Приложение). — 2013. — № 1. — С. 5–9.
- Маев И. В. Оценка эффективности включения препарата висмута в схемы лечения больных с инфекцией Helicobacterpylori в амбулаторных условиях / И. В. Маев, А. А. Самсонов, В. Б. Гречушников, Р. Г. Сайфутдинов, Д. Н. Андреев, Ю. А. Лежнева // Дневник казанской медицинской школы. — 2014. — № 2 (5). — С. 10–14.
- Маев И. В. Эволюция представлений о диагностике и лечении инфекции Helicobacterpylori (по материалам консенсуса Маастрихт IV, Флоренция, 2010) / И. В. Маев, А. А. Самсонов, Д. Н. Андреев, С. А. Кочетов // Вестник практического врача. — 2012. — Спецвыпуск № 1. — С. 23–30.
- Реброва О. Ю. Математический анализ медицинских данных. Применение пакета прикладных программ STATISTICA / О. Ю. Реброва. — М. — 2006. — 305 с.
- Bagchi D. Mechanism of gastroprotection by bismuth subsalicylate against chemically induced oxidative stress in cultured human gastrit mucosal cell / D. Bagchi, T. McGinn, X. Ye et al. // Digestive Diseases and Sciences. — 1999. — Vol. 44, № 12. — Р. 2419–2428.
- Goñi B. Validation of a modified version of SODA questionnaire (severity of dyspepsia assessment) adapted to Peru for evaluating evolution of symptoms severity in patients with dyspepsia / B. Goñi, C. Cabrejos, C. Bravo, P. Zarate, B. Ortiz, D. Senmache, P. Valdivia, H. Mercado, P. Rivera, B. Rivera, B. Paredes, Z. Chang // Rev Gastroenterol Peru. — 2013. — Vol. 33, № 1. — P. 9–27.
- Handa O. Redox biology and gastric carcinogenesis: the role of Helicobacter pylori / O. Handa, Y. Naito, T. Yoshikawa // Redox Report. — 2011. — Vol. 16, № 1 — P. 1–7.
- Lassen A. T. Acid-related disorders and use of antisecretory medication / A. T. Lassen // Dan Med Bull. — 2007. — Vol. 54, № 1. — P. 18–30.
- Lee S.-Y. Current progress toward eradicating Helicobacter pylori in East Asian countries: Differences in the 2013 revised guidelines between China, Japan, and South Korea/ S.-Y. Lee // World J. Gastroenterol. — 2014. — Vol. 20(6). — P. 1493–1502.
- Malfertheiner P. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report / P. Malfertheiner, F. Megraud, C. O’Morain et al. // Gut. — 2007. — Vol. 56. — P. 772–781.
- Malfertheiner P. European Helicobacter Study Group. Management of Helicobacter pylori infection the Maastricht IV/Florence Consensus Report / P. Malfertheiner, F. Megraud, C. O’Morain et al. // Gut. — 2012. — Vol. 61, № 5. — P. 646–664.
- Rabeneck L. SODA (severity of dyspepsia assessment): a new effective outcome measure for dyspepsia-related health / L. Rabeneck, K. Cook, К. Wristers, J. Souchek, T. Menke, N. Wray //Journal of Clinical Epidemiology. — 2001. — Vol. 54, № 8. — Р.755–765.
- Rugge M. OLGA staging for gastritis: a tutorial / M. Rugge, Р. Correa, F.Di.Mario,E.El-Omar, R.Fiocca, K.Geboes, R.Genta, D.Graham, T.Hattori, P.Malfertheiner, S.Nakajima, P.Sipponen, J.Sung, W.Weinstein, M.Vieth // Digestive and Liver Disease. — 2008. — Vol. 40, № 8. — P. 650–658.
- Turkez H. The efficiacy of bismuth subnitrate against genotoxicity and oxidative stress induced by aluminum sulphate / H. Turkez, F. Geyikoglu // Toxicology and Industrial Health. — 2011. — Vol. 27, № 2 — P. 133–142.
- Yamaoka Y. Mechanisms of disease: Helicobacter pylori virulence factors / Y. Yamaoka // Nat Rev Gastroenterol Hepatol. — 2010. — Vol. 7, № 11. — P. 629–641.

