Введение. Степень и характер влияния противоопухолевых цитостатических препаратов на гемопоэз во многом определяют возможности применения этих веществ в клинической практике. При изучении действия циклофосфана был установлен его выраженный миело- и лимфосупрессивный эффект [1-3]. В то же время клетки-предшественники гранулоцитов менее подвержены действию циклофосфана, чем эритроидные ядросодержащие клетки и клетки-предшественники лимфоцитов [4]. Установлено, что влияние циклофосфана на иммунную систему зависит от концентрации препарата, а также от времени его введения относительно антигенной стимуляции. Наиболее чувствительны к циклофосфану клетки на стадии пролиферации [5]. В последние годы было показано, что алкилирующие химиотерапевтические агенты в малых дозах способны оказывать иммуномостимулирующее действие за счёт угнетения Т-супрессорной субпопуляции [6]. Однако в терапевтических концентрациях они способны угнетать иммунный ответ. В частности, циклофосфан уже в дозе 20 мг/кг вызывает уменьшение числа спленоцитов у мышей [3]. При этом число Т-клеток снижается на 50%. Высокодозная химиотерапия (200 мг/кг) вызывает резкое уменьшение количества Т-лимфоцитов (на 90%) [6]. По данным Hirakata и Qin, циклофосфан при ежедневном введении в течение 7 дней по 20 мг/кг вызывает также снижение пролиферативной активности лимфоцитов селезёнки на такие митогены как липополисахарид, конканавалин А и Pseudomonas aeruginosa [7, 8]. Показано также, что однократное введение циклофосфана приводит к снижению числа лимфоцитов, особенно В-клеток, экспрессирующих В220. Кроме того, циклофосфан вызывает снижение продукции иммуноглобулинов клетками Пейеровых бляшек [7]. Эти результаты, по мнению авторов, свидетельствуют о необходимости комбинации химиотерапии и иммунотерапии при лечении злокачественных новообразований. В ряде исследований показано, что иммуномодуляторы различной природы способны восстанавливать количественный и супопуляционный состав лимфоидных клеток после действия цитостатиков [6, 9-11]. Несмотря на длительную историю изучения циклофосфана и его побочных действий до последнего времени не уделялось достаточного внимания морфологическим изменениям органов гемиммунопоэза и их клеточного состава под воздейсвием высоких доз цитостатика. Известно [12, 13], что при введении циклофосфана наблюдается тимическая атрофия с уменьшением размеров органа и заметным обеднением морфологии долек, кроме того в тимусной паренхиме выявляются миелометапластские изменения, особенно в субкапсулярной и кортико-медуллярной зонах. В капсулярной зоне и перегородках выражено истончение соединительно-тканных элементов [12]. Среди клеток долек тимуса увеличивается число апоптозированных тимоцитов с фрагментированной ДНК. Такие тимоциты имеют высокий уровень экспрессии каспазо-активируемой ДНКазы [13]. Показано [14], что циклофосфан вызывает практически полное истощение лимфоидных клеток в фолликулах бурсы Фабрициуса, значительное уменьшение её массы. В первую очередь, под действием циклофосфана в фолликулах бурсы снижается число пиронинофильных клеток. К 27 дню после введения циклофосфана клеточный состав фолликулов бурсы практически полностью восстанавливается, однако репопуляция кортикальной зоны в фолликулах бурсы имеет место только после таковой в мозговой зоне [14]. В настоящее время практически отсутствуют сведения о морфогистохимических характеристиках лимфоидных органов при проведении иммунокоррекции на фоне супрессивного действия цитостатиков. Использование морфогистохимических исследований позволит расширить характеристику иммуномодулирующих эффектов, проявляющихся на уровне как центральных, так и периферических органов иммунной системы. Подобные исследования, наряду с изучением макроскопических изменений и клинико-патологическими данными, приводят к установлению иммуномодулирующего эффекта того или иного препарата непосредственно на иммунную систему [15].
Целью настоящего исследования явилась морфологическая оценка формирования модели иммуносупрессии, индуцированной введением циклофосфана. В задачи исследования входила морфологическая характеристика органов гемиммунопоэза и субпопуляционного состава лимфоцитов при действии циклофосфана.
Материал и методы. Исследования проведены на 240 мышах линий СВА и Balb/с. Иммуносупрессию индуцировали внутрибрюшинным введением циклофосфана в дозе 50 или 100 мг/кг массы тела 4-х кратно ежедневно. Контрольной группой служили интактные мыши. Мононуклеарные лейкоциты (МЛ) селезенки получали путем центрифугирования клеточной взвеси на градиенте плотности фиколла. Оценку субпопуляционной структуры лимфоцитов осуществляли методом проточной цитометрии с применением моноклональных антител (МКА) (Caltag Laboratories, США) против клеточных антигенов. На МЛ селезенок мышей исследовали уровни экспрессии молекул субпопуляций Т-клеток (СD3, CD4, CD8, СD4/CD25/Foxp3), В-лимфоцитов (CD19), NK, NKT (CD3/NK) и белков MHC I и II классов. Мазки периферической крови готовили через 4, 24 и 96 часов после окончания эксперимента, окрашивали азуром II-эозином по Романовскому-Гимза и подсчитывали лейкоцитарную формулу. У мышей исследовали костный мозг, тимус и селезёнку. Материал забирали через 4, 24, 48, 96 и 168 часов после введения препарата и фиксировали в спирт-формол-уксусной кислоте по Теллесницкому. Серийные парафиновые срезы окрашивали гематоксилином и эозином, азуром II и эозином, метиловым зеленым и пиронином по Браше с контролем РНК-азой для оценки содержания РНК. Проводили ШИК-реакцию по Шабадашу с контрольной обработкой срезов амилазой для выявления гликогена и нейтральных гликозаминогликанов (ГАГ) и использовали альциановый синий с целью определения кислых гликозаминогликанов. Подсчитывали различные клеточные формы на 1000 клеток коркового и мозгового вещества долек тимуса, белой и красной пульпы селезёнки и проводили статистическую обработку данных с использованием t-критерия Стьюдента, применяя стандартный пакет статистических программ Windows 98 (StatSoft 5.5).
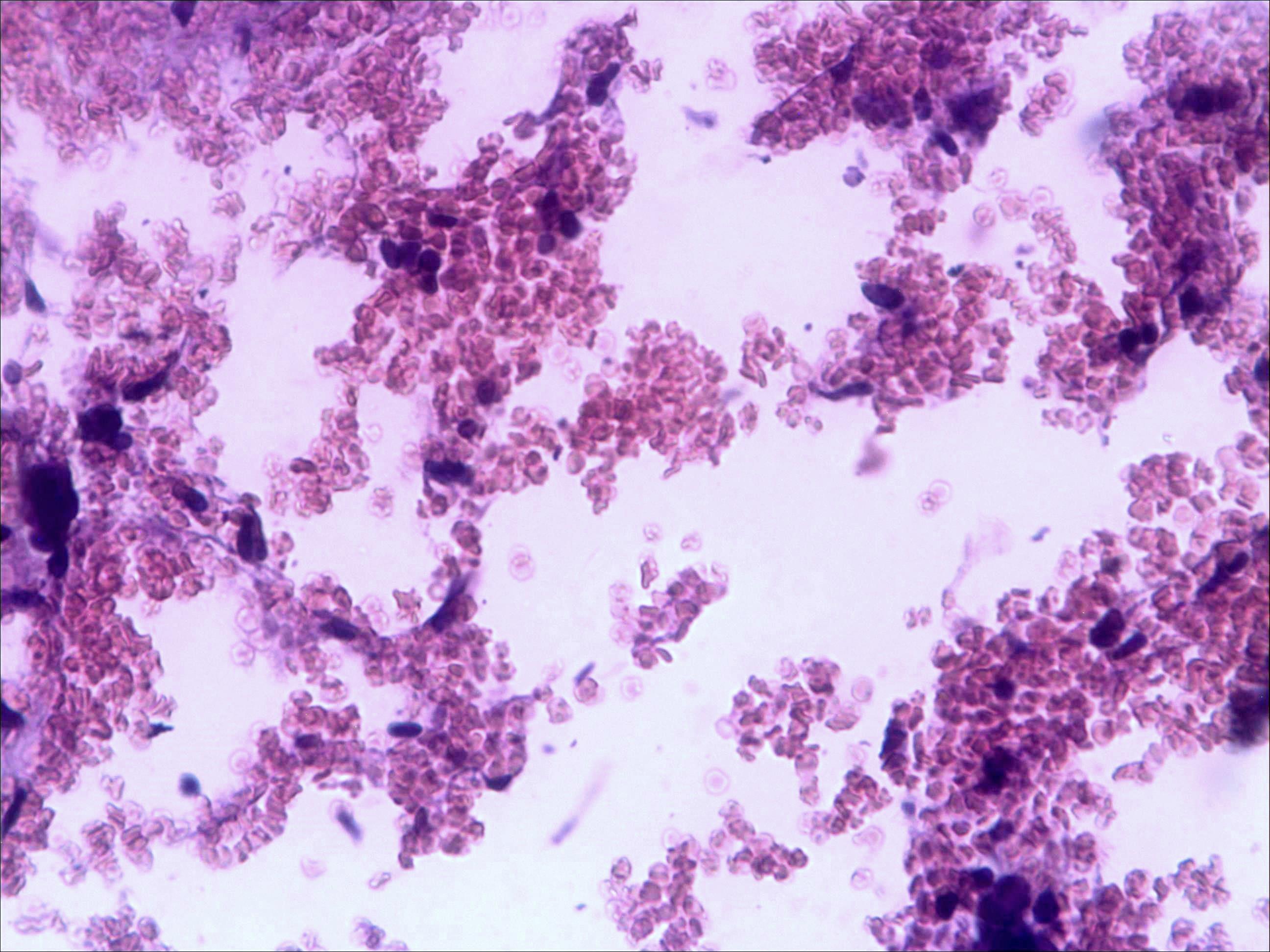
Основные результаты. Изучение мазков периферической крови мышей показало, что введение малых доз циклофосфана (50 мг/кг веса) через 24 часа после последнего введения цитостатика приводит к уменьшению количества моноцитов на 8-10%, незначительному снижению числа лимфоцитов (на 7-8%), но, напротив, к увеличению относительного содержания в крови и палочкоядерных, и сегментоядерных нейтрофилов (до 47 и 22% соответственно). Красный костный мозг интактных мышей имеет типичное строение (рис. 1а).
|
а |
б |
| |
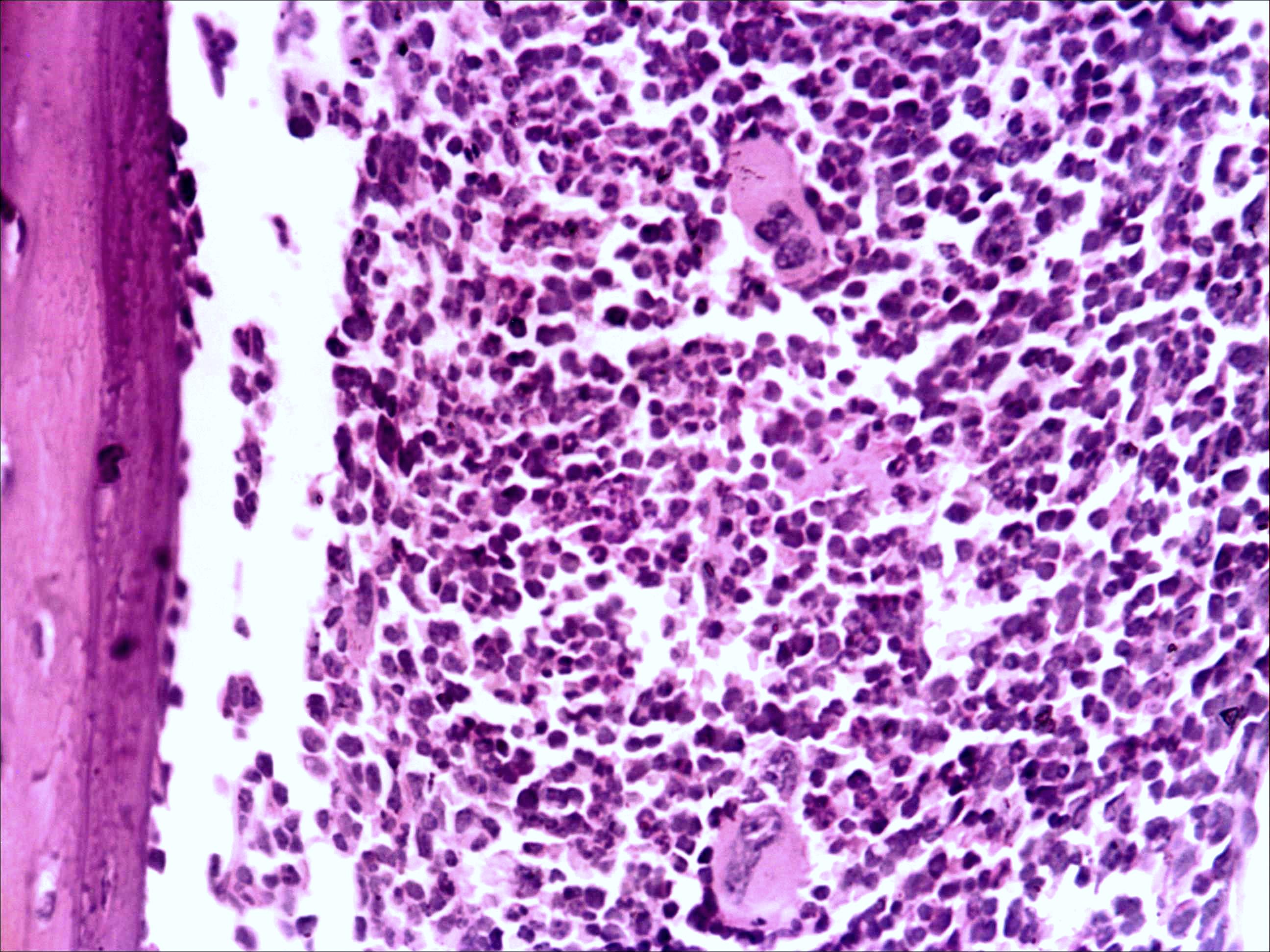
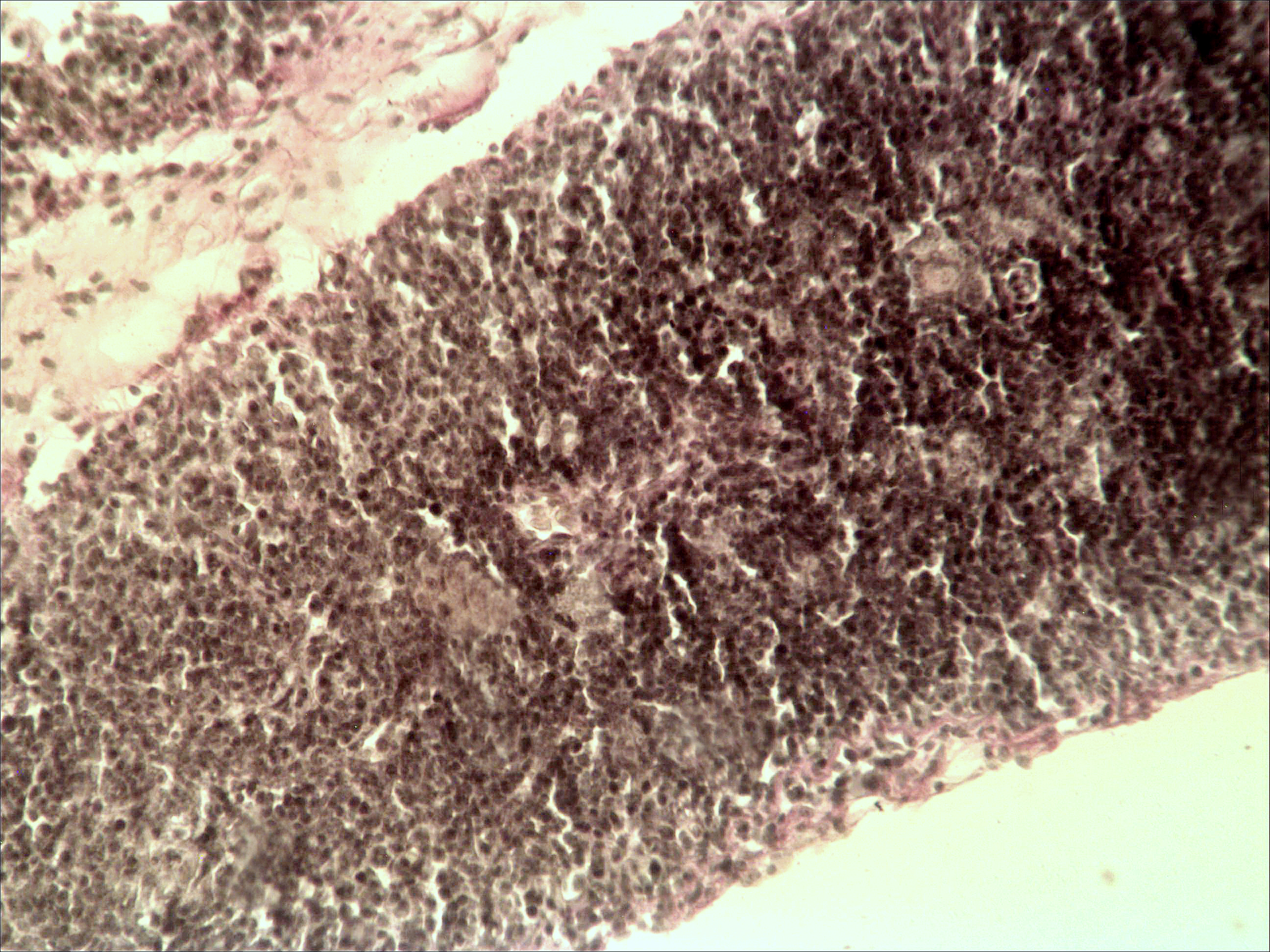
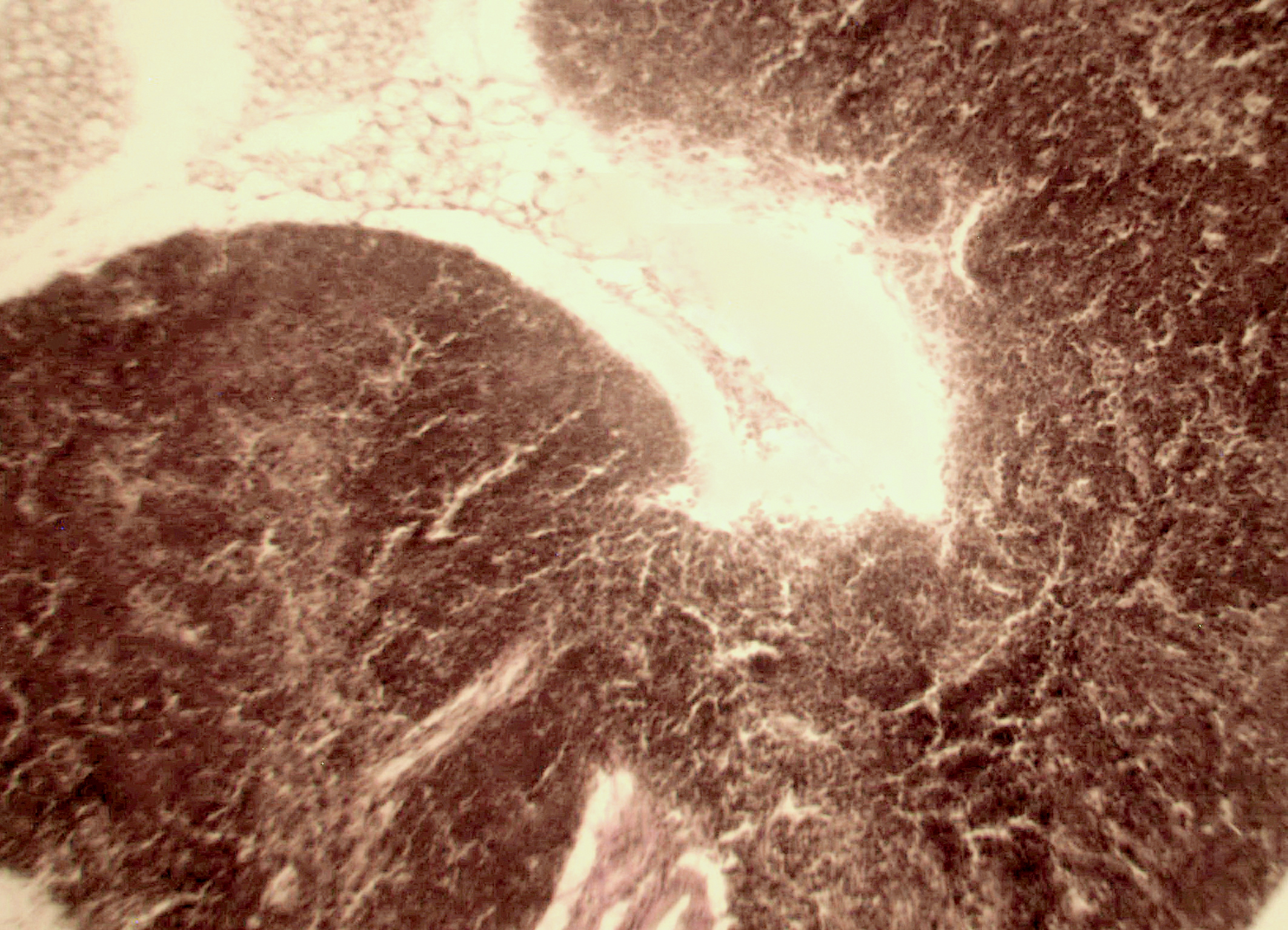
Морфологическая картина органа резко изменяется при действии циклофосфана через 4 часа после последнего введения (рис. 1б): на срезе видно большое количество зрелых эритроцитов при почти полном отсутствии и молодых, и зрелых форм лейкоцитов, дифференцирующихся клеток эритроидного ростка, остаётся лишь некоторое количество мегакариоцитов. Изменения нормальной структуры тимуса (рис. 2а) при введении циклофосфана носят следующий характер. Под воздействием 4-х кратной инъекции циклофосфана в дозе 100 мг/кг уже через 4 часа тимус резко обедняется лимфоцитами (рис. 2б). Особенно заметен данный процесс в корковом веществе, где выявляются лишь расширенные капилляры и клетки стромы, и почти полностью отсутствуют клетки лимфоидного ряда.
|
а |
б |
|
в |
г |
|
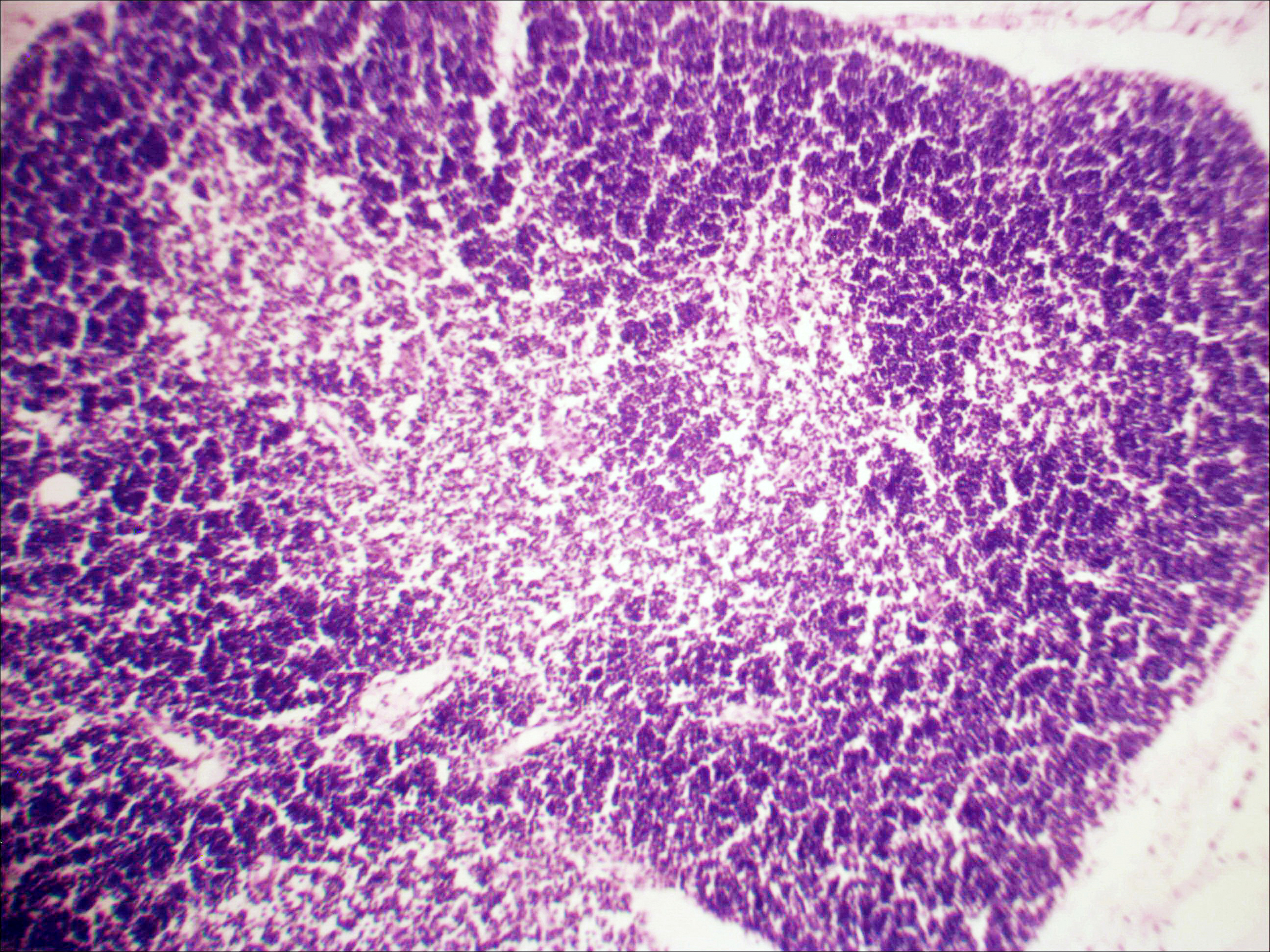
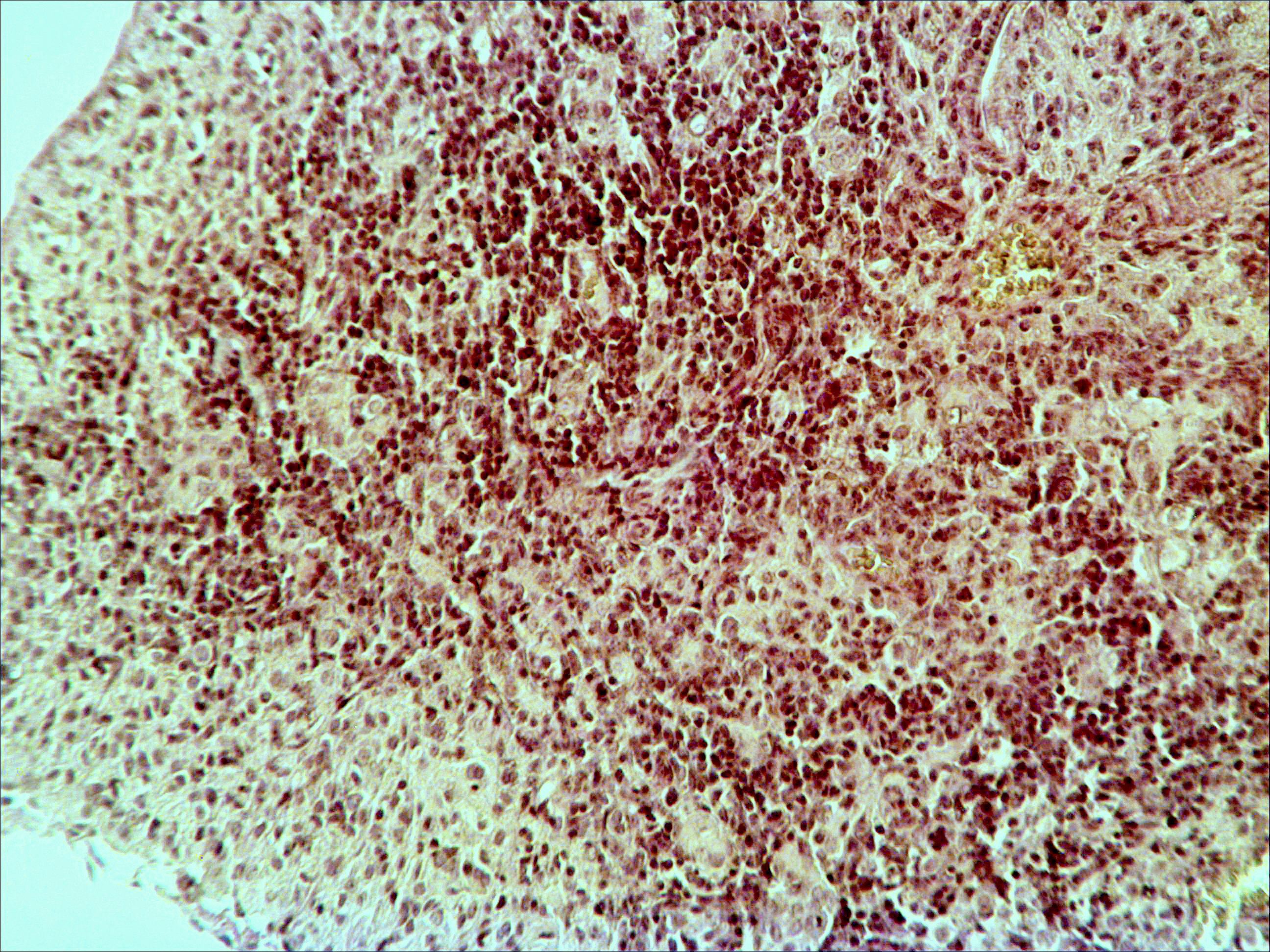
Рис. 2. Тимус интактных и экспериментальных мышей: а — интактных; окр. гематоксилином-эозином; ок. 10, об. 10; б — через 4 часа после введения циклофосфана; окр. по Ван Гизону; ок. 10, об. 10; в — через 96 часов после введения циклофосфана; окр.; по Ван Гизону; ок. 10, об. 10; г — через 168 часов после введения циклофосфана; окр.; по Ван Гизону; ок. 10, об. 10. | |
Мозговое вещество содержит заметно большее, чем корковое, количество лимфоцитов. Структура тимуса не восстанавливается ни через 96 часов после введения цитостатика, ни к концу эксперимента (8-е сутки после введения циклофосфана; рис. 2в, г). В данные сроки дольки тимуса кажутся однородными, т.е. не наблюдается деления на корковое и мозговое вещество. Более того, лимфоциты расположены более плотно в центре, чем по периферии, хотя общее количество их невелико. В связи с этим в корковом веществе отчётливо выявляются стромальные клетки, а также видны многочисленные макрофаги, содержащие в цитоплазме ШИК-позитивный компонент. Селезёнка интактных мышей имеет типичное для данных лабораторных животных строение. Введение циклофосфана в течение 4-х дней в дозе 100 мг/кг вызывает расширение сосудов органа и выраженную гиперемию прежде всего красной пульпы. Через 4 часа после последней инъекции цитостатика видно, что фолликулы белой пульпы невелики, имеют однородный характер, т.е. не наблюдается разделения на характерные для лимфатических узелков зоны. При большом увеличении особенно заметно почти полное отсутствие лимфоцитов в периартериальной муфте фолликулов - Т-зависимой зоне белой пульпы. В фолликулах не выявляются также реактивные центры В-зоны, а маргинальные участки обеднены клетками лимфоидного ряда. На 4-е сутки эксперимента фолликулы сохраняют небольшие размеры, не имеют отчётливо выраженных зон. Границы белой и красной пульпы стёрты, так как последняя оказывается плотно заполненной лимфоидными клетками. К концу эксперимента (8-е сутки после введения циклофосфана) структура селезёнки приближается к норме, но зоны фолликулов не восстановлены, а красная пульпа гиперемирована и содержит большее, чем у интактных животных, количество лимфоцитов. Анализ иммунофенотипа спленоцитов экспериментальных мышей продемонстрировал заметное снижение количества основных субпопуляций лимфоцитов под действием циклофосфана по сравнению с контрольной группой. В частности, на вторые сутки после последнего введения циклофосфана регистрируется уменьшение доли В-лимфоцитов (CD19+) в 3 раза (p<0,05). Среди Т-клеток в наибольшей степени супрессивное действие циклофосфана оказало влияние на CD4+-лимфоциты, содержание которых снизилось почти в 2,5 раза по сравнению с контролем (p<0,05). Введение циклофосфана приводит к достоверному снижению числа натуральных киллеров (DX5+) с 12±2% до 3±0,1% (p<0,01). Наряду с перечисленными данными, наблюдается также очевидная тенденция к понижению уровня НКТ (CD3+/DX5+) и Т-регуляторных клеток (CD4+/CD25+). В меньшей степени были подвержены действию циклофосфана CD8+-лимфоциты. Восстановление исходных показателей иммунофенотипа в данных условиях регистрировалось на 5-7 сутки после последнего введения цитостатика.
Заключение. Изменения состава периферической крови, структуры красного костного мозга, органов лимфоиммунопоэза и субпопуляционного состава лимфоцитов экспериментальных животных свидетельствуют о том, что циклофосфан в высоких дозах и при многократном введении обладает миело-, лимфо- и иммуносупрессивным действием. Восстановление указанных нарушений после применения цитостатика происходит спонтанно в течение длительного времени. Следовательно изученный режим введения циклофосфана может быть использован для создания экспериментальной индуцированной иммуносупрессии.
Литература:
1. Ванько Л.В., Сухих Т.Г. Естественная цитотоксическая активность клеток костного мозга и селезенки мыши в процессе регенерации после воздействия циклофосфамида // Бюлл. эксп. биол. и мед. – 1983. Т.XXVI. - №12. – С. 84-86.
2. Запускалова О.Б., Богдашин И.В., Новицкий В.В. Коррекция диуцифоном нарушений иммунитет, вызванных введением цитостатических препаратов // Иммунология. – 1990. - №6. – С. 24-27.
3. Mackova N., Suliova J. Repair processes of haemopoiesis after applying cyclophosphamide. I. Morphological changes in the bone marrow, spleen and thymus // Folia Haematol Int Mag Klin Morphol Blutforsch. – 1986. - 113(5). – P.596-604.
4. Sefc L., Psenak O., Sykora V., Sulk K., Necas E. Response of hematopoiesis to cyclophosphamide follows highly specific patterns in bone marrow and spleen // J Hematother Stem Cell Res. – 2003. - 12(1). – P.47-61.
5. Goodman L.S., Gilman A. The Pharmacological Basis of Therapeutics (eds A.G. Gilman, L.S. Goodman, L.S. Rall, F. Murad). - Macmillan, New York, 1975. - Chapter 55. - P. 1255.
6. Motoyoshi Y., Kaminoda K., Saitoh O. et al. Different mechanisms for anti-tumor effects of low- and high-dose cyclophosphamide // Oncol Rep. – 2006. - V.16. - №1. - P. 141-146.
7. Hirakata Y., Furuya N., Tateda K., Yamaguchi K. A protective role for lymphocytes in cyclophosphamideinduced endogenous bacteraemia in mice. // J. Med. Microbiol. – 1995. - Vol. 43. – P. 141-147.
8. Qin C.G., Huang K.X., Xu H.B. Effect of Misgurnus anguillicaudatus polysaccharide on immune responses of splenocytes in mice // Acta Pharmacol Sin. – 2002. - 23(6). – Р. 534-538.
9. Стеценко О.Н., Борзова Н.В., Линднер Д.П., Иванова А.С. Влияние иммуномодулятора полиоксидония на восстановление костного мозга, поврежденного действием гидрокортизона и циклофосфана // Иммунология. – 2005. - №6. – с. 27-32.
10. Cho W.C., Leung K.N. In vitro and in vivo immunomodulating and immunorestorative effects of Astragalus membranaceus // J Ethnopharmacol. – 2007. - 113(1). – Р. 132-141.
11. Chuang Y.H., Lian Z.X., Yang G.X., Shu S.A., Moritoki Y., Ridgway W.M., Ansari A.A., Kronenberg M., Flavell R.A., Gao B., Gershwin M.E. Natural killer T cells exacerbate liver injury in a transforming growth factor beta receptor II dominant-negative mouse model of primary biliary cirrhosis. // Hepatology. – 2008. - 47(2). – Р. 571-580.
12. Milicevic N.M., Milicevic Z., Piletic O., Ninkov V., Mujovic S. Restriction of regenerative capacity of the rat thymus after the application of cyclophosphamide // Journal of Comparative Pathology. – 1984. - vol. 94, issue 3. - P. 425-431.
13. Prakash, Gupta V., Singh S.M., Singh M.P., Singh G. Effect of intrauterine exposure of murine fetus to cyclophosphamide on development of thymus // Immunopharmacology and Immunotoxicology. – 2007. - vol. 29, issue 1. - P. 17-30.
14. Sorvari T., Toivanen A., Toivanen P. Transplantation of bursal steam cells into cyclophosphamide-trated chicks: redevelopment of bursal follicles // Transplantation. - 1974. - vol. 17, issue 6. - P. 584-592.
15. Vinod G., Arun P., Santanu J. Lymphoid tissue in toxicity studies: An over view // Journal of immunology and immunopathology. – 2009. - vol. 11, issue 2. – P. 125-138.
16. Лилли Р. Патогистологическая техника и практическая гистохимия.- М.: Мир, 1969. - С. 128-131.
17. Зидермане А.А. Циклофосфан. Сборник статей. Академия наук Латвийской ССР. Институт органического синтеза. Издательство «Зинатне». Рига. - 1965. - С.52-59.
18. Pannacciulli I.M., Massa G., Saviane A.G., Bianchi G., Bogliolo G.V., Ghio R. The effects of chronic administration of cyclophosphamide on haemopoietic stem cells // European Journal of Haematology. – 1977. – vol. 19, issue 2. – P. 217-223.
19. Горская Ю.Ф., Лебединская О.В., Шуклина Е.Ю. Математическое моделирование динамики колониеобразования при действии циклофосфамида // Материалы IV межрегиональной научно-практической конференции врачей патологоанатомов Урала, Сибири и Алтайского края. В кн.: “Актуальные вопросы патологической анатомии”. – Омск. – 1998. – С. 38-45.
20. Горбачева А.В., Ксиненко С.Г., Нашинский В.Г. Стрессиндуцирующее действие циклофосфана и его коррекция настойкой лобазника вязолистного // Сибирский онкологический журнал. – 2003. - №1. – С. 26-29.