Изучены моторно-эвакуаторные нарушения у 50 пациентов, оперированных по поводу аксиальной грыжи пищеводного отверстия диафрагмы. Из них у 18 пациентов выполнена селективная проксимальная ваготомия и у 32 пациентов — лапароскопическая операция Nissen.
После селективной проксимальной ваготомии и у 18(36,0 %) пациентов после лапароскопической операции Nissen имелись минимальные кратковременные проявления эвакуаторных нарушений в виде незначительной гиперфункции фундопликационной манжетки. У этих пациентов по данным периферической электрогастроентерографии имелся компенсированный тип моторики отделов ЖКТ с адекватной реакцией на пищевую стимуляцию всех отделов желудочно-кишечного тракта.
У 13 (26,0 %) пациентов после лапароскопической операции Nissen имелись выраженные эвакуаторные нарушения вследствие гиперфункции фундопликационной манжетки, а так же её дислокации и несостоятельности швов.
По данным периферической электрогастроентерографии у этих пациентов эвакуаторные нарушения определяли декомпенсированный тип моторики отделов ЖКТ с отсутствием нейро-рефлекторной реакции отделов желудочно-кишечного тракта на пищевую стимуляцию.
Тесная взаимосвязь моторно-эвакуаторных нарушений между отделами ЖКТ позволила на основе дискриминантного анализа показателей периферической электрогастроентерографии выделить 3 степени тяжести послеоперационных эвакуаторных нарушений, при которых 3-я степень тяжести была у пациентов с наиболее выраженными эвакуаторными нарушениями в области фундопликационной манжетки, 10,0 % которых были повторно оперированы с восстановлением эвакуаторных и моторных нарушений.
Полученные данные позволяют определять компенсацию послеоперационных эвакуаторных нарушений у пациентов с аксиальными грыжами пищеводного отверстия диафрагмы и степень тяжести их декомпенсации с индивидуализацией тактики лечения.
Ключевые слова: аксиальная грыжа пищеводного отверстия диафрагмы, послеоперационные моторно-эвакуаторные нарушения, селективная проксимальная ваготомия, операция Nissen, периферическая электрогастроентерография
Введение
Аксиальные грыжи пищеводного отверстия диафрагмы (АГПОД) занимают 3-е место среди патологии желудочно-кишечного тракта (ЖКТ) и отмечаются более чем в 90 % диафрагмальных грыж. [1,2,3].
Ежегодно в мире выполняется несколько тысяч операций по поводу АГПОД наиболее часто — лапароскопическим способом по Nissen. [4].
По данным Т. Т. Битарова [4] послеоперационные моторно-эвакуаторные нарушения у пациентов с АГПОД наблюдаются в 40 % случаев.
А. Ф. Черноусов [5] указывает, что наиболее часто они возникают в нижней трети пищевода в виде острой дисфагии, причинами которой являются чрезмерная крурорафия, излишне тугая фундопликационная манжетка, выраженное рубцевание в области ПОД, нераспознанное нарушение моторики пищевода (ахалазия).
По данным различных авторов дисфагия после фундопликации встречается в 3,2–100 %, наиболее часто носит транзиторный характер и купируется самостоятельно в течение 2–4 недель [3,6].
Shan C–X., Zhang W. и соавт. [12] отмечают появление «gas-bloat» синдрома в 47,4 % случая после операции Nissen.
Соскальзывание фундопликационой манжетки так же является одной из основных механических причин послеоперационных моторно-эвакуаторных нарушений и наиболее часто возникает после операций по Nissen, клинически проявляется дисфагией с болями за грудиной даже без полного закрытия просвета сдавленной части желудка [7].
Доказано, что явления стойкой дисфагии чаще возникают после лапароскопических фундопликаций в сравнении с открытыми, особенно, при использовании манжетки в модификации Nissen [8,10,12].
При сохранении стойкой дисфагии в 2–3 % случаев осуществляется повторное хирургическое вмешательство [3,10,13,14].
Однако, четких критериев, характеризующих декомпенсацию моторно-эвакуаторной функции пищевода, для прогнозирования результата консервативного лечения этого осложнения и принятия решения о необходимости осуществления реконструктивной операции мы не нашли.
Цель исследования — изучить послеоперационные моторно-эвакуаторные нарушения ЖКТ у больных с АГПОД.
Методы исследования
Оперативное вмешательство по поводу АГПОД выполнено 50 пациентам. Из них 18 (36,0 %) пациентам выполнено СПВ по методу РНЦХ РАМН [4,5] и 32 (64,0 %) пациентам выполнена эндоскопическая фундопликация по методу Nissen [12].
Учитывались клинические проявления послеоперационных моторно-эвакуаторных нарушений.
Всем пациентам проводилось эндоскопическое и рентгенологическое исследование. Регистрация электрофизиологических показателей моторики ЖКТ осуществлялась производилась аппаратом Гастроскан ГЭМ по стандартной методике. Контрольную группу составил 50 здоровых лиц.
Для оценки компенсации показателей моторики отделов ЖКТ мы использовали предложенные нами ранее показатели компенсации [11].
По каждому признаку в сравниваемых группах мы определяли среднюю арифметическую величину (М) и стандартную ошибку среднего (m). Оценка нормальности распределения выполнялась при помощи критерия Колмогорова-Смирнова. Проверка равенства дисперсий осуществлялась тестом Levene. Сравнение независимых групп по количественным признакам проводилось непараметрическим методом с U-критерием Манна-Уитни.
Критическое значение уровня статистической значимости при проверке нулевой гипотезы принималось равным p<0,05 (5 %). При p>5 % принималась нулевая гипотеза, при p<0,05 — альтернативная гипотеза.
Для выявления показателей ПЭГЭГ, позволяющих дискриминировать исследуемые группы, нами использован метод дискриминантного анализа (ДА), который проводился методом пошагового включения признаков в модель с итоговой оценкой вклада каждого показателя в долю вероятности правильной классификации.
ММ проводилось на основе анализа 20 базальных и 20 стимулированных показателей ПЭГЭГ.
ДА выполнялся методом пошагового исключения показателей из модели по критериям Tolerance и F-статистике (F для включения 2,0; F для исключения 1,9). Группирующим признаком являлся тип моторики ЖКТ.
Результаты исследования:
После СПВ объем отделяемого по назогастральному зонду составлял 70±30 мл/сутки. Зонд удаляли на 4-е сутки после операции.
Употребление жидкой пищи было безболезненным. При употреблении твердой пищи пациентами отмечалась незначительная кратковременная боль за грудиной. Со стороны брюшной полости явлений пареза кишечника отмечено не было. У больных отсутствовало вздутие живота, отходили газы, стул был на 5–6-е сутки после операции.
Послеоперационных осложнений в данной группе пациентов не было.
После операции Nissen у 19 (38,0 %) больных послеоперационный период так же протекал гладко. По назогастральному зонду объем желудочного отделяемого составлял 60±30 мл/сутки. Зонд удаляли на 2-е сутки после операции. Рвоты у данных пациентов не наблюдалось. Питание начинали с 3-х суток. При употреблении жидкой пищи болевой синдром отсутствовал, при употреблении твердой пищи отмечалась так же кратковременная незначительная боль в подложечной области.
Со стороны брюшной полости явлений пареза кишечника отмечено не было. У больных отсутствовало вздутие живота, отходили газы, стул был на 4–5-е сутки после операции (таблица 1).
Таблица 1
Характер жалоб пациентов с АГПОД после оперативного лечения
|
Жалобы |
Группы пациентов | ||||||
|
СПВ |
Nissen | ||||||
|
n =18 |
% |
n =32 |
% | ||||
|
Боль в области п/о раны |
1–2-е сутки |
18 |
100,0 |
32 |
100,0 | ||
|
3–4-е сутки |
11 |
61,2 |
2 |
6,2 | |||
|
4-е и более |
4 |
22,3 |
1 |
3,1 | |||
|
Боль /тяжесть в эпигастрии после употребления пищи |
2 |
11,2 |
1 |
3,1 | |||
|
Вздутие живота, дискомфорт |
- |
- |
5 |
15,6 | |||
|
Слабость |
1 |
5,6 |
13 |
40,6 | |||
|
Дисфагия |
Iстепень |
- |
- |
2 |
6,2 | ||
|
IIстепень |
1 |
3,1 | |||||
|
Рвота |
Однократная |
- |
- |
1 |
3,1 | ||
|
Многократная |
- |
- |
2 |
6,2 | |||
|
Тошнота |
2 |
11,2 |
5 |
15,6 | |||
|
Нарушения стула |
Запор |
3 |
16,7 |
11 |
34,3 | ||
|
Диарея |
- |
- |
1 |
3,1 | |||
|
Чередование запоров и диареи |
- |
- |
1 |
3,1 | |||
В остальных 13(40,1 %) случаях после операции Nissen отмечено более тяжелое течение послеоперационного периода, которое проявлялось наличием дополнительных жалоб на общую слабость у 13(40,1 %) пациентов, тошноту у 5(15,6 %) пациентов, рвоту в 3(9,3 %) случаях. Отмечались явления дисфагии I-II степени в 3(9,3 %) случаях в виде боли по ходу прохождения пищевого комка. В 1(3,1 %) случае отмечалось прохождение только полужидкой пищи
Наряду с такими жалобами как боль в области послеоперационной раны, вздутия живота, запора и диареи у этих пациентов со стороны брюшной полости в 5(15,6 %) случаях отмечались явления «gas-bloat»синдрома в виде вздутия живота и дискомфорта, неспособности выпустить газ с отрыжкой из желудка, нарушение стула в виде запора у 11 (34,3 %) больных.
Назогастральный зонд этим пациентам сохраняли до 4–6 суток. Объем желудочного отделяемого составлял 120±30 мл/сутки.
При послеоперационном обследовании у этих пациентов выявлена задержка бария в пищеводе и до выписки из стационара сохранялись явления дисфагии I-II степени.
Признаки стеноза в области фундопликационной манжетки определялись как клинически, так и при инструментальном обследовании больных в виде сужения нижней трети пищевода при ФГДС и задержки бария в нижней трети пищевода с его супрастенотическим расширением.
Рентгенологическое исследование после операции проводилось всем пациентам и выявило у них явления гиперфункции фундопликационной манжетки различной степени выраженности.
В доступной литературе мы не нашли рентгенологических критериев оценки гиперфункции фундопликационной манжетки после операции по поводу АГПОД, что затрудняет решение вопросов тактики лечения этих пациентов.
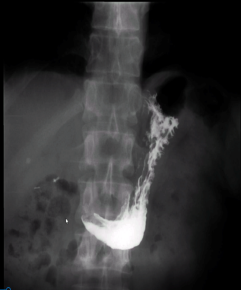
Для их оценки нами предложено условное разделение рентгенологических признаков на незначительную гиперфункцию (задержка столбика рентген контрастного вещества до 1–2 минуты, h≤17,0 см и b≤6,0см) и значительную (задержка столбика рентген контрастного вещества до 5 минут и более h≥17,0 см и b≥6,0 см) (Рис. 2).
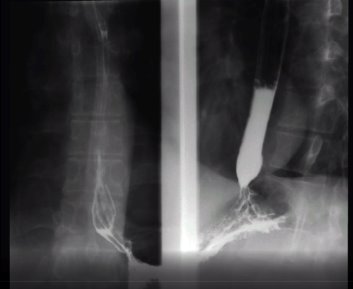
А Б
Рис. 1. Рентгеноскопия пищевода в норме. А — вариант нормы- прохождение рентгенконтрастного вещества по пищеводу за 1–2 дыхательных движения; Б — раствор сульфата бария в желудке, полное смыкание кардии
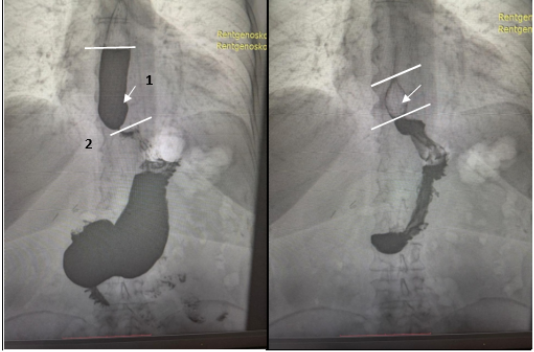
Рис. 2. Рентгеноскопия пищевода больной С. после лапароскопической кардифундопликации по Nissen: 1 — задержка контраста в пищеводе на 5 минут; 2 — сужение пищевода в области фундопликационной манжетки, наличие симптома «птичьего клюва»
После СПВ во всех случаях отмечалось наличие незначительной гиперфункции фундопликационной манжетки с задержкой контрастного вещества до 1 минуты у 13 (72,2 %) пациентов и до 2-х минут у 2 (11,2 %) больных (таблица 2).
Таблица 2
Результаты рентгенологического исследования больных с АГПОД в раннем послеоперационном периоде
|
Признак |
Распределение признаков | ||||
|
СПВ ( n=1 8 ) |
Nissen ( n=3 2 ) | ||||
|
n |
% |
n |
% | ||
|
Сужение пищевода |
I степени (d до 9–11 мм) |
- |
- |
2 |
6,2 |
|
II степени (d до 6–8 мм) |
- |
- |
1 |
3,1 | |
|
Задержка эвакуации контрастного вещества из пищевода в желудок |
1 минута |
13 |
72,2 |
3 |
9,3 |
|
2 минуты |
2 |
11,2 |
10 |
31,2 | |
|
5 минут и более |
- |
- |
19 |
59,3 | |
|
Гиперфункция кардиофундопликационной манжетки |
незначительная |
18 |
100,0 |
13 |
40,6 |
|
значительная |
- |
- |
19 |
59,3 | |
|
Синдром «gas-bloat»(синдром вздутия) |
- |
- |
1 |
3,1 | |
|
Соскальзывание фундопликационной манжетки |
- |
- |
2 |
6,2 | |
После операции Nissen незначительная гиперфункция фундопликационной манжетки была в 13 (40,6 %) случаях с задержкой контраста в пищеводе на 1 минуту у 3 (9,3 %) пациентов, на 2 минуты — у 10 (31,2 %) пациентов и на 5 минут и более — у 19 (59,3 %) пациентов.
Сужение пищевода I-II степени отмечалось в 9,3 % случаев, проявление «gas-bloat» синдрома было в 1(3,1 %), случае и миграция фундопликационной манжетки в 1(3,1 %) случаев.
После СПВ таких осложнений не наблюдалось.
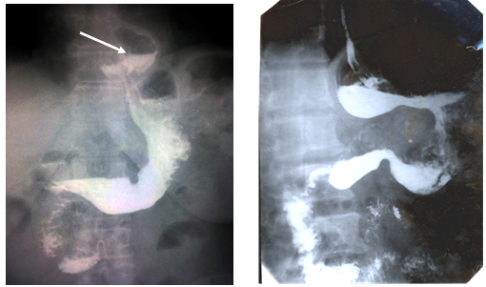
АБ
Рис. 3. Рентгенгография пищевода и желудка больной А. после операции Nissen. А-Миграция кардиофундаппликационной манжетки в средостение. Б-«gas-bloat»(синдром вздутия)
После операции Nissen по поводу послеоперационных моторно-эвакуаторных нарушений в области фундопликационной манжетки оперированы 5 пациентов. Из них у 1 пациента имелось прорезывание швов фундопликационной манжетки с перфорацией стенки желудка и у остальных 4 пациентов — миграция фундопликационной манжетки (рисунок 3).
В 1 случае выполнена релапаротомия и зашивание перфорации желудка, в остальных 4 случаях — расправление дислоцированной фундопликационной манжетки с устранением стенотических осложнений и СПВ с повторным формированием фундопликационной манжетки.
Для оценкипослеоперационной моторики ЖКТ всем пациентам выполнена ПЭГЭГ.
В соответствии с полученным нами данными о неоднородности послеоперационных моторно-эвакуаторных проявлений у больных с АГПОД нами выполнена кластеризация показателей ПЭГЭГ, в результате которого все пациенты разделились на 2 группы (рисунок 4).
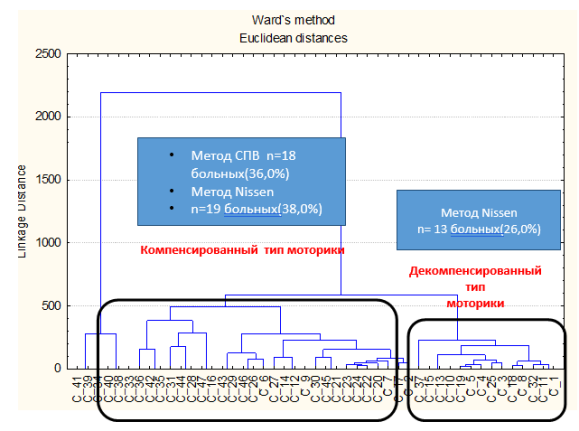
Рис. 4. Дендограмма распределения больных по типам МЭ нарушений в зависимости от вида оперативного лечения
В одну группу вошли все 18 (36,0 %) пациентов после СПВ и 19 (38,0 %) пациентов после операции Nissen с неосложненным течением послеоперационного периода, минимальными проявлениями гиперфункции фундопликационной манжетки.
По данным ПЭГЭГ у них сохранялась адекватная реакция отделов ЖКТ на пищевую стимуляцию с сохранением нейрорефлекторной стимуляции ниже расположенным отделов ЖКТ и отмечался компенсированный тип моторики ЖКТ с повышением стимулированных показателей электрической и ритмической активности отделов ЖКТ относительно их базальных значений со значением показателей компенсации электрической и ритмической активности отделов ЖКТ >1.
В другую группу пациентов вошли 13 (26,0 %) пациентов после операции Nissen с выраженными явлениями гиперфункции фундопликационной манжетки и её дислокацией.
У пациентов с декомпенсированным типом моторики с показателями компенсации электрической и ритмической активности <1
По данным ПЭГЭГ у них отсутствовала адекватная реакция отделов ЖКТ на пищевую стимуляцию и соответствующая нейрорефлекторная стимуляция ниже расположенных отделов ЖКТ и отмечался декомпенсированный тип послеоперационной моторики со снижением стимулированных показателей электрической и ритмической активности отделов ЖКТ относительно их базальных значений со значением показателей компенсации электрической и ритмической активности отделов ЖКТ <1. (таблица 3).
Таблица 3
Показатели ПЭГЭГ у больных с АГПОД после оперативного лечения
|
Показатели ПЭГЭГ |
Значения показателей ПЭГЭГ | |||||
|
До операции n- 50 |
После операции | |||||
|
Nissen n- 32 |
СПВ n- 18 | |||||
|
Компенсированный тип |
Декомпенсированный тип | |||||
|
n 19 |
n 13 | |||||
|
Ps (мВ) |
Базал |
39,16±0,51 |
50,04±0,27 |
162,94±4,93* |
44,96±0,29 | |
|
Стим |
52,89±0,62 |
49,02±0,27 |
13,28±10,93* |
78,94±0,31 | ||
|
Pi (мВ) |
Желудок |
Базал |
15,06±0,19 |
20,72±0,21 |
40,81±1,05 |
17,46±0,14 |
|
Стим |
17,51±0,21 |
13,73±0,71 |
0,6±0,02* |
28,89±0,22 | ||
|
ДПК |
Базал |
1,62±0, 34 |
3,11±0, 54 |
2,62±0,05 |
1,99±0, 21 | |
|
Стим |
5,54±0, 11 |
4,21±0, 81 |
1,21±0,18 |
5,88± 0,78 | ||
|
Тощая |
Базал |
3,32±0,45 |
6,67±0, 67 |
6,41±0,01 |
4,05±0, 36 | |
|
Кишка |
Стим |
8,66±0, 14 |
5,13±0, 54 |
4,12±0,56 |
8,26±0, 63 | |
|
Подвзд. кишка |
Базал |
9,21±0, 16 |
14,67±0, 16 |
15,16±0,40 |
9,30±0, 72 | |
|
Стим |
11,95±0,17 |
10,69±0, 81 |
38,13±1,11* |
18,76±0, 12 | ||
|
Толстая кишка |
Базал |
20,23±0, 31 |
18,52±0, 12 |
97,14±3,45* |
18,60±0, 12 | |
|
Стим |
24,16±0,39 |
15,33±0, 11 |
31,53±6,94 |
31,88±0, 18 | ||
|
Pi/Ps (%) |
Желудок |
Базал |
30,32±0,81 |
28,91±0, 98 |
27,44±0,78 |
28,59±0, 34 |
|
Стим |
30,14±0,95 |
29,39±0, 73 |
2,18±0,56* |
26,40±0, 58 | ||
|
ДПК |
Базал |
3,79±0,54 |
3,75±0, 56 |
1,57±0,08 |
3,41±0, 24 | |
|
Стим |
5,64±0,82 |
6,28±0,87 |
3,4±0,07 |
6,41±0, 79 | ||
|
Тощая |
Базал |
6,54±0,49 |
8,13±0, 52 |
3,67±0,19 |
7,41±0, 56 | |
|
кишка |
Стим |
9,62±3,23 |
8,94±0, 56 |
9,7±0,30 |
8,53±0, 52 | |
|
Подвзд. кишка |
Базал |
15,52±0,82 |
17,20±0, 63 |
8,58±0,31* |
15,28±0, 69 | |
|
Стим |
16,19±0,72 |
20,37±0, 71 |
52,72±0,39* |
18,31±0, 44 | ||
|
Толстая |
Базал |
43,58±4,08 |
36,77±0,72 |
58,97±0,78* |
45,28±0, 14 | |
|
Стим |
38,19±7,30 |
34,72±0, 13 |
24,01±0,10* |
40,33±0,13 | ||
|
P(P(i)/P(i+1)i) |
Желудок/ |
Базал |
20,29±6,36 |
16,21±0, 12 |
22,35±0,11 |
12,86±0, 97 |
|
ДПК |
Стим |
17,59±3,62 |
13,81±0, 76 |
0,76±1,23* |
10,24±0, 69 | |
|
ДПК/Тощая кишка |
Базал |
0,61±0,03 |
0,51±0, 03 |
0,55±0,03 |
0,54±0,01 | |
|
Стим |
0,62±0,03 |
0,65±0,04 |
0,35±0,03 |
0,70±0,03 | ||
|
Тощая/ |
Базал |
0,42±0,01 |
0,51±0,01 |
0,42±0,07 |
0,50±0,03 | |
|
Подвзд |
Стим |
0,87±0,31 |
0,44±0,16 |
0,22±0,01* |
0,46±0,01 | |
|
Подвзд./ |
Базал |
1,22±0,48 |
0,79±0,05 |
0,16±0,08* |
0,50±0,04 | |
|
Толстая |
Стим |
1,07±0,20 |
1,13±0, 13 |
8,38±0,01* |
0,69±0,05 | |
|
Kритм |
Желудок |
Базал |
8,81±0,69 |
10,78±0,17 |
15,87±0,35 |
10,29±0, 39 |
|
Стим |
11,12±0,85 |
8,53±0,29 |
1,50±0,67* |
13,44±0, 52 | ||
|
ДПК |
Базал |
2,05±0,23 |
2,53±0,22 |
3,03±0,07 |
2,49±0, 15 | |
|
Стим |
3,15±0,32 |
2,94±0,22 |
2,38±0,14 |
4,44±0, 26 | ||
|
Тощая кишка |
Базал |
3,45±0,96 |
4,69±0, 27 |
5,58±0,35 |
4,23±0, 23 | |
|
Стим |
4,88±0,71 |
4,42±0,29 |
3,83±0,67 |
6,53±0, 33 | ||
|
Подвзд. кишка |
Базал |
5,02±0,81 |
6,43±0,38 |
7,90±0,07 |
6,12±0, 28 | |
|
Стим |
6,34±0,45 |
5,95±0, 29 |
14,04±0,14* |
8,89±0, 29 | ||
|
Толстая кишка |
Базал |
15,06±5,12 |
18,21±0, 18 |
30,03±0,12 |
16,19±0, 78 | |
|
Стим |
16,09±0, 13 |
27,26±0, 13 |
27,94±0,13* |
20,36±0,76 | ||
Такая зависимость наглядно демонстрирует тесную взаимосвязь эвакуаторных и моторных послеоперационных нарушений ЖКТ у пациентов с АГПОД. (таблица 4, рисунок 7).
Таблица 4
Показатели ПЭГЭГ у пациентов с декомпенсированным типом моторики
|
Показатели ПЭГЭГ |
До операции |
После операции Декомпенсированный тип моторики n=13 |
Р 1 |
Р 2 |
Р 3 | |||
|
I группа n- 5 |
II группа n-2 |
III группа n-6 | ||||||
|
ПК моторики ЖКТ |
2,5±0,07 |
0,70±0,03 |
0,75±0,05 |
0,91±0,02 |
p>0,015757 |
p>0,006368 |
p>0,006368 | |
|
ПК ЭА. Pi Моторики ЖКТ |
Желудок |
1,44±0,41 |
0,59±0,029 |
0,19±0,002 |
0,609±0,004 |
p< 0,00001 |
p< 0,00001 |
p>0,664514 |
|
ДПК |
3,01±0,03 |
2,3±0,082 |
0,14±0,001 |
1,95±0,09 |
p>0,678697 |
p>0,006368 |
p>0,678697 | |
|
Тощая кишка |
2,11±0,02 |
0,83±0,03 |
0,17±0,003 |
1,31±0,02 |
p>0,067407 |
p>0,513928 |
p>0,013501 | |
|
Подвзд. кишка |
1,17±0,07 |
0,67±0,35 |
0,14±0,013 |
1,05±0,02 |
p>0,549140 |
p>0,513928 |
p>0,013501 | |
|
Толстая кишка |
1,26±0,02 |
0,54±0,08 |
0,43±0,01 |
0,87±0,06 |
p>0,013501 |
p>0,008831 |
p< 0,00001 | |
|
ПКСК |
Желудок |
1,22±0,02 |
0,70±0,09 |
0,33±0,03 |
0,83±0,02 |
p >0,373103 |
p< 0,000687 |
p>0,013501 |
|
ДПК |
1,38±0,01 |
1,58±0,06 |
0,36±0,03 |
1,71±0,03 |
p>0,884985 |
p>0,008831 |
p>0,604529 | |
|
Тощая кишка |
1,44±0,03 |
1,07±0,02 |
0,37±0,01 |
1,18±0,03 |
p>0,513928 |
p< 0,001028 |
p>0,664514 | |
|
Подвзд. кишка |
1,15±0,02 |
0,87±0,05 |
0,36±0,02 |
1,06±0,08 |
p< 0,00001 |
p< 0,00901 |
p>0,013501 | |
|
Толстая кишка |
1,22±0,12 |
0,62±0,01 |
0,33±0,01 |
0,92±0,02 |
p>0,513928 |
p< 0,008028 |
p >0,373103 | |
Примечание: p 1 — статистически значимое (p<0,05) различие в сравнении показателей моторики I группы с показателями моторики II группы; p 2 — статистически значимое (p<0,05) различие в сравнении показателей II группы с показателями моторики III группы; p 3 — статистически значимое (p<0,05) различие в сравнении показателей моторики III группы с показателями моторики I группы.
После выполненных повторных операций у пациентов с осложнениями после операции Nissen у них по данным ПЭГЭГ тип моторики ЖКТ приобретал компенсированный характер (рисунок 5, 6)
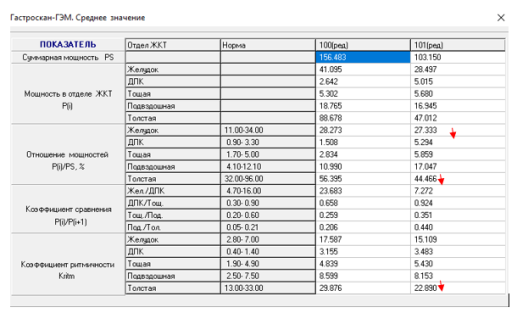
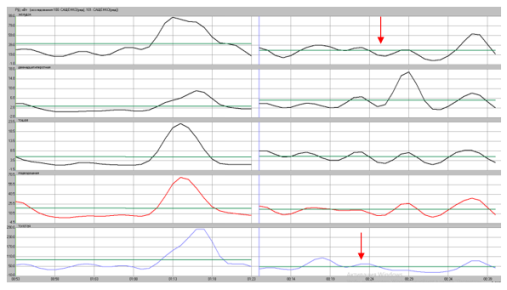
Рис. 5. Показатели ПЭГЭГ больной М. после операции Nissen с миграцией фундопликационной манжетки и сужением пищевода 3 ст. Отмечается декомпенсированный типа моторики ЖКТ
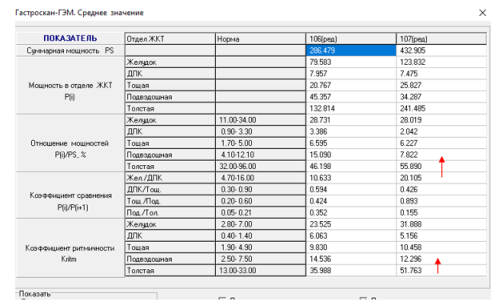
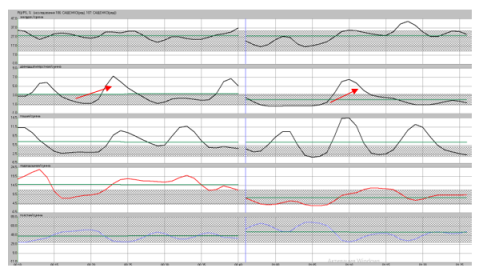
Рис. 6. Показатели ПЭГЭГ у больной М.после устранения миграции фундопликационной манжетки и стеноза пищевода и СПВ, отмечается компенсированный гипермоторный тип моторики ЖКТ
Для подтверждения данной гипотезы нами проведено ММ моделирование на основании ДА. В результате проведенного анализа в ММ вошло 15 показателей ПЭГЭГ из которых статистически значимыми оказались 11 показателей (таблица 5).
Таблица 5
Показатели ММ компенсации моторики ЖКТ у больных с БАГПОД после СПВ и операции Nissen по данным ПЭГЭГ
|
Показатели ПЭГЭГ |
Показатели дискриминантного анализа после СПВ и операции Nissen | |||||
|
Лямбда Уилкса |
Частичная лямбда |
F - (1,20) |
p |
Tolerance |
1-Toler. (R-Sqr.) | |
|
Ps базальный |
0,166623 |
0,442982 |
26,4060 |
0,000043 |
0,017133 |
0,982867 |
|
Pi толстая кишка базальный |
0,215413 |
0,342647 |
40,2875 |
0,000003 |
0,014236 |
0,985764 |
|
Pi толстая кишка стимулированный |
0,487164 |
0,151511 |
117,6037 |
0,000000 |
0,103148 |
0,896852 |
|
Pi подвздошная кишка стимулированный |
0,538387 |
0,840125 |
12,75002 |
0,000664 |
0,058749 |
0,941251 |
|
Pi/Ps подвздошная кишка базальный |
0,186478 |
0,395816 |
32,0550 |
0,000013 |
0,070968 |
0,929032 |
|
Pi/Ps толстая кишка базальный |
0,341643 |
0,216047 |
76,2012 |
0,000000 |
0,031344 |
0,968656 |
|
Pi/Ps толстая кишка стимулированный |
0,518520 |
0,872313 |
9,80725 |
0,002577 |
0,017851 |
0,982149 |
|
Р(i)/Р(i+1) Жел/ДПК стимулированный |
0,392513 |
0,188047 |
90,6743 |
0,000000 |
0,073534 |
0,926466 |
|
Р(i)/Р(i+1) ДПК / Тощая кишка стимулированный |
0,213782 |
0,345263 |
39,8233 |
0,000003 |
0,132541 |
0,867459 |
|
Р(i)/Р(i+1)Под /Толстая кишка базальный |
0,099472 |
0,742025 |
7,3009 |
0,013350 |
0,062460 |
0,937540 |
|
К ритмичности желудок базальный |
0,116466 |
0,633755 |
12,1358 |
0,002216 |
0,022600 |
0,977400 |
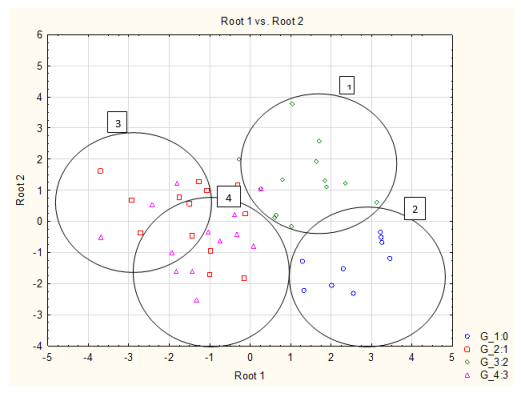
Рис. 7. Распределение больных после оперативного лечения по данным ДА показателей ПЭГЭГ:
1 — декомпенсированный тип моторики после операции по Nissen
2 — здоровые лица
3 — компенсированный тип моторики после операции после СПВ
4 — компенсированный тип моторики после операции по Nissen
На основании полученных данных нами предложен способ определения компенсации моторики ЖКТ после оперативного лечения АГПОД по данным ПЭГЭГ.
Для осуществления этого метода ПЭГЭГ осуществляют по стандартной методике с пищевой нагрузкой. Для обработки данных ПЭГЭГ используем формулу:
d1=-111,830+0,486 х А1+2,534 х А2+17,688 х А3 +(-1,949 х А4)+ 84,572 х А5 +3,595 х А6
d2=-48,8657+(-2,3503 х А1) +1,6707 х А2+16,3269 х А3 +(-0,8428 х А4)+ 56,9092 х А5 +1,6967 х А6
d3=-47,7711+(-0,4912 х А1) +1,4696 х А2+10,8907 х А3 +0,1390 х А4)+ 60,8451 х А5 +1,4869 х А6
d4=-58,7025 + (-2,1756 х А1) +1,7533 х А2+16,7124 х А3 +(--0,6640 х А4)+ 70,0829 х А5 стим +2,2018 х А6 определяют значения прогностических коэффициентов d. При значении d 1 больше d 2 и d 3 устанавливают I степень, при d 2 больше d 1 и d 3 — II степень и при d 3 больше d 1 и d 2 устанавливают III степень нарушения эвакуаторной функции желудка.
Для каждой степени нарушения эвакуаторной функции пищевода нами были рассчитаны значения констант «а» и прогностических коэффициентов d 1 , d 2 и d 3.
Правильная диагностика нарушения эвакуаторной функции пищевода составила 100 %. Правильное распределение пациентов по степени тяжести послеоперационного гастростаза у пациентов с АГПОД составило 90,6 %.
У пациентов с 1–2 степенью декомпенсации моторно-эвакуаторных нарушений по данным ПЭГЭГ проводилось только консервативное лечение. При 3-й степени декомпенскации послеоперационных моторно-эвакуаторных нарушений в 1-м случае они носили наиболее выраженный характер и потребовали дополнительного обследования, в 5(10.0 %) остальных случаях — выполнено повторное оперативное лечение по хирургическому устранению стенотических поражений пищевода.
Выводы.
- После селективной проксимальной ваготомии и у 18(36,0 %) пациентов после лапароскопической операции Nissen имелись минимальные кратковременные проявления эвакуаторных нарушений в виде незначительной гиперфункции фундопликационной манжетки. У этих пациентов по данным периферической электрогастроентерографии имелся компенсированный тип моторики отделов ЖКТ с адекватной реакцией на пищевую стимуляцию всех отделов желудочно-кишечного тракта.
- У 13 (40,6 %) пациентов после лапароскопической операции Nissen имелись выраженные эвакуаторные нарушения вследствие гиперфункции фундопликационной манжетки, а так же её дислокации и несостоятельности швов.
- По данным ПЭГЭГ у этих пациентов эвакуаторные нарушения определяли декомпенсированный тип моторики отделов ЖКТ с отсутствием нейро-рефлекторной реакции на пищевую стимуляцию.
- Тесная взаимосвязь моторно-эвакуаторных нарушений позволила на основе ДА показателей ПЭГЭГ выделить 3 степени тяжести послеоперационных эвакуаторных нарушений при которых 3 степень тяжести была у пациентов с наиболее выраженными эвакуаторными нарушениями в области фундопликационной манжетки 83,3 % которых были повторно оперированы с восстановлением эвакуаторных и моторных нарушений.
- Полученные данные позволяют определять компенсацию и степень декомпенсации послеоперационных эвакуаторных нарушений у пациентов с АГПОД с индивидуализацией их тактики лечения.
Литература:
1. О новом физикальном симптоме в диагностике грыж пищеводного отверстия диафрагмы / А. А. Гаранин, Э. Э. Адыширин-Заде, А. М. Осадчук. — Текст: непосредственный // Медицинский альманах. — 2018.
2. Особенности нарушения качества жизни у больных с малыми грыжами пищеводного отверстия диафрагмы [Текст] / И. А. Зябрева [и др.] //Гастроэнтерология Санкт-Петербурга. — 2021. — № 1–2. — С. 39.
3. Хуболов, А. М. Причины неудач и показания к рефундопликаии в антирефлюксной хирургии / А. М. Хуболов. — Текст: непосредственный // Саратов- ский научно-медицинский журнал. — 2016. — Т. 12, № 3. — С. 408–411.
4. Битаров, Т. Т. Лапароскопическая фундопликация в модификации РНЦХ в лечении больных рефлюкс-эзофагитом. дис. … канд. мед. наук: 14.01.17 /Битаров Тимур Тамазович. — Москва, 2016. — 113 с.
5. Робот-ассистированные и лапароскопические фундопликации при кардиофундальных и субтотальных грыжах пищеводного отверстия Черноусов А. Ф., Комаров Р. Н., Осминин С. В., Ветшев Ф. П., Билялов И. Р. Вестник хирургической гастроэнтерологии. 2021. № 2. С. 52.
6. Велигоцкий ММ, Горбулич АВ, Комарчук вв. Профилактика неблагоприятных результатов лапароскопической коррекции антирефлюксной функции кардии при грыжах пищеводного отверстия диафрагмы и ахалазии пищевода. Одесский медицинский журнал. 2018;149(3):66–69.
7. Комаров, Р. Н. Хирургия грыж пищеводного отверстиям диафрагмы: лапароскопические или робот-ассистированные операции? [Текст] / Р. Н. Комаров, С. В. Осминин, И. Р. Билялов // Российский журналгастроэнтерологии, гепатологии, колопроктологии. — 2022. — Т. 32, № 1. — С.15–23.
8. . Ерин, С. А. Современные технологии в оперативном лечении грыж пищеводного отверстия диафрагмы: дис. … канд. мед. наук: 14.01.17 /Ерин Сергей Александрович. — Москва, 2021. — 111 с.
9. Результаты применения программы ускоренного выздоровления fast track у пациентов с лапароскопической коррекцией грыжи пищеводногоотверстия диафрагмы [Текст] / М. А. Буриков [и др.] // Хирургия. Журнал им.Н. И. Пирогова. — 2018. — № 10. — С. 18–22.
10. Комплексное лечение осложненных форм грыж пищеводного отверстия диафрагмы с учетом индивидуальных особенностей пациента [Текст] / Д. М. Черкасов [и др.] // Медико-фармацевтический журнал«Пульс». — 2019. — Т. 21, № 10. — С. 35–41.
11. Косенко П. М., Вавринчук С. А., Куликов Л. К. Электрофизиологические показатели моторики ЖКТ после селективной проксимальной ваготомии у больных с язвенным пилородуоденальным стенозом // Доказательная гастроэнтерология. — 2016. — № 3. С. 31–43.
12. Shan C–X, Zhang W, Zheng XM, JiangD–Z, Liu S, Qiu M. Evidence — based appraisal in laparoscopic Nissen and Toupet fundoplications иfor gastroesophageal reflux disease. World Journal of Gastroenterology. 2018;16(24):3063–3071.
13. Characteristics of esophageal motility in patients with non-erosive reflux disease and reflux esophagitis / X. Sun, M. Ke, Z. Wang [et al.]. — Text: visual // Zhonghua Yi Xue Za Zhi. — 2014. — Vol. 94, № 22. — P. 1718–1721.
14. Charlson, M. E. A new method of classifying prognostic comorbidity in longitudinal studies: development and valida- tion / M. E. Charlson, P. Pompei, K. L. Ales, C. R. MacKenzie // J Chronic Dis. — 1987. — Vol. 40, № 5. — P. 373–383.

