Электрокатализ — это процесс изменения скорости некоторых, селективных, электрохимических реакций, который происходит на границе электрода и электролита в случае каталитического действия. Он важен в процессе превращения химической энергии в электрическую и наоборот.
Данное явление впервые было замечено в начале XX века, когда установили зависимость скорости катодного выделения водорода от материала электрода. Электрокатализ получил широкое распространение после 1960 благодаря развитию исследований, посвященных проблеме топливных элементов.
По своей сути электрокатализ похож на гомогенный катализ — явление, которое представляет собой изменение скорости химической реакции при воздействии вспомогательных веществ — катализаторов.
Особенностью данного процесса является то, что сами по себе катализаторы, принимая активное участие в реакции, не изменяются во время прохождения реакции — то есть не расходуются. По причине возможного многократного использования подобного вещества, его количество, используемое в реакции, меньше, чем с реагентами.
Другая не менее значимая способность катализаторов — повышение избирательности протекания реакции или селективности. Другими словами, если без использования катализатора реагенты реагируют между собой, то в итоге есть вероятность получения нескольких различных конечных продуктов. Такая вариативность объясняется условием строения и устойчивости (неустойчивости) промежуточных частиц, от которых зависит скорость протекания реакции и выбор ее направления. Если же применить в реакции «ускоритель», в большинстве случаев, получится только один, известный, продукт реакции. Катализатор снижает энергию активации и устанавливает конкретное строение промежуточных частиц, которые заставляют реакцию происходить подобным образом.
Электрокатализ особенно значим при необходимости увеличения эффективности работы топливных элементов — часто, в подобных установках применяют электроды, покрытые катализаторами.
Топливный элемент — устройства, которые позволяют вырабатывать электрический ток и тепло из химического источника тока с высокой эффективностью. Простейшая установка такого типа состоит из полимерной мембраны, которая размещается между анодом и катодом вместе с соответствующими катализаторами и служит в качестве электролита. На рисунке 1 «Топливный элемент с протонообменной мембраной» показана схема такой установки.
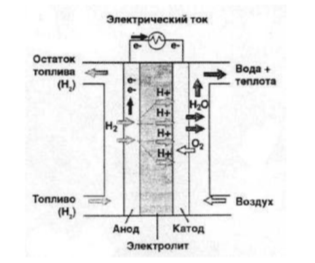
Рис. 1. Топливный элемент с протонообменной мембраной
Проходя через каналы на пластине, молекулы водорода поступают на анод, где случается реакция разложения молекул на отдельные атомы. После, благодаря абсорбции, атомы водорода под влиянием катализатора становятся положительно заряженными ионами водорода H+ или протоны. Через мембрану они поступают к катоду и происходит процесс диффузии, при котором протоны взаимодействуют с подведенным кислородом и образуют воду. Поток электронов поступает к катоду через внешнюю электрическую цепь, находящейся под нагрузкой (она является потребителем электроэнергии). Генерация тока происходит благодаря превращению химической энергии в электрическую на месте соприкосновения трех фаз: катализатора на носителе — электронном проводнике, электролите, выступающем ионным проводником, и газообразном реагенте.
Использование подобной схемы позволяет уменьшить конструкцию топливного элемента и увеличить его габариты, повысить количество материалов, которые могут применяться в топливных элементах, из-за снижения коррозионной агрессивности среды.
Тип среды в топливном элементе особенно сильно влияет на выбор электрокатализаторов, так как именно от нее зависит кинетика и механизм протекания электродных реакций. К примеру, наиболее изученным и универсальным катализатором является платина и, на данный момент, практически во всех прототипах подобных установок используются катализаторы на ее основе. Однако этот материал не является «выгодным» из-за своей стоимости и низкой стабильности.
Проблема поиска стабильных катализаторов, которые способны обеспечить высокую скорость и глубину реакции, является одной из главных при оптимизации токогенерирующего процесса в теплообменных аппаратах.
Помимо использования различных катализаторов в процессе, не менее важно учитывать вид твердого полимерного электролита: анодного или катодного. В случае с протонопроводящим электролитом в катодном пространстве, происходит накопление воды, образовавшейся при восстановлении кислорода. С точки зрения макрокинетики ее следует отводить для оптимизации данного процесса. Так же стоит отметить, что данная реакция может проходить при pH ~ 0 и это условие позволяет протекать токогенерирующей реакции с высокой скоростью. Однако, в такой процесс влияет на материал, из которого сделан катализатор — ускоряет его разрушение. Поэтому к катодным твердым электролитам предъявляется требование в повышенной физико-химической стабильности (чаще всего они изготавливаются на основе платины, которая необходимыми характеристиками в полной мере не обаладает.
В топливных элементах, где токогенерирующая реакция происходит в полости анода, вода образуется и накапливается при реакции электроокисления водорода. В ходе экспериментов было установлено, что самые высокие характеристики топливных элементов такого типа можно получить только при 100 %-ом увлажнении топлива и окислителя. Поэтому в данном случае, в отличии от катодного типа, отвод воды не требуется. Следует отметить, что в таких топливных элементах использование катализаторов, содержащих платину, необязательно. Это связано с низкой коррозионной активность гидроксильных групп, связанных с полимером.
Также следует учитывать экономический вопрос и обоснование топливных элементов — они должны выдерживать устойчивое функционирование продолжительностью более 30000 часов в стационарных условиях. Факторы, влияющие на потерю стабильности устройством можно подразделить на 2 группы:
- Деградационные изменения, возникающие непосредственно генерацией тока в топливном элементе.
- Эффекты, которые происходят при отравлении катализаторов и электролитов примесями, которые поступают в систему вместе с топливом и/или окислителем.
Обе группы имеют непосредственное влияние на скорость реакции и, иногда, на процесс токогенерирующей реакции.
Деградационные изменения при работе топливного элемента, где окислитель и топливо не содержат примеси, возникают в связи с высокой кислотностью среды полимерного электролита, приводящей к активной коррозии. Также, одной из основных «виновников» разрушения мембраны является проникновение кислорода и водорода в смежные электродные пространства в результате их сопряженной реакции на поверхности пластины.
Наличие вредных примесей в газах, которые попадают в топливный элемент, приводит к частичной блокировке активных центров катализаторов, а иногда и к разрушению полимерного электролита. Наиболее опасно наличие примесей серы и азота, чьи оксиды в состоянии изменить механизм процесса и заполнить 86 % активной поверхности и могут заблокировать от 25 до 100 % поверхности соответственно. Отдельно следует выделить примесь из аммиака, которая опасна для топливного элемента с протонпроводящим электролитом, тем, что вызывает увеличение сопротивления мембраны и дезактивацию катализаторов (для анодпроводящих электролитов данное отравление не является критическим).
Одна из основных проблем оптимизации процесса получения тока в топливном элементе является нахождение стабильных электрокатализаторов, которые могут позволить происходить реакции с высокой скоростью и глубиной. Однако, так же следует учитывать стоимости и доступность (распространенность) предполагаемых для использования катализаторов. Другая, не менее важная проблема — обеспечение длительного стабильного периода использования топливного элемента. На данный момент поиск и разработка соответствующих заявленным требованиям материалов является значительной задачей.
Литература:
- Электрокатализ.//Академик [Электронный ресурс]. URL: https://dic.academic.ru/dic.nsf/bse/153545/Электрокатализ (дата обращение 19.11.2019)
- Корчагин О. В., Тарасевич М. Р. Токогенерирующие реакции в топливных элементах с протонпроводящим и анионпроводящим электролитами. Электрохимическая энергетика. 2014. Т. 14, № 3. С. 117–132
- Багоцкий В. С., Васильева Б. Ю. Топливные элементы. Некоторые вопросы теории. М.: Наука, 1964. 140 с
- Тарасевич М. Р., Корчагин О. В. Экспресс-диагностика характеристик и стабильности топливных элементов с протонпроводящим электролитом // Электрохимия. 2014. Т.50, № 8. С. 821–834.
- Тарасевич М. Р., Хрущева Е. И. Механизм и кинетика электровосстановления кислорода на металлических электродах // Кинетика сложных электрохимических реакций. М.: наука, 1981. С. 104–158.

