Полимерные носители важны для контролируемого выделения и направленного транспорта лекарств. Они особенно важны для противотуберкулезных лекарственных средств.
Туберкулез – одно из наиболее опасных инфекционных заболеваний по количеству вызываемых им смертей. По данным Всемирной Организации Здравоохранения, эта инфекция вызывает 8 миллионов новых случаев заболеваний и убивает более двух миллионов человек в год во всем мире.
Одна из основных проблем в лечении туберкулеза состоит в необходимости поддержания постоянной высокой концентрации противотуберкулезного препарата не только в кровотоке, но и в специальных клетках – макрофагах – местах персистенции возбудителей болезни – микробактерий. На данный момент применяются противотуберкулезные препараты, имеющие низкую проникающую способность через клеточные мембраны, и в макрофаги действующие препараты практически не попадают. В связи с этим обычное лечение туберкулеза, направленное на уничтожение Mycobacterium tuberculosis только в кровотоке, является малоэффективным и требует серьезной химиотерапии с использованием чрезвычайно высоких дозировок токсичных лекарственных препаратов в течение длительного времени (нескольких месяцев).
Полимерные матрицы позволяют обеспечить постепенное выделение лекарственного вещества в организм в малых дозах путем их медленной диффузии, скорость которой можно регулировать, а также позволяют обеспечить солюбилизацию плохо растворимых в воде лекарственных веществ.
Более того, полимерные носители могут обеспечить направленный транспорт противотуберкулезных препаратов непосредственно в макрофаги, используя способность макрофагов поглощать инородные объекты размером порядка 100 - 200 нм. Кроме того если полимерный носитель заряжен положительно, то он должен проявлять лизосомотропность (сродство к отрицательно заряженным лизосомам) и благодаря этому обеспечивать доставку противотуберкулезного средства в вакуолярный аппарат макрофагов – место персистенции возбудителя, а также увеличивать частоту фагосомолизосомального слияния и стимулировать пластические процессы в клетках (индуцировать синтез лизосомальных гидролаз).
Одним из наиболее перспективных полимеров для этой цели является хитозан и его производные, характеризующиеся хорошей биосовместимостью и биоразлагаемостью.
1.1. Общие сведения о хитозане
Хитозан - сополимер 2-ацетамидо-2-дезокси-Д-глюкопиранозы и 2-амино-2-дезокси-Д-глюкопиранозы.
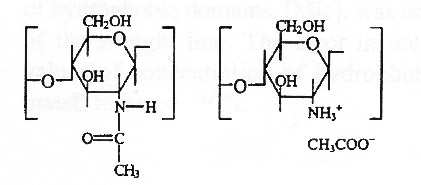
Рис. 1 Химическая формула хитозана
Его получают щелочным деацетилированием хитина, который является главным составляющим панцирей ракообразных, таких как креветки, крабы. Хитозан - слабое основание, нерастворимое в водных и органических растворителях, но растворимое в разбавленном водном растворе кислот (pH<6.5). В растворе кислоты аминогруппы хитозана протонируются, полимер становится заряженным. Хитозан становится растворимым, если не менее 50% аминогрупп протонированы. Помимо степени заряженности, главными параметрами, влияющими на особенности хитозана, являются его молекулярная масса и степень деацетилирования (DA). При работе с данным полимером DА может быть понижена переацетилированием, а молекулярная масса может быть понижена деполимеризацией. На данный момент хитозан доступен в форме сухих хлопьев, раствора или тонкого порошка. Средняя молекулярная масса колеблется от 3800 до 2000000 г/моль, а степень деацетилирования от 0 до 95 %.
Хитозану в настоящее время уделяют большое внимание в медицинских и фармацевтических приложениях. Главные причины все увеличивающегося интереса - это его свойства. Хитозан биосовместим, что позволяет использовать его для различных медицинских целей. Кроме того, хитозан расщепляется при обмене веществ определенными человеческими ферментами, например, лизоцимом, и, таким образом, может быть рассмотрен как разлагаемый микроорганизмами биополимер. В растворенной форме хитозан демонстрирует еще одну уникальную особенность – его молекулы способны проникать через внешние мембраны клеток живых организмов. Эта способность является одной из основ механизма иммуномодуляции, индуцируемой хитозаном в организмах растений, животных и человека. Благодаря наличию положительных зарядов на полимерных цепях, хитозан обладает свойством адгезии к отрицательно заряженным поверхностям. Кроме того хитозан, обладая ярко выраженными иммуностимулирующими свойствами, способствует повышению устойчивости организма к инфекциям. Наконец, хитозан находится в изобилии в природе, и его производство экономически и экологически выгодно.
Вообще говоря, по своим свойствам хитозан похож на человеческий фибрин (один из компонентов свертывания крови). При приеме внутрь, в отличие от большинства видов растительной клетчатки, под воздействием пищеварительных ферментов, а также лецитина, часть хитозана расщепляется, всасывается в кровь и усваивается организмом в виде низкомолекулярных соединений. Главным из них является гиалуроновая кислота, входящая в состав межклеточного вещества, мембран (оболочек) клеток, стекловидного тела глаза и т.д. Другая часть, не расщепленная ферментами, не всосавшаяся в кровь, соединяясь с влагой, превращается в гелеобразную массу, действует в желудочно-кишечном тракте как мощный адсорбент, очищает кишечник, выводит из него токсические вещества. Хитозан, соединяясь с желчной кислотой, блокирует усвоение жиров и холестерина и выводит их из организма, тем самым препятствует развитию атеросклероза. Также он тормозит образование ангиотензина - вещества, вызывающего спазм сосудов и повышение артериального давления. Он активирует фагоцитоз микроорганизмов. За счет комплексообразования хитозан связывает и выводит из организма токсические вещества. Также хитозан усиливает внутрикишечный синтез витаминов кишечными бактериями и препятствует образованию камней в желчевыделительной системе.
1.2 Использование хитозана в качестве носителя лекарственных препаратов.
Большинство используемых ныне терапевтических средств, несмотря на безусловную эффективность при лечении того или иного заболевания, вызывают нежелательные побочные эффекты. Идеальная лекарственная система должна осуществлять точную доставку лекарственного вещества в больной орган и его высвобождение в нужный момент, когда организм в нем нуждается, и в минимальном количестве, необходимом для лечения. Создание такой системы позволило бы существенно снизить дозы лекарственных веществ и, следовательно, избежать их побочных воздействий.
Наиболее удобный традиционный способ введения лекарств - пероральный - позволяет избежать связанных с инъекциями боли и риска инфицирования. Более того, лекарственные формы, предназначенные для перорального приема, более дешевые, поскольку для их приготовления не нужны стерильные условия. Скорость выделения контролируется количеством лекарства в матрице, растворимостью его в полимере, степенью гидратации геля, кинетикой набухания и контракции полимера [1-3]. Скорость сорбции и десорбции можно направленно менять путем введения в гель лигандов, способных специфически связываться с сорбируемым веществом [3-5].
Кишечная стенка представляет собой основной барьер, через который терапевтические вещества могут проникать в кровоток. Однако, если маленькие молекулы, такие как аминокислоты и сахара, могут свободно преодолеть стенку кишечника за счет активного транспорта через клеточную мембрану, то для таких крупных молекул, как белки, мембрана клеток кишечника практически непроницаема. Таким образом, для создания лекарственных форм белков, пептидов, гормонов и других высокомолекулярных гидрофильных соединений необходимо воспользоваться принципом "Троянского коня": макромолекулы должны быть "замаскированы" (включены внутрь гидрофобных микрочастиц, которые путем эндоцитоза смогут попасть внутрь клетки кишечной стенки).
Полимерные носители можно разделить на несколько групп: полимерные конъюгаты, мицеллы и микрогели. Микрогели наиболее удобны для использования в качестве лекарственных носителей: их размер можно варьировать от 100 нм до нескольких микрометров, лекарственный препарат может находиться внутри микрогелей, а также на поверхности микрогелей можно расположить молекулы - рецепторы, определяющие зараженные клетки. Более того, набухание микрогелей может зависеть от изменения рН или температуры. Таким образом микрогели выделяют лекарственный препарат при определенных условиях [6].
В настоящее время известны примеры успешного использования целого ряда полимерных систем на основе хитозана для доставки и контролируемого освобождения биологически активных веществ через слизистые и, в частности, при их пероральном введении. Основные требования к лекарственной форме, предназначенной для перорального приема, следующие: обеспечение защиты "начинки" от действия протеолитических ферментов и кислой среды желудка (рН=2) и контролируемое высвобождение лекарства в нейтральной среде (рН=7,0-7,4) тонкого кишечника или прямой кишки. Среди множества примеров из литературы приведем лишь несколько. Например, английские ученые Lim S.T., Forbes В., и Berry D.J. [7] предложили разработку новых полимерных микрочастиц на основе гиалуроновой кислоты-хитозана для назальной (через слизистые носовой полости) доставки гентамицина, которая оказалась в 30-40 раз эффективнее, чем доставка этого антибиотика в виде раствора или сухого порошка. Польским ученым Bodek K.H. [8] предлагается использовать микрокристаллический хитозан в виде гидрогелевых частиц в качестве эффективного средства пролонгированной доставки кетопрофена. Отметим также публикацию испанских ученых Janes K.A. и Fresneau M.P [9], которые предлагают использовать хитозановые носители для доставки доксорубицина при терапии рака. В Японии предлагают использовать хитозановые капсулы, содержащие противовоспалительное лекарство (5-аминосалициловую кислоту), для лечения колитов в модели на крысах [10]. Наконец, параллельно несколько лабораторий занимаются разработкой хитозановых микрокапсул с инкапсулированным в них инсулином для перорального применения [11, 12].
Особый интерес хитозан представляет в качестве носителя противотуберкулезных лекарственных препаратов, поскольку, как положительно заряженный полимер, он способствуют проникновению лекарственного вещества через клеточную мембрану (заряженную отрицательно), а также стимулируют поглощение лекарственных веществ макрофагами. В настоящее время уже начаты работы по получению полимерных носителей на основе хитозана для противотуберкулезных лекарственных препаратов. Были получены микросферы из природных полисахаридов хитозана и альгината. Хитозан является поликатионом, а альгинат полианионом. Лекарства от туберкулеза, которые вводились в микросферы – это рифампицин, изониазид и пиразинамид. Размер микросфер 65-75 мкм, и лекарство заходит внутрь хитозан-альгинатных микросфер в меньших количествах (по сравнению с альгинатными микросферами)[13].
Свойства полиионного комплекса между хитозаном и альгинатом сильно зависят от среды раствора: уменьшение pH приводит к сжатию альгинатного геля и уменьшению проникающей способности альгинат-хитозанных микросфер. В нейтральной или щелочной среде интерполимерный комплекс набухает, и лекарство выходит наружу.
Преимуществом таких микросфер в сравнении с альгинатными в том, что хитозан стабилизирует альгинатные микросферы, предотвращая их разрушение, увеличивает пористость микросфер и время выхода лекарства. Способность хитозана регулировать связывание с кишечником способствует выходу инкапсулированного лекарства.
В случае инкапсулированного лекарства концентрация его в пораженных органах (легкие, печень, селезенка) оставалась постоянной в течение недели, при введении чистого лекарства оно расходовалось за сутки; максимального значения концентрация достигала через сутки в случае микросфер и через час – в противном.
Микросферы на основе хитозана рассматриваются как перспективные носители лекарств как для парентеральной (минуя желудочно-кишечный тракт), так и для оральной доставки.
Литература
1. Tanaka Т. II Phys. Rev. Lett. 1978. V. 40. P. 820-823.
2. Nirokawa, Г.; Tanaka, Т. II J. Chem. Phys. 1984. V. 81. P. 6379-6380.
3. Matsukata, M.; Takei, Y.; Aoki, T. et al. II3. Biochem. (Tokyo), 1994. V. 116. P. 682-686.
4. Hoffman, A.S.; Afrassiabi, A.; Dong, L.C.: J. Controlled Release. 1986. V. 4. P. 213-222.
5. Kokufata, E.; Zhang, Y.-Q.; Tanaka, T.: Nature. 1991. V. 351. P. 302-304.
6. Hong Zhang; Sawitri Mardyani; Warren, C.W. Chan; Eugenia Kumacheva: Design of Biocompatible Chitosan Microgels for Targeted pH-Mediated Intracellular of Cancer Therapeutics. Biomacromolecules 2006, 7, 1568-1572.
7. Lim, ST.; Forbes, В.; Berry, DJ. et al.: Int. J. Pharm. V. 23. N 1. P. 73-82.
8. Bodek, K.H.: II Acta Pol. Pharm, 2001. V. 58. N 3. P. 185-194.
9. Janes, K.A.; Fresneau, M.P.; Marazuela, A. et al.: J. Control Released 2001. V. 15. N 73 (2-3), P. 255-267.
10. Tozaki, H.; Fujita, Т.; Terahe, A.; Okabe, S. et al.: J. Pharm. Pharmocol. 1999. V. 51. N10. P. 1107-1112.
11. Ramadas, M.; Paul, W.; Dillep, KJ. et al.: J. Microencapsul. 2000. V. 17. N 4. P. 405:11.
12. Ramadas, M.; Paul, W. et al.: J. Pharm. Sci. 1997. V. 86. N 9. P. 1016-1021.
13. Qurrat-ul-Ain1, Sadhna Sharma1, G. K. Khuller1 and S. K. Garg2. Alginate-based oral drug delivery system for tuberculosis: pharmacokinetics and therapeutic effects. Journal of Antimicrobial Chemotherapy (2003) 51, 931–938

