Представлен краткий обзор антологии и перспективы новых снотворных средств, полученных из N3-фенацилуридина, а также описание нескольких новых аналогов ациклонуклеозидов.
Ключевые слова: N3-фенацилуридин, снотворные средства
Целевой поиск новых безопасных и эффективных снотворных все еще находится в центре внимания современной фармацевтической и медицинской химии, а также фармакологии. Ряд потенциальных соединений-лидеров, которые обладают различными механизмами действия, был представлен в недавнем обзоре [1]. Особое место среди них может занимать нуклеозидное производное — N3-фенацилуридин:
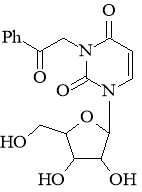
Его воздействие на центральную нервную систему впервые было показано И. Ямамото и соавторами в 1994 г. [2]. В ходе исследований механизма его связывания с рецепторами было установлено, что N3-фенацилуридин оказывает некоторое влияние на связывание меченного тритием флунитразепама с бензодиазепиновыми рецепторами [3].
Эти данные указывают на то, что этот молекулярный механизм может быть частично ответственным за биологическую активность N3-фенацилуридина. Но существенный механизм его гипнотической активности был открыт и опубликован Т. Кимурой и соавторами [4] только спустя несколько лет. Было показано, что специфический тип рецепторов, так называемые «уридиновые рецепторы» в центральной нервной системе, опосредовал свою активность на молекулярном уровне. Также было показано, что соответствующие спирты наделены тем же профилем активности и сродства с вновь открытыми рецепторами. Во время этих исследований была показана примечательная стереоселективность их действия [5].
Следует отметить, что R-изомер 3-(2-гидрокси-2-фенилэтил)уридина был примерно в 190 раз менее активным, чем его оптический антипод, и примерно в 5 раз менее активен, чем рацемическая форма в рецепторе. В испытаниях in vivo снотворный эффект продолжался в 10 раз короче, чем в случае рацемической формы, и в 15 раз короче, чем в случае S-энантиомера при введении мышам в приблизительно равных дозах. Абсолютным лидером в этих исследованиях был N3-фенацилуридин, который в 16 раз более эффективен, чем S-энантиомер соответствующего спирта в исследованиях по связыванию рецепторов. Мыши, обработанные N3-фенацилуридином, также спали на 20 % дольше, чем мыши, получавшие S-изомер 3-(2-гидрокси-3-фенилэтил)уридина в равных дозах. Эти данные представляются довольно интересными, поскольку соответствующие спирты оказались единственными фармакологически активными метаболитами N3-фенацилуридина у мышей [6]. Среди родственных соединений небольшое удлинение сна, вызванного пентобарбиталом, было также связано с урацилом, уридином и N3-фенацилурацилом (в порядке убывания).
Модификация рибозильной части и урацильного фрагмента N3-фенацилуридина, по-видимому, наносит ущерб снотворным свойствам соединений во время исследований in vivo. Замена рибозильного остатка его 2-дезоксианалогом, а также замена фрагмента урацила на тимидин или 6-азаурацил привели к резкой потере снотворной активности полученных соединений [7]. Некоторые гипнотические свойства сохранялись в случае 3-(4-фторфенил)-2'-дезокси-2'-фторуридина, что делает его и его близкие структурные аналоги более перспективными в качестве анти-ВИЧ-1, а не снотворных агентов [8].
Некоторые усилия были также предприняты в области синтеза и фармакологической оценки производных N3-фенацилуридина, в которых отсутствует сахарный фрагмент в положении N-1 ядра урацила, но вместо него имеются структурно разнообразные, главным образом, гетарилметильные группы [9]. Во время оценки в опытах in vivo этих серий соединений было установлено, что 1- [2-(метилсульфанил) этил]-, 1-(2- или 3-хлорбензил)-N3-фенацилурацилы проявляли свои собственные снотворные свойства.
Необходимо отметить, что несколько аналогов N3-фенацилуридина, содержащих различные заместители в ароматической части фенацильного фрагмента, продемонстрировали многообещающую антиноцицептивную активность, которая была наиболее очевидна в случае метоксилированных производных [10].
Важно отметить, что открытие N3-фенацилуридина и его характеристика в качестве средства, вызывающего сон, является хорошим примером рациональной структурно-основанного поиска лекарственных препаратов. Вся эта работа началась в середине 1980-х годов и велась одной и той же группой авторов все это время.
Принимая во внимание сильное влияние липофильности названных соединений на их свойства, вызывающие сон после введения инъекции, мы сосредоточили наше внимание на разработке новых структурных аналогов N3-фенацилуридина, содержащих менее гидрофильный заместитель вместо рибозильного фрагмента, но также имитирующих последний. Нам также было любопытно уменьшить степень стереохимической сложности названных соединений. Вот почему соответствующие ациклонуклеозид-ацетаты оказались структурами, выбранными для дальнейшего синтеза и исследования. Более того, эти соединения были признаны перспективными анти-ВИЧ-1 агентами, принимая во внимание этот тип активности N3-фенацил-2’-дезокси-2’-фторуридиновых аналогов [8]. Общий синтез целевых соединений состоял из следующих этапов:
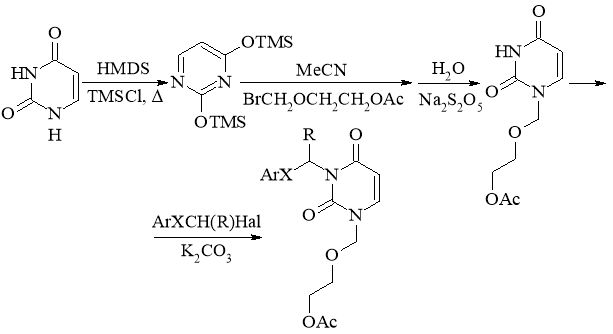
Ar = C6H5, 4-FC6H4, 4-MeOC6H4
X = C(O), S; Hal = Br, Cl
Примечательно, что α-бромпропиофеноны оказались гораздо менее реакционноспособными в этом синтезе, чем соответствующие α-бромацетофеноны, как показывает реакция ТСХ-мониторинга. Полная конверсия исходного ацетата ациклоуридина наблюдалась только после длительного кипячения в ацетонитриле с первыми. В случае менее стерически затрудненных α-бромацетофенонов реакция была завершена за гораздо более короткий период времени при комнатной температуре. Использование арил(хлорметил)сульфида в качестве алкилирующего агента было объяснено перспективной структурой названных соединений. С одной стороны, фенилсульфанильная группа гораздо более липофильная, чем бензоильная. С другой стороны, первый может подвергаться микросомальному окислению до сульфоксида, с получением биоизостера до фенацила с повышенной энантиоселективностью действия.
Все названные соединения в настоящее время изучаются как потенциальные индукторы сна (in vivo) и перспективные противовирусные препараты (in vitro).
Литература:
- Tanious, M. K. New Hypnotic Drug Development and Pharmacologic Considerations for Clinical Anesthesia / M. K. Tanious, S. S. Beutler, A. D. Kaye, R. D. Urman. — Текст: непосредственный // Anesthesiology Clinics. — 2017. — № 35(2). — С. e95-e113.
- N3-Phenacyluridine, a novel hypnotic compound, interacts with the benzodiazepine receptor / T. Kimura [и др.]. — Текст: непосредственный // European Journal of Pharmacology. — 1996. — № 311. — С. 265–269. T. Kimura, M. Miki, M. Ikeda, S. Yonemoto, K. Watanabe, S. Kondo, I. K. Ho and I. Yamamoto, Biol. Pharm. Bull.24, 729–731 (2001).
- Kimura, T. Uridine Receptor: Discovery and Its Involvement in Sleep Mechanism / T. Kimura, I. K. Ho, I. Yamamoto. — Текст: непосредственный // Sleep. — 2001. — № 24(3). — С. 251–260.
- Ralevic, V. Receptors for purines and pyrimidines / V. Ralevic, G. Burnstock. — Текст: непосредственный // Pharmacological Reviews. — 1998. — № 50(3). — С. 413–492.
- Metabolism of a novel hypnotic, N3-phenacyluridine, and hypnotic and sedative activities of its enantiomer metabolites in mouse / T. Kimura [и др.]. — Текст: непосредственный // Xenobiotica. — 2000. — № 30(6). — С. 643–653.
- Synthesis and Hypnotic and Anti-Human Immunodeficiency Virus-1 Activities of N3-Substituted 2’-Deoxy-2’-fluorouridines / Y. Sato [и др.]. — Текст: непосредственный // Chemical and Pharmaceutical Bulletin. — 1994. — № 42(3). — С. 595–598.
- Synthesis and hypnotic-sedative activities of N-substituted uracil on mice / T. Maruyama [и др.]. — Текст: непосредственный // Nucleic Acids Research Supplement. — 2003. — № 3. — С. 25–26.
- Synthesis of N3-substituted uridine and related pyrimidine nucleosides and their antinociceptive effects in mice / T. Shimizu [и др.]. — Текст: непосредственный // Chemical and Pharmaceutical Bulletin. — 2005. — № 53(3). — С. 313–318.
- Yamamoto, I. N3-benzyluridine exerts hypnotic activity in mice / I. Yamamoto, T. Kimura, Y. Tateoka, Watanabe,and,I,K K. — Текст: непосредственный // Chemical and Pharmaceutical Bulletin. — 1985. — № 33. — С. 4088–4090.
- Yamamoto, I. Hypnotic activity of N3-benzylthymidine on mice / I. Yamamoto, T. Kimura, Y. Tateoka, Watanabe,and,I,K K. — Текст: непосредственный // Journal of Medicinal Chemistry. — 1987. — № 33. — С. 4088–4090.

