Фенолы широко используются практически во всех областях промышленности и народного хозяйства. Все возрастающие количества фенолов нужны для производства пластмасс, создания ряда принципиально новых видов полимерных материалов, синтетического каучука, ядохимикатов для сельского хозяйства, поверхностно-активных веществ, получения пластификаторов, стабилизаторов для нефтепродуктов и многих других продуктов.
Увеличение потребности в фенолах объясняется как относительной дешевизной и доступностью этого сырья, так и уникальностью свойств многих продуктов переработки фенолов, особой ценностью их для ряда новых отраслей техники. Хотя темпы роста производства фенолоформальдегидных смол, например, и уступают темпам роста производства полиолефинов, но экономический эффект применения фенолоформальдегидных смол в народном хозяйстве выше, чем от использования большинства других полимерных материалов.
Масштабы потребления фенолов значительны, но для удовлетворения требований промышленности нужны не только фенол, но и нафтолы и разнообразные гомологи фенолов. Так, особенно существенно увеличилась потребность в смесях крезолов, индивидуальных крезолах и ксиленолах, в высших алкилфенолах и двухатомных фенолах. Развитие ряда новых производств привлекает внимание к организации крупнотоннажного выпуска двухатомных фенолов, 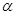 -нафтола, гомологов нафтолов. [3, с.7-8]
-нафтола, гомологов нафтолов. [3, с.7-8]
Оба нафтола (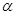 - и
- и 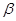 -) имеют большое техническое значение;
-) имеют большое техническое значение; 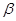 -нафтол является наиболее важным из простых промежуточных продуктов ряда нафталина. Нафтолы применяются в производстве азокрасителей в качестве азосоставляющих [2,с.111-112] и являются исходными продуктами для получения нафтолсульфокислот, которые также находят широкое применение в производстве азокрасителей. Кроме того,
-нафтол является наиболее важным из простых промежуточных продуктов ряда нафталина. Нафтолы применяются в производстве азокрасителей в качестве азосоставляющих [2,с.111-112] и являются исходными продуктами для получения нафтолсульфокислот, которые также находят широкое применение в производстве азокрасителей. Кроме того, 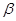 -нафтол является единственным, имеющим практическое значение, источником получения
-нафтол является единственным, имеющим практическое значение, источником получения 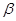 -нафтиламина и его производных, которые получаются из
-нафтиламина и его производных, которые получаются из 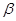 -нафтола и его сульфокислот реакцией Бухерера или нагреванием с аммиаком при высокой температуре. Нафтолы обладают характерным запахом, нерастворимы в разбавленных кислотах, умеренно растворимы в воде, хорошо - в щелочах и обычных органических растворителях; перегоняются с водяным паром. При нагревании нафтолы возгоняются [4,с.13]
-нафтола и его сульфокислот реакцией Бухерера или нагреванием с аммиаком при высокой температуре. Нафтолы обладают характерным запахом, нерастворимы в разбавленных кислотах, умеренно растворимы в воде, хорошо - в щелочах и обычных органических растворителях; перегоняются с водяным паром. При нагревании нафтолы возгоняются [4,с.13]
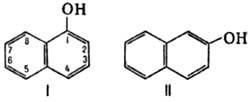
Рис. 1. Строение 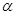 - и
- и 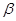 - нафтолов.
- нафтолов.
В промышленности 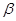 -нафтол и многие сульфокислоты
-нафтол и многие сульфокислоты 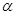 -нафтола получаются сплавлением со щелочами нафталин-
-нафтола получаются сплавлением со щелочами нафталин-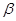 -сульфокислоты и соответствующих нафталинди- и нафталин-полисульфокислот. Более употребителен и выгоден способ аминирования оксисоединений нафталина посредством нагревания с сульфитом аммония и аммиаком. По химическим свойствам нафтолы сходны с фенолами, но более реакционноспособны. Например, они превращаются в эфиры при нагревании со спиртом и серной кислотой и образуют нафтиламины при нагревании с аммиаком и бисульфитом по Бухереру. [2, с.45-53]. Основные физические свойства
-сульфокислоты и соответствующих нафталинди- и нафталин-полисульфокислот. Более употребителен и выгоден способ аминирования оксисоединений нафталина посредством нагревания с сульфитом аммония и аммиаком. По химическим свойствам нафтолы сходны с фенолами, но более реакционноспособны. Например, они превращаются в эфиры при нагревании со спиртом и серной кислотой и образуют нафтиламины при нагревании с аммиаком и бисульфитом по Бухереру. [2, с.45-53]. Основные физические свойства 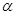 - и
- и 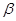 - нафтолов представлены в табл.1. Строение нафтолов объясняется строением нафталина, т.к. нафтолы являются производными соединений нафталинового ряда. Еще в 1868 г. были получены данные, согласно которым нафталин содержит два эквивалентных сконденсированных бензольных кольца, лежащих в одной плоскости.
- нафтолов представлены в табл.1. Строение нафтолов объясняется строением нафталина, т.к. нафтолы являются производными соединений нафталинового ряда. Еще в 1868 г. были получены данные, согласно которым нафталин содержит два эквивалентных сконденсированных бензольных кольца, лежащих в одной плоскости.
Строение нафталина было доказано по схеме:

Таким образом, было установлено, что оба кольца являются бензольными. Согласно экспериментальным данным нафталин по своим свойствам относится к ароматическим соединениям. С теоретической точки зрения нафталин имеет структуру, необходимую для того, чтобы быть ароматическим соединением: он содержит плоские шестичленные кольца и рассмотрение атомных орбиталей показывает, что его структура допускает образование p-облаков, содержащих 6 электронов - ароматический секстет. Десять атомов углерода расположены по углам двух сочлененных шестиугольников. Каждый атом углерода связан с тремя другими атомами s-связями. Поскольку они образуются при перекрывании тригональных sp2 -орбиталей, то все атомы углерода и водорода лежат в одной плоскости. Выше и ниже этой плоскости находится p облако, образующееся в результате перекрывания р-орбиталей, имеющее форму восьмерки. Рентгеноструктурный анализ показал, что в нафталине длина С-С связей различна. Энергия сопряжения 61 ккал/моль.
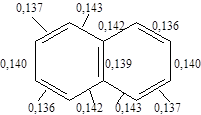
Для нафталина типичны реакции электрофильного замещения. p-Электронное облако является источником электронов, доступных для электрофильного реагента, который присоединяется к кольцу с образованием промежуточного карбониевого иона, при отщеплении от которого протона восстанавливается ароматическая система. Следует отметить, что связи 1,2 более похожи на двойные, чем 2,3. Связи 1,2 и 3,4 в нафталине в некоторой степени аналогичны сопряженной системе в 1,3-бутадиене. Это находит отражение как в определенной активности a-положений к электрофильным реагентам, так и в реакциях присоединения, характерных для диеновых углеводородов. При вступлении электрофильного реагента в a-положение возникающий промежуточный s-комплекс более энергетически выгоден в сравнении с s-комплексом, образующимся при атаке b-положения.
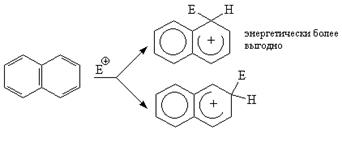
Таким образом, нафтолы во многих реакциях похожи больше на резорцин, чем на фенол. Такая реакционная способность связана с особыми свойствами 1,2-связи нафталинового ряда, более короткой (менее насыщенной), чем любая из связей в бензольном кольце. [2, с.13-26].
Физические свойства нафтолов.
Таблица 1.

Cинтез 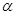 -нафтола по Фитингу и Эрдману нагреванием фенилизокротоиовой кислоты – пример интрамолекулярной циклической конденсации [1, с.406]:
-нафтола по Фитингу и Эрдману нагреванием фенилизокротоиовой кислоты – пример интрамолекулярной циклической конденсации [1, с.406]:
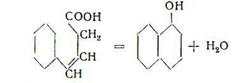
Фенолы способны вступать в многообразные химические реакции как по гидроксильной группе, так и по ароматическому кольцу. Химические, как и физические свойства фенолов определяются в значительной мере существованием статического эффекта взаимодействия между фенольным гидроксилом и ароматическим кольцом.
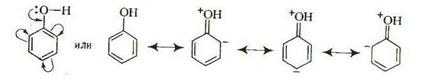
В результате эффекта сопряжения за счет электронов атома кислорода электронная плотность в орто- и пара-положениях ароматического ядра возрастает и не только облегчается отрыв водородного атома гидроксильной группы, но и активируется бензольное кольцо.
Характерные реакции фенолов и нафтолов:
1. Реакции фенольной гидроксильной группы.
Вследствие существования индукционного эффекта фенильной группы и сопряжения между кислородом гидроксильной группы и ароматическим кольцом, фенол является на несколько порядков более сильной кислотой, чем вода, и, тем более, спирты жирного ряда. На силу кислотности влияет положение и природа заместителей в кольце. Электроноакцепторные заместители увеличивают кислотность фенолов, электронодонорные – уменьшают ее. Поэтому хлорфенолы и нитрофенолы – значительно более сильные кислоты, чем фенол, а алкилфенолы имеют меньшие константы кислотности.
Нафтолы являются несколько более сильными кислотами, чем фенолы, благодаря усилению сопряжения за счет дополнительного бензольного кольца.
Способность большинства фенолов образовывать водорастворимые соли со щелочами широко используется для выделения фенолов из смесей с другими органическими веществами и для очистки фенолов. Высокая реакционная способность фенолят-иона делает целесообразным проведение многих реакций именно с фенолятами, а не с фенолами. [4, с.23-25].
Важность процесса аминирования определяется доступностью ряда фенолов и нафтолов и их невысокой стоимостью. Сущность реакции состоит в замене оксигруппы на аминогруппу при взаимодействии фенолов с аммиаком или солями аммония:
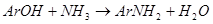
В простейшем варианте аминирование проводят при нагревании фенолов с водным или спиртовым раствором аммиака в автоклаве. Вместо аммиака применяют и легко гидролизуемые соли аммония (хлорид, карбонат, бикарбонат и, особенно, сульфит). Возможно проведение реакции не только в жидкой, но и в паровой фазе при пропускании смеси паров фенолов и аммиака над катализатором [5, с.35-44].
Условия аминирования сильно зависят от природы фенола. Так, анилин или дефиниламин удается получить только при температурах выше 300°С в присутствии соединения хлористого цинка с аммиаком
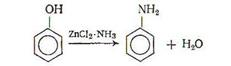
или при использовании катализаторов на основе окиси алюминия с добавкой соли щелочного металла [5, с.83-86].
Наиболее широко аминирование применяют для перевода сравнительно дешевого и доступного  -нафтола и его производных в
-нафтола и его производных в  -нафтиламин и его производные:
-нафтиламин и его производные:
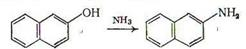
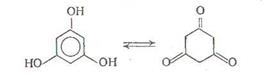
Особенно часто аминирование проводят при нагревании нафтола в автоклаве с водным раствором сульфита аммония при 100-150°С (реакция Бухерера). Вероятно, кето-енольная таутомерия, в принципе возможная для фенолов, определенным образом влияет на прохождение аминирования: не случайно, легче всего идет аминирование флороглюцина, у которого кето- и енольная форма энергетически равноправны [4, с.608].:
2. Реакции по ароматическому кольцу фенолов.
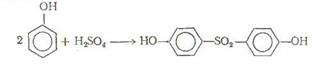
Сульфирование фенолов и нафтолов протекает в относительно мягких условиях. Состав (изомерный) образуюшихся сульфокислот фенолов и нафтолов зависит от температуры реакции. Так, при комнатной температуре сульфирование фенола приводит в основном к получению о-фенолсульфокислоты, тогда как при 100°С преимущественно получают п-фенолсульфокислоту. Ужесточение условий сульфирования дает 2,4-дисульфокислоту. При сульфировании избытком серной кислоты или олеумом удается с достаточно высоким выходом получить ди-(окисфенил)-сульфон, представляющий интерес как дубитель для термостойких смол.
Особое значение имеют сульфокислоты нафтолов, главным образом  -нафтола, являющиеся важнейшими полупродуктами в производстве красителей. Изменение темпе-ратуры и подбор сульфирующих агентов позволяет получать различные изомерные сульфокислоты нафтолов. Ниже приведены различные направления сульфирования
-нафтола, являющиеся важнейшими полупродуктами в производстве красителей. Изменение темпе-ратуры и подбор сульфирующих агентов позволяет получать различные изомерные сульфокислоты нафтолов. Ниже приведены различные направления сульфирования 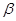 -нафтола, ведущие к получению различных полупродуктов для анилино-красочной промышленности:
-нафтола, ведущие к получению различных полупродуктов для анилино-красочной промышленности:
Нитрование фенолов также приводит к смеси о- и п-мононитрофенолов. Эта смесь может быть разделена вследствие большей летучести орто-изомера, образующего внутримолекулярный хеллат.  - Нафтол, его ацетил- и другие
- Нафтол, его ацетил- и другие
о-замещенные производные нитруются сначала в положения 2 и 4; при дальнейшем нитровании получаются 2,4-динитро-, а также 2,4,5- и 2,4,7-тринитропроизводные.  -нафтол нитруется сначала в положение 1, а затем в положение 6. Кроме того, нитронафтолы получаются из галоиднитронафталинов омылением щелочами, а также из нитронафтиламинов путем замены аминогруппы на гидроксил при постепенном приливании раствора диазотированного амина к раствору серной кислоты. Избыток азотистой кислоты часто предварительно разрушают мочевиной, но это не всегда дает хорошие результаты. Подобно нитрофенолам, нитронафтолы обладают кислотными свойствами. Те из них, в которых имеется нитрогруппа в положении 2, окрашивают шерсть и шелк в ярко-желтый цвет.
-нафтол нитруется сначала в положение 1, а затем в положение 6. Кроме того, нитронафтолы получаются из галоиднитронафталинов омылением щелочами, а также из нитронафтиламинов путем замены аминогруппы на гидроксил при постепенном приливании раствора диазотированного амина к раствору серной кислоты. Избыток азотистой кислоты часто предварительно разрушают мочевиной, но это не всегда дает хорошие результаты. Подобно нитрофенолам, нитронафтолы обладают кислотными свойствами. Те из них, в которых имеется нитрогруппа в положении 2, окрашивают шерсть и шелк в ярко-желтый цвет.
Характерной реакцией для фенолов и их эфиров является азосочетание:
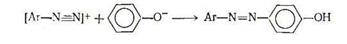
Важную роль играет кислотность реакционной среды, поскольку ионы диазония относительно устойчивы лишь в кислой среде, однако кислота подавляет ионизацию фенола и усложняет азосочетание. Практически азосочетание проводят в слабощелочной среде. Азосочетание с фенолами и нафтолами (и их замещенными) приводит к получению ряда практически ценных красителей. [4, с.34-35]
Формальдегид, сульфит и ароматичесике оксисоединения легко образуют  -сульфометилпроизводные, подобно тому как бисульфитное соединение формальдегида может служить для введения
-сульфометилпроизводные, подобно тому как бисульфитное соединение формальдегида может служить для введения  -сульфометильного остатка в аминогруппу, например
-сульфометильного остатка в аминогруппу, например 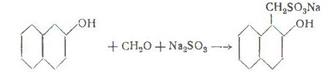
Сложными эфирами фенолов являются и карбаматы, образующие новый важный класс ядохимикатов. Ниже представлена схема получения одного из важных ядохимикатов N-метилкарбамата 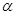 -нафтола:
-нафтола:
Принципиально возможно получение сложных эфиров фенолов с неорганическими кислотами и прямым взаимодействием при высоких температурах в присутствии водоотнимающих средств. Однако очень жесткие условия проведения этого процесса и относительно невысокий выход целевого продукта препятствуют широкому использованию такого подхода.
В промышленности фенол начали получать со второй половины 19 в. из каменноугольной смолы. В то время все его производство составляло всего несколько сот тонн в год. В настоящее время только за рубежом ежегодно производится 2 млн.т. фенола, из которых более 80% приходится на долю более развитых европейских стран. Особенно бурно развивалось производство фенола в истекшее десятилетие. За этот период среднегодовые темпы прироста продукции составили: по европейским странам – 18%, по США – 10%. Аналогичные темы прироста фенола наблюдаются и в нашей стране. Коксохимическая промышленность давно уже перестала удовлетворять потребность в феноле и в настоящее время основное его количество получают синтетическим путем. Особенности потребления фенола в некоторых странах не меняют общей тенденции в развитии структуры его потребления, и эта структура свидетельствует о перспективности дальнейшего развития производства этого одного из важнейших продуктов основного органического синтеза.
В России, как и в других странах, примерно 50 % фенола расходуeтся на производство различных полимерных продуктов. В будущем, по-видимому, существенного изменения в структуре потребления фенола не произойдет. Ожидаются лишь более высокие темпы производства дифенилолпропана и химических средств защиты растений.
Потребности в  - и
- и  - нафтолах должны, по-видимому, удовлетворяться за счет окисления тетралина и сульфирования нафталина. Расширение мощностей существующих и создание новых производств позволит полностью удовлетворить потребности в указанных продуктах.
- нафтолах должны, по-видимому, удовлетворяться за счет окисления тетралина и сульфирования нафталина. Расширение мощностей существующих и создание новых производств позволит полностью удовлетворить потребности в указанных продуктах.
Список использованной литературы.
1. Ворожцов Н.Н. Основы синтеза промежуточных продуктов и красителей. ГХТИ ОНТИ М. 1934, 539 с.
2. Дональдсон. Химия и технология соединений нафталинового ряда. ГНТИХЛ, М:1963 г.
3. Темникова Т.И. Курс теоретических основ органической химии. Изд. 3-е. Л. «Химия», 1968 г., 1008 с.
4. Харлампович Г.Д., Ю.В. Чуркин. Фенолы. Издательство «Химия», М: 1974 г.
5. Becker M., Russel J.Chem. Eng. 1973 v 80 №8, p.42-43.

