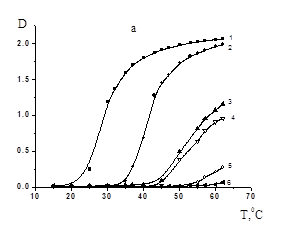Ранее [1] методом радикальной сополимеризации были получены новые термочувствительные сополимеры на основе 2-гидроксиэтилакрилата (ГЭА) и бутилакрилата (БА). Методом ЯМР(Н1) - и (С13) -спектроскопии определены составы сополимеров (СПЛ), найдены константы сополимеризации. Показано, что СПЛ ГЭА-БА характеризуются наличием нижней критической температуры растворения (НКТР) в воде, значение которой удается регулировать, варьируя содержание гидрофобного БА в составе СПЛ. В работе [2] методами турбидиметрии и вискозиметрии исследовано взаимодействие СПЛ ГЭА-БА с полиакриловой кислотой (ПАК) в водных растворах. Установлено образование интерполимерных комплексов (ИПК) посредством кооперативной системы водородных связей, при этом обнаружено, что с увеличением содержания БА в СПЛ состав поликомплексов приближается к эквимольному.
В данной работе исследовано влияние ПАК на термочувствительное поведение СПЛ ГЭА-БА в водных растворах.
Экспериментальная часть
ГЭА производства фирмы «Aldrich Chemical Co» (США) с содержанием основного продукта 99% очищали двукратной перегонкой.
БА производства фирмы «Fluka Chemica» (Швеция) с содержанием основного продукта 96% очищали двукратной перегонкой.
ПАК со средневесовой молекулярной массой 2.0´103, 1.0´105, 2.5´105 и 7.5´105 производства фирмы “Aldrich Chemical Co" (США) использовали без дополнительной очистки.
СПЛ ГЭА-со-БА синтезировали методом радикальной полимеризации ГЭА с БА (исходные составы мономерной смеси 93:7 и 95:5 мол.%) при температуре 333К в присутствии инициатора динитрилазобиссизомасляной кислоты. Реакционную смесь предварительно продували аргоном. После выделения и очистки СПЛ сушили в вакуумном шкафу при комнатной температуре до постоянной массы.
Составы СПЛ определяли методом ЯМР(1H и 13С)-спектроскопии (ЯМР-спектрометр Bruker ARX300 (Германия).
Оптическую плотность растворов СПЛ измеряли на спектрофотометре «UV-2401PC» («Shimadzu», Япония) при l=400 нм, термостатирование осуществляли с помощью термоэлектронного регулятора кювет «CPS-240A Shimadzu» (Япония).
pH растворов определяли на цифровом иономере "Ion Meter 3345" (Jenway LTD., UK) и регулировали добавлением небольших количеств 0.1 М растворов HCl или NaOH.
Результаты и их обсуждение
Процессы образования ИПК характеризуются рядом критических явлений, проявляющихся в существенной зависимости свойств системы от незначительного изменения различных параметров внешней среды. Так, еще в первых обзорных работах [3, 4] было показано существование нижнего и верхнего пределов молекулярной массы полимера, ниже и выше которых, процесс комплексообразования либо не происходит, либо формирующиеся комплексы характеризуются низкой стабильностью. При этом, по мнению ряда авторов [5], образование ИПК в водных растворах возможно лишь ниже определенной критической величины рН (рНкрит), поскольку в структуре поликарбоновых кислот способность к образованию водородных связей проявляют лишь неионизованные карбоксильные группы.
Критические значения рН комплексообразования зависят от природы взаимодействующих макромолекул, концентрации, ионной силы и других внешних и внутренних факторов системы. В связи с этим ранее авторами [6] было предложено использовать значения критических рН комплексообразования в качестве количественного критерия способности системы неионогенный полимер - поликарбоновая кислота к образованию интерполимерного комплекса (ИПК). Увеличение рНкрит, свидетельствует об усилении способности макромолекул к образованию ИПК, и наоборот, сдвиг данной величины в область более низких рН указывает на снижение комплексообразующей способности системы. Это позволяет установить ряд основных закономерностей по влиянию различных факторов на устойчивость поликомплексов, образованных водородными связями в водном растворе.
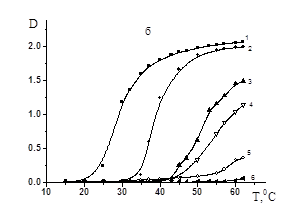
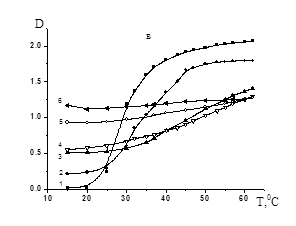
В данной работе исследовано влияние ПАК на термочувствительное поведение СПЛ ГЭА-ВБЭ. При этом варьировались соотношения полимеров, молекулярная масса ПАК, а также рН раствора. На рисунке 1 представлены данные турбидиметрического исследования влияния соотношения ПАК/СПЛ для поликислоты с различной ММ на фазовое разделение растворов СПЛ без регулирования рН. Видно, что присутствие ПАК и дальнейшее увеличение ее содержания поликислоты в смеси сдвигает температуру фазового разделения (Тфр) в область более высоких значений. Можно предположить, что наблюдаемые эффекты обусловлены формированием в данных условиях гидрофильных ассоциатов с множеством свободных сегментов ПАК с высокой плотностью заряда, что делает их более гидрофильными и агрегирующими лишь при относительно высоких температурах. Ранее в работе [7] было показано, что образование гидрофильных ассоциатов, объем которых превышает аддитивный объем исходных полимерных компонентов, возможно в области рН, незначительно превышающих критическую величину рН комплексообразования (рНкрит). Видно, что нет существенной разницы в фазовом поведении смесей ПАК/СПЛ с ММ поликислоты 1,0´105 и 2,5´105. Однако при переходе к ПАК с ММ=7,5´105, даже при относительно низких температурах (ниже 20°C) растворы являются мутными, что свидетельствует о формировании нерастворимых ИПК более гидрофобных по сравнению с исходными полимерными компонентами.
|
|
|
|
| |
МM(ПАК) = 1,0´105 (a), 2,5´105 (б), 7,5´105 (в); [ПАК]/[СПЛ]: 0(1); 0,08(2); 0,16 (3); 0,2(4); 0,5(5); 1(6); [ГЭА]:[БA]=93,3:6,7 мол.%, [ГЭА-БА]=0,02 моль/л.
Рисунок 1. Зависимость оптической плотности водных растворов ГЭА-БА–ПАК от температуры при различных соотношениях ПАК/СПЛ
Известно, что на взаимодействие неионного протоноакцепторного полимера с поликарбоновой кислотой существенное влияние оказывает рН среды. В связи с этим можно предположить, что характер влияния ПАК на термочувствительность СПЛ ГЭА-БА будет также в значительной степени зависеть от кислотности раствора. Действительно, как видно из данных рис. 2, в зависимости от рН присутствие ПАК приводит как к повышению, так и снижению температуры фазового разделения (рис.4а, б, в, г). В то же время в растворах с рН<рНкрит (рисунок 4, рН=2,2 и 2,5) наблюдается формирование компактных нерастворимых ИПК при любой температуре с более высокой гидрофобностью по сравнению с исходными полимерами. С увеличением температуры уменьшается мутность данных растворов, что вероятно связано с коагуляцией поликомплексов.
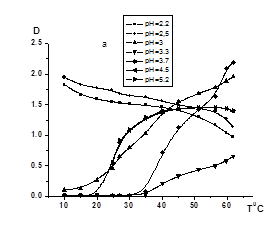
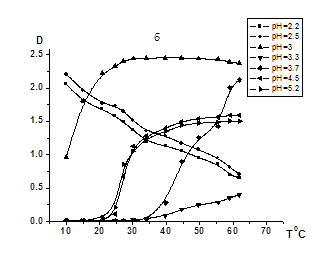
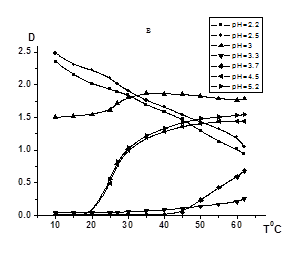

[ПАК]/[СПЛ]=0,08 (a), 0,16 (б), 0,5 (в), 1(г); [ГЭА]:[БА]=93,3:6,7 моль.%;
МM(ПАК)= 2,5´10-5.
Рисунок 2. Зависимости оптической плотности водных растворов ГЭА-БА – ПАК температуры при различных значениях рН и соотношений [ПАК]/[СПЛ]
При рН=3 система остается мутной при низких температурах (10-20°С), но дальнейшее нагревание приводит к повышению мутности. Это позволяет предположить, что в данных условиях некоторые фрагменты СПЛ ГЭА-БА не связаны в комплекс с ПАК за счет водородных связей и могут проявлять НКТР, приводящюю к агрегации с повышением температуры. При переходе к растворам с рН 3,3 и рН 3,7 присутствие ПАК способствует повышению Тфр. Следовательно в этой области рН имеет место формирование межмакромолекулярных ассоциатов ПАК-СПЛ, более гидрофильных по сравнению с исходными компонентами, причем этот эффект возрастает с повышением содержания поликислоты в растворе.При высоких значениях рН раствора (рН=4,5 и 5,2), в области, в которой уже невозможно взаимодействие неионного полимера с поликарбоновой кислотой из-за высокой степени диссоциации карбоксильных групп ПАК, ее присутствие практически не оказывает влияния на термочувствительность СПЛ ГЭА-БА. В этих условиях температура фазового разделения соответствует Тфр., характерной для СПЛ ГЭА-ВБЭ в отсутствии ПАК.
Таким образом, в работе исследовано влияние ПАК на фазовое поведение смесей водных растворов ПАК/СПЛ ГЭА-БА при различных температурах.
Литература
1. Бейсегул А.Б., Уркимбаева П.И., Мун Г.А., Нигм С.М., Нуркеева З.С. Новые термочувствительные сополимеры 2-гидроксиэтилакрилата и бутилакрилата и интерполимерные реакции с их участием// Международный симпозиум восточно-азиатских стран по полимерным композиционным материалам и передовым технологиям, г.Саратов, сентябрь, 2005, С.10-13.
2. Бейсегул А.Б.,Уркимбаева П.И., Мун Г.А.,Нуркеева З.С. Поликомплексы сополимеров 2-гидроксиэтилакрилата и бутилакрилата с полиакриловой кислотой и влияние различных факторов на их устойчивость// Вестн. КазНУ, Серия химическая №2(42), Алматы, 2006, С.39-43.
3. Кабанов В.А., Паписов И.М. Комплексообразование между комплементарными синтетическими полимерами и олигомерами в разбавленных растворах // Высокомолек. соед. 1979. Т.21А. № 2. С. 244.
4. Bekturov E.A., Bimendina L.A. Interpolymer complexes // Adv. Polym. Sci. 1981. V.41. P.99.
5. Tsuchida E., Abe K. Interactions between macromolecules in solution and intermacromolecular complexes // Adv. Polym. Sci. 1982. 45. P.1.
6. Nurkeeva Z. S., Mun G. A., Khutoryanskiy V. V. Interpolymer Complexes of Poly(glycol vinyl ethers) and Related Composite Materials (Review)// Polymer Sci., Т.43Б, №3, С.146-155, 2001.
7. Khutoryanskiy V.V., Dubolazov A.V., Nurkeeva Z.S., Mun G.A. pH Effects in the Complex Formation and Blending of Poly(acrylic acid) with Poly(ethylene oxide)//Langmuir, 2004, 20, С.3785-3790.