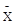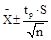Для фотометрического определения германия предложены органические реагенты реакции с которыми на образовании германгетерополикислот [1], для определения малого содержания германия триоксифлороны [4], и диоксиазосоединения [5,6]. Наибольшее практическое применение нашли фенилфлорон [7] и динитропирокатехин ализарина [8,9].
Введение в фенольное ядро реагента электроотрицательных заместителей позволяет снизить влияние внешних факторов на результаты анализа, сделать более действенными причины устранения мешающего влияния, создает условия повышение точности анализа. Исходя их этих теоретических положений нами синтезирован реагент 2,2/,3,4 – тетраокси- 3 –сульфо-азобензол. Где х - остаток неорганической кислоты.
Настоящее исследование посвящено фотометрическому изучению взаимодействия германия (IV) с 2,2/,3,4 – тетраокси 3/-сульфо-азобензола (тетраоксазена SH) этим реагентом и разработка методики определения его в полупроводниках.
Экспериментальная часть
Использовали 1×10-3 М раствор соли германия, который готовили растворением навески GeO2 в воде. Содержание германия устанавливали титриметрически, используя пирокатехин [10]. 1×10-3м водный раствор тетраоксазена СН готовили растворением навески в воде. Контроль над чистотой реагента проводили методом электрофореза. Все исследования проводили при постоянной ионной силе(m=0,1), которую создавали с помощью раствора NaCl. Для создания необходимой кислотности среды использовали ацетатно-аммиачные буферные растворы.
Значения рН контролировали на потенциометре рН 121 со стеклянным электродом. Оптические плотности растворов измеряли на спектрофотометре СФ-4А и фотоэлектроколориметре ФЭК-56 М в кювете с l= 1 см.
Изучение спектров поглощения реагента и комплекса его германием (IV), (рис. 1), а также влияния рН на комплексообразование (рис 2) позволило определить оптимальные условия реакции и рассчитать спектрофотометрические характеристики (Табл. 1).
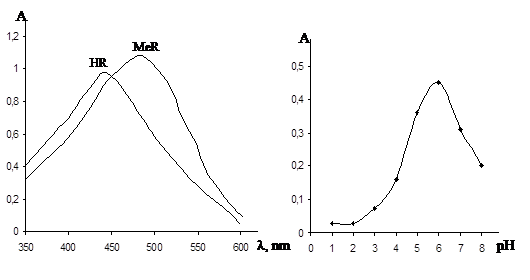 |
Рис.1 зависимости оптической плотности Рис.2 зависимости оптической
реагента и комплекса от длини волны плотности комплекса от рН
Соотношение компонентов в комплексе устанавливали методами изомолярных серий, насыщения, Старика-Барбанеля . Для определения числа протонов, выделяющихся при комплексообразовании, использовали метод Астахова [11].
В оптимальных условиях реакции построен калибровочный график для определения германия, уставлены интервалы определяемых концентраций и нижний предел обнаружения. Изучена избирательность определения германия (IV),часто сопутствующих ему элементов, а также ряда маскирующих веществ (табл. 2).
Результаты и их обсуждение
При взаимодействии ионов германия (IV) с реагентом образуется окрашенные в красный цвет комплексное соединение с оптимальными условиями образования(рНопт 4,0 и l=490 нм). Максимальное поглощение реагента наблюдается при 410 нм. Окраска комплекса развивается в течение 10 мин и устойчива более суток при нагревании до 800С не разрушается. Комплексообразование сопровождается батохромным смещением полосы максимального поглощения на 80 нм (рис. 1). Молярный коэффициент погашения комплекса равен 39750, а реагента-5000, что обеспечивает достаточно высокую чувствительность реакции, отношение EMеR/HНR, характеризующие фотометрическую чувствительность реакции, равно 8,0. Комплекс устойчивости в растворе, не требуется введения стабилизаторов, что является существенным преимуществом реагента перед широко применяемым в настоящее время фенилфлуоранами [8].
Для установления химизма реакции рассчитывали процентное содержание возможных ионных форм реагента и германия (IV) в зависимости от рН. Установлено, что при оптимальном значении рН равном 4,0 доминирует реагент в виде H3R2- а германия в виде Ge(OH)22+ и [GeO3]2-. Известно, что содержание германия в катионной и анионной формах в интервале рН 2-4 примерно одинаковы. На основании полученных результатов, а именно комплекса, как установлено нами, имеет отрицательный заряд, соотношение компонентов равно 1:1, число ионов водорода вытесняемых при взаимодействии n=2, установили, что в комплексообразовании участвует катион Ge(OH)22+.Следовательно, уравнение реакции взаимодействия германия (IV) с тетраоксиазоном CN может быть представлено в виде.
H3R2- + Ge(OH)22+⇄[HR Ge(OH)2]2- + 2H+
Константа устойчивости комплекса рассчитывать согласно выражению: Значение b рассчитывали на основании результатов метода насыщения. Равновесные концентрации реагента и металла находили согласно уравнениям материального баланса, с учетом побочных реакций протонизирования реагента и констант образования гидроокиси германия [12]. Установлено, что реагент реагирует с германием в соотношении 1:1. Изучение избирательности реакции, показало, что определению не мешают следующие элементы: Na, K-1:1000, Ca, Mg, Ba, Sr-1:500, U, Co, Cr, Mn, Ni, Cd, Pb- 1:300, Fe(II),Se, Te, Si-1:250, Bi, Th-1:100, Ti, Sn, Zr, Cu, Al-1:25, Fe(III)-1:10.Fe(III) + аскорбиновая кислота – 1:190; а также галогениды, фосфаты, роданиды, тиомочевина и аскорбиновая кислота – 1:1000.
Сравнивая избирательность определения германия 2,2/,3,4 - тетраокси- 3/-сульфо-5/-нитроазобензолом с наиболее эффективными реагентами фенилфлуороном (4), показало преимущество предложенного нами реагента. Т.к. при работе с фенилфлуорона требуется отделение германия от мешающих элементов отгонкой его тетрахлорида из 6 и растворов соляной кислоты или экстракцией.
По сравнению с резарсоном (5), 2,2/,3,4 - тетраокси- 3/-сульфо-5/-нитроазобензолом более избирателен по отношению к Zr, In, Sn, Cr, Fe, Co, Cu разработанный метод применен для определения германия в силикатах и полупроводниках.
Определение германия в полупроводниках № 35 и № 36. Процентное содержание компонентов в сплавах составляет: Ge-8 и 4% остальное Te и In.
Ход анализа: навеску сплава 0,1 г растворяли в 10 мл царской водки 3HCl+HNO3 в стакане емкостью 200 мл при нагревании 100-150 мл воды и нагревали до кипения. Раствор охлаждали и переносили в колбу емкостью 500 мл и доводили до метки водой.
Аликвотную часть (0,5-2,0 мл) анализируемого раствора переносили в колбу емк.25 мл, добавляли 2 мл 0,1 М раствора аскорбиновой кислоты 3 мл 1×10-3 М водного раствора 2,2/,3,4 - тетраокси- 3/-сульфо-5/-нитроазобензолом и доводили объем до метки буферным раствором с рН 4. содержание германия находили по градуровочному графику. Для его построения в 6 колб емк. 25 мл вводили 5,10,20,40,60, 80 мкг германия, 3 мл 1×10-3 м _водные раствором реагента и доводили до метки буферными растворами, имеющие рН 4. Измеряли оптическую плотность растворов при 490 нм в кювете с l=1см на фоне реагента. Результаты определения приведены в табл.
Определение германия в полупроводниках
(n=10. P=0.95)
|
№ сплава |
СодержаниеGe, % |
Найдено Ge, %
|
Sr |
|
|
34 |
8,0 |
8,1 |
0,02 |
8,1 ±0,05 |
|
35 |
5,0 |
4,8 |
0,03 |
4,8 ±0,03 |
Выводы
Исследована новая реакция германия с моноазосоединением на основе пирогаллола. Выход комплекса максимален при рН 4,0; l= 490 нм; соотношение Ge:R=1:1. Молярный коэффициент погашения при рН 4 равен 497500. Изучена избирательность реакции, разработаны методики определения германия в чистых солях, искусственных смесях и полупроводниках.
Литература:
- Wang Zhendi, Zheng Yongxi, Xuaxue Tongbao 1983,7, 19-22
- Monoe Pilar, V.J.Carlos, P.Francisco. Analyst, 1985, 110(6) pp.747-749
- Zheng J., Cao Benhoug, Wang Yougxian. Fenxi shiyanshi 1995, 14(2)
- Sato Shigeya, Tanaka Hiroyuki. Talanta 1989, 36(3), pp. 391-394
- Chen Ruohua, Qiang Hong, Ji Fei, Gu Xuexin. Micro chem, 2000, 64(1), 93-97
- Korolkova V.S., Kutner E.A., Gudriniece E. Lat. PSR Zinat, Akad. Vestis. Kim. Ser., 1988(1) pp.87-90
- Aliyeva R.A., Guseyinov A.Г., Azerb. Khim Zh. 1987(2)
- Li Day, Li Yongbo, Chen Min-Fang. Guangpu Shiyanshi, 2000, 17(3), pp.367-369
- Frist J., Getrost H (1975). Organische Reagenzien fur die Spurenanalyse. E.Merck, Darmstadt, 1975.
- Heinz – Helmut Perkampus. UV-VIS Spectroscopy and its Applications. Springer-Verlad, Berlin, New York, London, Paris, Tokyo, Budapest. 1992.
- Коростолев, М.И.Булатов, И.П.Калинкин. Практическое руководство по фотометрическим методом анализа. Ленин.: Химия, 1986, 432с.
- Назаренко В.А., Антонович В.Н., Невская Е.М. Гидролиз ионов металлов в разбавленных растворах. М. Атомиздат, 1979, 192 с.