Комплексообразование в системе Zr(SO4)2 — лимонная кислота по данным рН-метрии
Авторы: Айсувакова Ольга Павловна, Глушихина Елена Игоревна, Безрядин Сергей Геннадьевич
Рубрика: 4. Неорганическая химия. Комплексные соединения
Опубликовано в
Дата публикации: 25.06.2015
Статья просмотрена: 347 раз
Библиографическое описание:
Айсувакова, О. П. Комплексообразование в системе Zr(SO4)2 — лимонная кислота по данным рН-метрии / О. П. Айсувакова, Е. И. Глушихина, С. Г. Безрядин. — Текст : непосредственный // Современная химия: Успехи и достижения : материалы I Междунар. науч. конф. (г. Санкт-Петербург, июль 2015 г.). — Санкт-Петербург : Свое издательство, 2015. — С. 42-49. — URL: https://moluch.ru/conf/chem/archive/122/8204/ (дата обращения: 20.04.2024).
Методом рН-метрии изучено образование комплексов Zr(IV) c лимонной кислотой в водных растворах. При эквимолярном соотношении реагентов в системе обнаружены комплексы состава 1:1 и 4:4 различной степени протонизации. Показано, что моно- и тетраядерные формы существуют в равновесии во всем изученном диапазоне значений рН. Рассчитаны константы устойчивости и построены графики долевого накопления комплексов.
Ключевые слова: комплексообразование, растворы, рН-метрия, цирконий(IV), лимонная кислота.
Цирконий(IV) образует большое количество комплексных соединений с самыми разнообразными лигандами: карбоновыми кислотами, оксиантрахинонами, ЭДТА, галогенид- и сульфат ионами, β-дикетонами и т. д. Лимонная, винная, яблочная кислоты, препятствующие осаждению ионов циркония(IV) из растворов, являются весьма распространенными маскирующими агентами [1, с. 45]. Комплексы циркония(IV) с полифенолами и оксикарбоксилатными лигандами выполняют функцию высокоселективных реагентов в фотометрическом анализе [2, с. 172]. Однако литературные данные о составе и константах устойчивости многих комплексов циркония (IV) достаточно противоречивы и требуют более тщательно изучения.
Отличительной чертой соединений Zr(IV) является склонность к гидролизу, что приводит к выпадению осадков из водных растворов. Однако некоторые координационные соединения этого элемента относительно устойчивы к гидролизу в водных растворах даже в нейтральной и щелочной среде [3, с. 47]. Цитраты циркония (IV) — предмет настоящего исследования — представляют собой одну из таких групп соединений. Но до настоящего времени ряд вопросов, касающихся полимеризации и гидроксополимеризации ионов Zr(IV) в присутствии оксикарбоновых кислот оставался без должного внимания, хотя гидроксополиядерные соединения представляют большой интерес для решения проблемы смешаннолигандного комплексообразования в целом. Поэтому в задачу настоящего исследования входило изучение процессов образования моно- и полиядерных комплексов циркония(IV) c лимонной кислотой в широком диапазоне концентраций рН, ионов металла и лиганда.
Объектами исследования являлись комплексы Zr (IV) с лимонной кислотой (H4Cit). В качестве источника циркония(IV) использовался сульфат циркония (IV), полученный из оксохлорида циркония(IV) ZrOCl2·8H2O «хч», который очищался от примесей перекристаллизацией из 25 %-ного раствора соляной кислоты [4, с. 1470]. Лимонная кислота квалификации «чда» использовалась без дополнительной очистки. Стандартизацию раствора сульфата циркония проводили комплексонометрически с ксиленоловым оранжевым [5, с. 109]. Точную концентрацию лиганда определяли титрованием стандартным раствором гидроксида натрия в присутствии тимолового синего [6, с. 186].
Для получения однозначной модели комплексообразования и выявления полиядерных комплексных форм нами исследован широкий диапазон концентраций 0.0013–0.0200 моль/л по металлу и 0.0014–0.0210 моль/л по лиганду для следующих соотношений реагентов 1:1. Моделирование равновесий в системе Zr(SO4)2 — лимонная кислота проводилось на основании данных рН-метрического титрования. Так как равновесие в исследуемой системе устанавливается быстро, для изучения реакций комплексообразования использовался метод непрерывного титрования (титрование длится несколько часов; время установления воспроизводимых значений стеклянного электрода — не более 15 мин). Изучение комплексообразования в системе проводили в среде аргона. Активность протонов определяли на рН-метре «pH 213» (Hanna Instruments, USA) с точностью 0.005 ед. pH. Температуру рабочих растворов поддерживали на уровне t = 25 ± 0.1 0С.
Для моделирования равновесий в системе цирконий(IV) — лимонная кислота использовался программный продукт CPESSP [7, с. 30]. Достоверность полученных результатов оценивали по критерию Фишера Fpr.
Формирование выборки начинали с модели, включающей комплексы состава 1:1. Затем уточняли модель введением элементов 2:2 и 4:4. Для расчета использовали литературные значения констант образования гидроксокомплексов циркония(IV) [8, с. 94] и констант диссоциации лимонной кислоты [9, с. 237].
На рисунке 1 приведены зависимости функции Бъеррума ñ [10, с. 68] от рН при различных концентрациях ионов металла и лиганда. Как видно из представленных кривых величина функции Бъеррума при фиксированном значении рН в кислой, нейтральной и слабощелочной области увеличивается с ростом концентрации циркония. Такое поведение кривых можно объяснить образование комплексных форм различной ядерности.
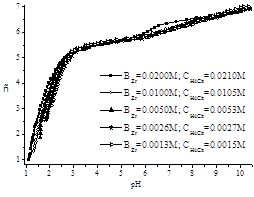
Рис 1. Зависимость функции Бьеррума от рН в системе Zr(IV) — лимонная кислота при соотношении реагентов 1:1 (ВZr = 0.0013–0.0200М, CH4Cit=0.0015–0.0210М)
При составлении модели комплексообразования в системе Zr(IV) — лимонная кислота в качестве исходных были выбраны следующие ранее приводимые в литературе комплексы [11, с. 253; 12, с. 24]: [ZrHCit]+, [ZrCit]0, [Zr4(OH)3(Cit)4]3-, [Zr4(OH)4(Cit)4]4-, [Zr4(OH)5(Cit)4]5-, [Zr4(OH)6(Cit)4]6-. Матрица стехиометрии для эквимолярного соотношения реагентов, составленная по литературным данным, не удовлетворительно описывает полученные нами экспериментальные кривые (R-фактор — величина, характеризующая отклонение теоретически рассчитанных значений функции Бъеррума от полученных экспериментально — превышает 7 %). Поэтому приводимые в литературе модели была дополнена нами моно- и тетраядерными формами состава [Zr(OH)2Cit]2-, [Zr(OH)3Cit]3-, [Zr(OH)4Cit]4-, [Zr4(HCit)3(Cit)]3+, [Zr4(Cit)4]0, [Zr4(OH)10(Cit)4]10-, [Zr4(OH)11(Cit)4]11-, [Zr4(OH)12(Cit)4]12-. Тетраядерные комплексы вносят ощутимый вклад в меру качества модели.
Проверка предположения о возможном образовании протонированных моноядерных комплексов [ZrH3Cit]+ и [ZrH2Cit]2+ и комплекса, содержащего полностью диссоциированную форму лиганда [ZrCit]0, показала, что подобные частицы в изучаемой системе не образуются. Взаимодействие ионов циркония с лимонной кислотой начинается с образования в кислой области комплекса [ZrHCit]+, причем максимальная доля накопления этой формы достигает 60 %. Параллельно идет процесс полимеризации, и уже в кислой области (рН 2–3) зафиксировано существование тетраядерных частиц различной степени депротонизации ([Zr4(HCit)3(Cit)]3+, [Zr4(Cit)4]0).
Гидролитический распад цитратов циркония (IV) начинается уже в кислой среде. В диапазоне рН 3–6 становится значимым вклад в комплексообразование смешаннолигандных (гидроксоцитратных) комплексов состава [Zr4(OH)3(Cit)4]3-, [Zr4(OH)6(Cit)4]6-, [Zr4(OH)8(Cit)4]8-. Доля накопления моноядерного анионного комплекса [Zr(OH)2Cit]6- достигает величины 75 %, а диапазон существования данной частицы охватывает кислую, нейтральную и слабощелочную области (рН 3–8). В щелочной области (рН 7,5–10,5) обнаружены тетраядерные частицы [Zr4(OH)10(Cit)4]10-, [Zr4(OH)11(Cit)4]11-, [Zr4(OH)12(Cit)4]12- (доля накопления — 50, 20 и 15 % соответственно) и моноядерные комплексы [Zr(OH)3Cit]7- и [Zr(OH)4Cit]8- (60 и 10 % соответственно).
Таким образом, во всем изученном диапазоне значений рН моно- и тетраядерные формы существуют в равновесии. Константы устойчивости обнаруженных комплексных форм приведены в таблице 1.
Таблица 1
Состав и константы устойчивости цитратов циркония(IV)
|
№ |
Комплекс |
lgβ |
|
|
1 |
[ZrHCit]+ |
13.08 |
|
|
2 |
[Zr(OH)2Cit]2- |
47.82 |
|
|
3 |
[Zr(OH)3Cit]3- |
54.19 |
|
|
4 |
[Zr(OH)4Cit]4- |
57.47 |
|
|
5 |
[Zr4(HCit)3(Cit)]3+ |
70.82 |
|
|
6 |
[Zr4(Cit)4]0 |
107.9 |
|
|
7 |
[Zr4(OH)3(Cit)4]3- |
143.81 |
|
|
8 |
[Zr4(OH)6(Cit)4]6- |
177.99 |
|
|
9 |
[Zr4(OH)8(Cit)4]8- |
197.14 |
|
|
10 |
[Zr4(OH)10(Cit)4]10- |
212.86 |
|
|
11 |
[Zr4(OH)11(Cit)4]11- |
218.37 |
|
|
12 |
[Zr4(OH)12(Cit)4]12- |
223.09 |
На основании этих данных построены диаграммы распределения комплексных частиц в системе Zr(IV) — лимонная кислота (рис. 2).
Предложенная нами схема комплексообразования в системе Zr(IV) — лимонная кислота учитывает образование моно- и полиядерных частиц состава 1:1 и 4:4 различной степени протонизации. Доминирующими комплексными частицами в растворе являются тетраядерные формы, описывающие как кислую, так и щелочную области, начиная с рН 2. Доля накопления протонированной моноядерной формы [ZrHCit]+ невелика, данная частица существует лишь в сильнокислой области при рН<2. Наличие целого ряда комплексных форм различной ядерности, по-видимому, объясняется как свойствами лиганда, так и тенденцией ионов циркония(IV) к образованию полиядерных частиц в растворах [3, с 52; 13, с. 1041; 14, с. 880].
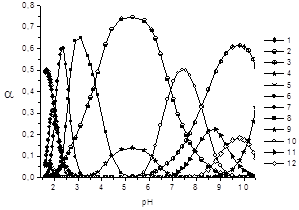
Рис. 2. Графики долевого накопления комплексных форм в системе Zr(IV)- лимонная кислота от рН: B(Zr)= 0.0050М: C(H4Cit)= 0.0053M: 1 — [ZrHCit]+; 2 — [Zr(OH)2Cit]2-; 3 — [Zr(OH)3Cit]3-; 4 — [Zr(OH)4Cit]4-; 5 — [Zr4(HCit)3Cit]3+; 6 — [Zr4(Cit)4]0; 7 — [Zr4(OH)3(Cit)4]3-; 8 — [Zr4(OH)6(Cit)4]6-; 9 — [Zr4(OH)8(Cit)4]8-; 10 — [Zr4(OH)10(Cit)4]10-; 11 — [Zr4(OH)11(Cit)4]11-; 12 — [Zr4(OH)12(Cit)4]12-
Способность цитрат-ионов к образованию тетраядерных комплексов может объясняться связываем цитратных остатков с ионами металлов через α-гидроксильную группу лиганда [17, с 141; 18, с.]. В работе Журавлевой Н. В. [18, с. 91], однако, отмечают, что для полиядерного комплесообразования недостаточно связывания ионов металлов лишь посредством α-гидроксильной группы, в образовании полиядерных циртатов также должны участвовать карбоксильные группы лиганда. При этом возможна реализация максимальной дентатности лиганда, равной четырем.
Литература:
1. Пятницкий, И. В. Маскирование и демаскирование в аналитической химии / И. В. Пятницкий, В. В. Сухан. — М.: Наука, 1990. — 222 с.
2. Коростелев, П. П. Фотометрический и комплексонометрический анализ в металлургии / П. П. Коростелев. — М.: Металлургия, 1984. — 272 с.
3. Ekberg, C. Studies on the hydrolytic behavior of zirconium(IV) / C. Ekberg, G. Kallvenius, Y. Albinsson, P. Brown //J. Solution Chem. — 2004. — V. 33, № 1. — P. 47–79.
4. Брауэр, Г. Руководство по неорганическому синтезу: в 6 томах. Т.4. / Г. Брауэр, Ф. Вайгель, Х. Кюнль, У. Ниман, Х. Пуфф, Р. Сиверс, А. Хаас, И. Хелмбрехт, П. Эрлих. — М.: Мир. 1985. — 1501 с.
5. Елинсон, С. В. Аналитическая химия циркония и гафния / С. В. Елинсон, К. И. Петров. — М.: Наука, 1965. — 241 с.
6. Лурье, Ю. Ю. Справочник по аналитической химии / Ю. Ю. Лурье. — М.: Химия, 1989. — 448 с.
7. Сальников, Ю. И. Полиядерные комплексы в растворах / Ю. И. Сальников, А. Н. Глебов, Ф. В. Девятов. — Казань: Изд-во Казанского ун-та, 1989. — 288 с.
8. Назаренко, В. А. Гидролиз ионов металлов в разбавленных растворах / В. А. Назаренко, В. П. Антонович, Е. М. Невская. — М.: Атомиздат, 1979. — 192 с.
9. Кочергина, Л. В. Термохимическое исследование реакций кислотно-основного взаимодействия в водном растворе лимонной кислоты / Л. В. Кочергина, В. П. Васильев, Д. В. Крутов, О. Н. Крутова. // Журн. физ. химии. — 2007. — Т. 81, № 2. — С. 234–238.
10. Бек, М. Исследование комплексообразования новейшими методами / М. Бек, И. Надьпал. — М.: Мир, 1989. — 431 с.
11. Чевела, В. В. Цитраты циркония(IV) в водных растворах / В. В. Чевела, С. Г. Безрядин, В. Ю. Иванова, Л. И. Мухамедьярова, Н. А. Григорьева, В. С. Залымов, Л. Г. Смирнова // Ученые записки казанского университета. Серия Естественные науки. — 2010. — Т.152, Кн.4. — С. 251–254.
12. Мухамедьярова, Л. И. Состав, структура и устойчивость цитратов циркония(IV) в водных растворах / Л. И. Мухамедьярова, С. Г. Безрядин, В. В. Чевела, Н. А. Григорьева, В. С. Залымов, В. Ю. Иванова // Вестник Оренбургского государственного университета. — 2010. — Т.118, № 12. — С. 22–26.
13. Dehnicke, K. Existence of the VO2+, TiО2+ and ZrО2+ сations / К. Dehnicke, J. Weidlein // Angew. Chem. Int. Ed. — 1996. — V. 5, № 12. — P. 1041.
14. Канажевский, В. В. Изменение локального окружения циркония при замещении лигандов в растворах / В. В. Канажевский, В. П. Шмачкова, Н. С. Коцаренко, В. Н. Коломийчук, Д. И. Кочубей. // Журн. структ. химии. — 2006. — Т. 47, № 5. — С.874–881.
15. Blomqvist, K. Solution study of system with polynuclear complex formation. 4. Heteronuclear copper(II) citrate complexes with nickel(II) or magnesium(II) / K. Blomqvist, E. R. Still // Inorg. Chim. Acta, 1984 — V. 82, № 2. — P. 141–144.
16. Журавлева, Н. Е. Гомо- и гетерополиядерные координационные соединения 4f-ионов иттриевой группы и некоторых 3d-ионов в цитратных водных растворах / Н. Е. Журавлева // дисс… канд. хим. наук. … 02.00.01 / Журавлева Наталья Евгеньевна. — Казань, 1986. — 214 с.
Похожие статьи
Состав, структура, устойчивость dl-тартратов циркония...
Определения состава, устойчивости и доли накопления dl-тартратных комплексов циркония (IV) в водном растворе методом pH-метрии и математического моделирования равновесий, в широком диапазоне рН при мольном соотношении 1:1...
Изучение комплексообразования ванадия... | Молодой ученый
соотношение реагентов, система, раствор, доля накопления, константа устойчивости, комплекс циркония. Комплексообразование висмута(III) с 2,2¢,3,4-тетраокси-3-сульфо-5-нитроазобензолом в...
Об одном частном случае аналитического описания зависимости...
В соответствии с классическим определением, концентрационная суммарная ступенчатая константа устойчивости βk комплекса MAk в растворе. (1). рассматривается как константа равновесия.
К вопросу о расчетах множественных химических равновесий
Для моделирования равновесий в системе цирконий(IV) — лимонная кислота использовался программный продукт CPESSP [7, с. 30].
В соответствии с классическим определением, концентрационная суммарная ступенчатая константа устойчивости βk...
Исследование комплексообразования мeди...
Экспериментальная часть. Реагенты и растворы.
При экстракции комплексов меди с ДТФ молекулы хлороформа не входят в состав
При уменьшении диэлектрической проницаемости растворителя константы устойчивости комплексов возрастают.
Установление состава комплекса по методу изомолярных серий...
Для расчета константы устойчивости комплекса ScR использовали метод пересечения кривых.
золото, сложный состав, порядок сливания компонентов, прибавленный реагент, оптическая плотность комплекса, металл, диск носителя, буфер, VII, III.
Материалы и реагенты для приготовления промывочных...
Ёдгаров Н. Химические реагенты и материалы в нефтегазовом комплексе — Ташкент.
сульфатный рассол, каустическая сода, сульфат натрия, кислота, натрий, маточный раствор, объемное соотношение, целевой продукт, гидроксид натрия, высший сорт.
Синтез и исследование свойств комплексов марганца (II) и рения...
Показано, что состав полученных комплексов зависит от соотношения исходных компонентов.
Для определения состава и термической устойчивости полученных комплексов нами проведены термогравиметрические исследования.
Получение водорастворимых гуминовых соединений при...
Вывод: Полученные водорастворимые комплексы гуматов кальция и магния устойчивы в широком диапазоне pH среды.
Рис 1. Зависимость функции Бьеррума от рН в системе Zr(IV) — лимонная кислота при соотношении реагентов 1:1 (ВZr = 0.0013–0.0200М, CH4Cit...
Похожие статьи
Состав, структура, устойчивость dl-тартратов циркония...
Определения состава, устойчивости и доли накопления dl-тартратных комплексов циркония (IV) в водном растворе методом pH-метрии и математического моделирования равновесий, в широком диапазоне рН при мольном соотношении 1:1...
Изучение комплексообразования ванадия... | Молодой ученый
соотношение реагентов, система, раствор, доля накопления, константа устойчивости, комплекс циркония. Комплексообразование висмута(III) с 2,2¢,3,4-тетраокси-3-сульфо-5-нитроазобензолом в...
Об одном частном случае аналитического описания зависимости...
В соответствии с классическим определением, концентрационная суммарная ступенчатая константа устойчивости βk комплекса MAk в растворе. (1). рассматривается как константа равновесия.
К вопросу о расчетах множественных химических равновесий
Для моделирования равновесий в системе цирконий(IV) — лимонная кислота использовался программный продукт CPESSP [7, с. 30].
В соответствии с классическим определением, концентрационная суммарная ступенчатая константа устойчивости βk...
Исследование комплексообразования мeди...
Экспериментальная часть. Реагенты и растворы.
При экстракции комплексов меди с ДТФ молекулы хлороформа не входят в состав
При уменьшении диэлектрической проницаемости растворителя константы устойчивости комплексов возрастают.
Установление состава комплекса по методу изомолярных серий...
Для расчета константы устойчивости комплекса ScR использовали метод пересечения кривых.
золото, сложный состав, порядок сливания компонентов, прибавленный реагент, оптическая плотность комплекса, металл, диск носителя, буфер, VII, III.
Материалы и реагенты для приготовления промывочных...
Ёдгаров Н. Химические реагенты и материалы в нефтегазовом комплексе — Ташкент.
сульфатный рассол, каустическая сода, сульфат натрия, кислота, натрий, маточный раствор, объемное соотношение, целевой продукт, гидроксид натрия, высший сорт.
Синтез и исследование свойств комплексов марганца (II) и рения...
Показано, что состав полученных комплексов зависит от соотношения исходных компонентов.
Для определения состава и термической устойчивости полученных комплексов нами проведены термогравиметрические исследования.
Получение водорастворимых гуминовых соединений при...
Вывод: Полученные водорастворимые комплексы гуматов кальция и магния устойчивы в широком диапазоне pH среды.
Рис 1. Зависимость функции Бьеррума от рН в системе Zr(IV) — лимонная кислота при соотношении реагентов 1:1 (ВZr = 0.0013–0.0200М, CH4Cit...











