Комплексные соединения платиновых металлов с оловосодержащими лигандами представляют интерес в качестве высокоактивных и селективных катализаторов реакции гидрирования, изомеризации, а также фиксации азота мягких условиях [1–4]. Их широко применяют в качестве активаторов в процессах химического металирования диэлектриков. Актуальными являются вопросы, связанные с разработкой мер повышения устойчивости к окислению олово (II) лиганда при нагревании. Накопленная к настоящему времени большая информация в основном относится к строению и свойствам исходных комплексов [1–5].
Особый интерес представляют комплексы платиновых металлов с кислородсодержащими заместителями у олово-лиганда. Однако, определенные трудности исследованию твердофазовых термически инициированных превращений таких комплексов накладывают их высокая дисперсность, рентгеноаморфность, склонность к термоокислительным реакциям и т п. Поэтому при исследовании твердофазовых термопревращений целесообразно сочетать методы ДТА в широком интервале давлений ядерно-гамма-резонансную спектроскопию и рентгенофазовый анализ.
ЯГР спектры 119Sn регистрировались на спектрометре ЯГРС-4 в комплекте с многоканальным анализатором Аи-4096. Прибор калибровали по стандартным поглотителям (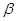 -Sn и SnО2) В качестве излучателя использовалась СаSnО3 содержащий изотоп 119Sn испускающий гамма-лучи с энергией 23,8 кэВ.
-Sn и SnО2) В качестве излучателя использовалась СаSnО3 содержащий изотоп 119Sn испускающий гамма-лучи с энергией 23,8 кэВ.
Измерения проводились при 80 К в специальном пенопластовом криостате. Тердые вещества таблетировали в полиэтилене. Толщина поглотителей по природному олову составляли 10–15 мг/см2. Параметры ЯГР спектров представлены относительно SnО2.
На рис 1 представлены ЯГР спектры диоксида олова в качестве стандарта (кривая 1), у которого химический сдвиг 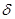 = 0, Г1
= 0, Г1 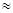 1 мм/с (Г-полуширина линий компонент спектра) и хлоридов олова (IУ), олова (II), платинооловянного комплекса (соответственно кривые [2–4] в растворах НС1. ЯГР спектр хлорида олова (IУ) представляет собой синглет с изомерным сдвигом
1 мм/с (Г-полуширина линий компонент спектра) и хлоридов олова (IУ), олова (II), платинооловянного комплекса (соответственно кривые [2–4] в растворах НС1. ЯГР спектр хлорида олова (IУ) представляет собой синглет с изомерным сдвигом 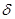 2 = 0,45 мм/с, Г2
2 = 0,45 мм/с, Г2 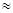 1,2 мм/с (кривая 2), хлорида олова (II) не связанного с платиной-симметричный дублет с изомерным сдвигом
1,2 мм/с (кривая 2), хлорида олова (II) не связанного с платиной-симметричный дублет с изомерным сдвигом 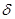 3 = 3,51 мм/с и квадрупольным расшеплением
3 = 3,51 мм/с и квадрупольным расшеплением 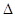 3 = 1,20 мм/с, Г3
3 = 1,20 мм/с, Г3 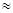 0,8 мм/с. Спектр платинооловянного комплекса в растворе НС1 также представляет собой симметричный дублет, но с меньшей величиной изомерного сдвига
0,8 мм/с. Спектр платинооловянного комплекса в растворе НС1 также представляет собой симметричный дублет, но с меньшей величиной изомерного сдвига 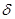 4 = 1,75 мм/с и с большей величиной квадрупольного раcщепления
4 = 1,75 мм/с и с большей величиной квадрупольного раcщепления 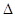 4 = 1,87 мм/с, Г4
4 = 1,87 мм/с, Г4 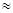 1 мм/с. Такое изменение изомерного сдвига обусловлено уменьшением 5s электронной плотности на атоме олова(II), в результате образования биметаллической связи олова с платиной. Симметричность дублета свидетельствует о том, что все лиганды олова в биметаллическом комплексе имеют одинаковый состав и близки по строению. О структурной однородности образцов свидетельствуют также величины полуширин линий, сопоставимые с полушириной для SnO2.
1 мм/с. Такое изменение изомерного сдвига обусловлено уменьшением 5s электронной плотности на атоме олова(II), в результате образования биметаллической связи олова с платиной. Симметричность дублета свидетельствует о том, что все лиганды олова в биметаллическом комплексе имеют одинаковый состав и близки по строению. О структурной однородности образцов свидетельствуют также величины полуширин линий, сопоставимые с полушириной для SnO2.
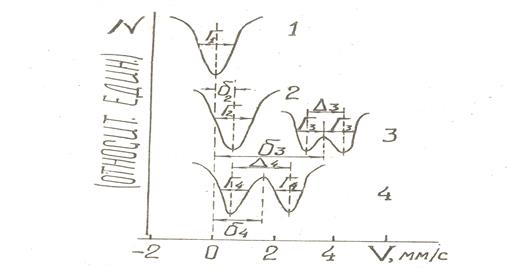
Рис. 1. Определение величин химического сдвига (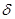 ) и квадрупольного расщепления (
) и квадрупольного расщепления (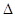 ) ЯГР спектров соединений олова: 1-диоксид олова, 2- и 3-растворы хлоридов олова (IY) и олова (II), 4-платина-оловяного комплекса при 80 К.
) ЯГР спектров соединений олова: 1-диоксид олова, 2- и 3-растворы хлоридов олова (IY) и олова (II), 4-платина-оловяного комплекса при 80 К.
Аналогичные зависимости химического сдвига и квадрупольного расщепления наблюдаются и для ЯГР спектров комплексов выделенных в твердую фазу. Так, при образовании комплексного соединения значение химического сдвига уменьшается на 1–2 мм/с; на пример, для (ТЭА)3 [Pt(SnCl3)5] 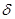 = 1,7 мм/с, что является следствием уменьшения 5s электронной плотности, которое связана с частичным переходом 5s электронов атома олова к атому платинового металла, зачет образования
= 1,7 мм/с, что является следствием уменьшения 5s электронной плотности, которое связана с частичным переходом 5s электронов атома олова к атому платинового металла, зачет образования 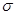 - связи. Увеличение значение квадрупольного расщепления происходит в следствие возрастания ассимметричности химического окружения ядра олова, при переносе электронов с d — орбиталей платинового металла на р-орбитали олово-лиганда при образовании
- связи. Увеличение значение квадрупольного расщепления происходит в следствие возрастания ассимметричности химического окружения ядра олова, при переносе электронов с d — орбиталей платинового металла на р-орбитали олово-лиганда при образовании 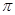 -дативной связи.
-дативной связи.
Спектры ЯГР исходного рутений-олово(II) гидроксидного комплекса, представляют собой симметричный дублет из монолиний (рис. 2, кривая 1). Полуширина сопоставима с таковой для диоксида олова, она характеризуется симметричными узкими линиями, что свидетельствует об однородности исходного комплекса. Дифрактограмма данного комплекса указывает на его рентгеноаморфность (рис. 4, кривая 1). Дифференциальная кривая этого комплекса, нагретого на воздухе, характеризуются эндотермическими эффектами при 325 и 415 К, обусловленным отщеплением молекул воды и НСI. На этот эффект накладывается экзотермический эффект при 415–485 К, возникший в результате окисления олова (II) (рис. 3, кривая 3), поэтому эндотермический эффект маскируется экзотермическим эффектом окисления и разложения. Второй экзоэффект, наблюдаемый в области 605–630 К, обусловлен кристаллизацией продуктов термопревращения SnO.
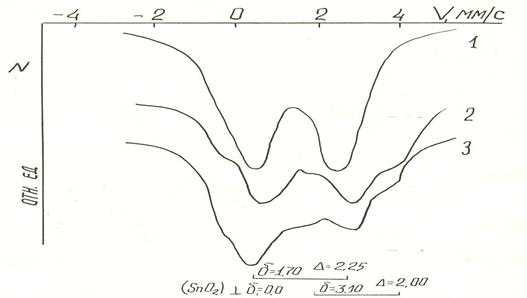
Рис 2. Спектры ЯГР Н4 [Ru{Sn(OH)3}5Cl] и продуктов его термообработки: 1-исходного образца, 2- и 3-при 10 мм. рт.ст. до 750–1000 К соответственно
.
Из полученных данных следует, что изученный комплекс при нагревании на воздухе до 630 К разрушается в результате окисления олово (II) -лиганда до SnO2. Настоящим исследованием установлено, что нагревание комплекса при пониженных давлениях сохраняет олово (II) в координированном состоянии в широком интервале температур (рис. 3, кривая 2). Это является следствием того, что при пониженных давлениях эндоэффекты удаления воды и HCl соответствуют более низких температур, отсутствием кислорода в газовой среде и смещением температуры экзотермического эффекта кристаллизации — более высокой. Так на дифференциальной кривой нагревания комплекса при давлении 45 миллиметров рт.ст. до температуры 670 К экзоэффект не наблюдается. Следовательно, продукт находится в рентгеноаморфном состоянии (рис. 4, кривые 3 и 4) на ЯГР-спектре этого образца (рис. 2, кривая 2) зафиксировано появление дублета с большим квадруполем. Приближенное разложение спектра свидетельствует о сохранении олова (II) в координированном состоянии, а также о формировании второй фазы, отвечающей частичному выделению олова (II). Дальнейшее повышение температуры приводит к образованию кристаллического диоксида олова. На дифференциальной кривой это отражается в виде экзотермического эффекта (рис. 3, кривая 2). Образование кристаллического SnO2 происходит вследствие реакции диспропорционирования выделившегося из координации оксида олова (II). Однако на дифрактограмме образца отсутствуют дифракционные пики, указывающие на наличие металлического олова. Это возможно, является следствием его высокой степени дисперсности. Появление у образца сероватого оттенка относят к появлению олова в металлическом состоянии. Температура начала кристаллизации и амплитуда экзотермического эффекта зависят от глубины вакуума. Чем глубже вакуум, тем выше температура кристаллизации и больше амплитуда экзоэффекта.
При температуре выше 1000 К происходит дальнейшее внутримолекулярное окислительно-восстановительное термопревращение, имеющее результатом формирование металл-оловянных комплексов с низкими степенями окисления рис. 2, кривая 2. Конечным продуктом твердофазовых термических превращений оказываются интерметаллическое соединение рутения с оловом и диоксид олова.
Таким образом, выводы, сделанные на основе данных ДТА, подтверждаются ЯГР и рентгенофазовыми анализами.

Рис 3. Кривые нагревания Н4 [Ru{Sn(OH)3}5Cl]: 1-температурная, 2 и 3-дифференциальные соответственно при 45 мм.рт.ст. и атмосферном давлении.
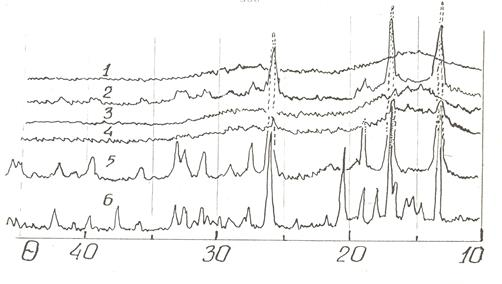
Рис. 4. Дифрактограммы Н4 [Ru{Sn(OH)3}5Cl] и продуктов его термообработки. 1-исходного образца, 2–6 нагретые: 2-на воздухе до конца температуры экзоэффекта (650 К), 3–6 в вакууме, 3-до начало экзоэффекта (660 К), 4-в момент экзоэффекта (690 К), 5-образца 3 нагретого до конца экзоэффекта (750 К), 6-до 1000 К.
Литература:
1. Юрченко Э. Н. Применение мессбауэровской спектроскопии для изучения Sn — содержащих катализаторов// Успехи химии, 1986. Том 55, Вып. 3. С. 477–498.
2. Антонов П. Г. Биметаллические комплексы платиновых металлов с оловом: Автореф. дис.... д-ра. хим. наук. — Л., 1984. — 41 с.
3. Гамма-резонансные спектры координационных соединений олова(П) //В. И. Гольданский, В. В. Храпов, В. Я. Рочев и др. //Докл. АН СССР. — 1968. — Т. 183, N2. — С. 364–367.
4. Исследование оловосодержащих лигандов в комплексах платиновых металлов методом ЯГР, рентгеноэлектронной и ИК-спектроскопии и МО ЛКАО /Э. Н. Юрченко, В. А. Варнек, Г. Л. Елизарова и др. //Коорд. химия. — 1975. -Т.1, вып. 10. -С. 1406–1414.
5. Юрченко Э. Н. Молекулярная спектроскопия и структурная химия новых биметаллических координационных соединений и катализаторов: автореф. дис. … д-ра хим. наук. –Новосибирск. 1984. –45 с.
6. Берг Л. Г. Введение в термографию — М.: Наука, 1969. — 396 с.

