В статье авторы описывают синтез новых производных колхицина и приводят данные об их антипролиферативной активности.
Ключевые слова: колхицин, тубулин, антимитотическая активность.
Предложен синтез высокоактивных гетероциклических аллоколхициноидов, содержащих дигидрофурановый цикл Д. Синтез соединений представлен на рис. 1 .
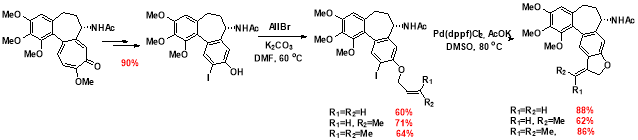
Цитотоксическая активность указанных соединений проявляется в наномолярном диапазоне по отношению к клеткам HaCaT, Colo-357, HEK-293.
Механизм последней стадии представлен на рис. 2 .
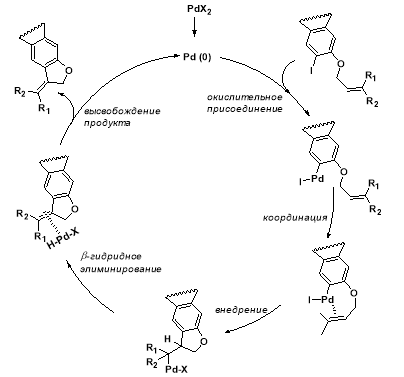
Рис. 2. Механизм реакции Хека
После проведения реакции Хека методом ЯМР было установлено, что продуктом данной реакции в случае незамещенного аллилбромида является смесь целевого колхициноида и изомерного 3-метилфурана в соотношении 3:1.Остальные продукты образовывались без примеси изомерного фурана. Это может быть обусловлено кислотно-катализируемой изомеризацией колхициноида, образующегося в реакции изначально. Возможно, выделяющаяся кислота HI не сразу связывается с находящимся в смеси основанием. Действительно, проведение подобной реакции с субстратом в системе трифторуксусная кислота — дихлорометан приводило к образованию изомерного продукта с количественным выходом в течение часа ( рис. 3 ).
Была изучена зависимость образования обоих продуктов от времени при медленном нагревании смеси до 35 °С.
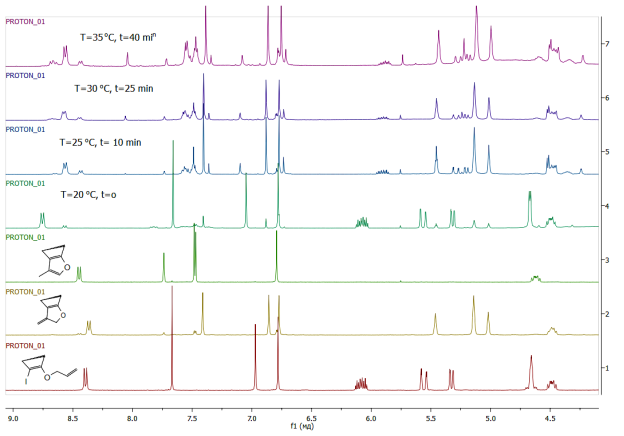
Рис. 4. Зависимость образования продуктов реакции от времени и температуры.
Сразу после смешения реагентов и добавления растворителя начинается образование нормального продукта реакции Хека, однако уже через 10–15 минут при нагревании смеси до 25 °С на спектре ЯМР становятся заметны сигналы продукта изомеризации. Его содержание увеличивается и через 40–50 минут соотношение колхициноидов становится равным примерно 3:1, и сохраняется таковым до окончания реакции. Необходимо отметить, что полная конверсия субстрата не наступает при 35–40 °С, для полного превращения необходима температура 75–80 °С.
Были предприняты попытки хроматографического разделения соединений на силикагеле с применением различных элюирующих систем, однако это не привело к положительному результату.
Было обнаружено, что добавление в систему 1,1 эквивалента B 2 Pin 2 подавляет процесс изомеризации и снижает выход метилфурана до 6–8 %. Это можно объяснить протеканием следующего процесса:
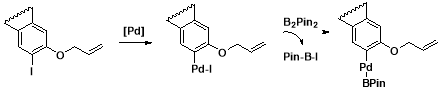
Рис. 5. Возможное объяснение участия B2Pin2 в реакции Хека
Интермедиат, образующийся при замене атома йода на BPin, далее будет элиминировать не иодоводородную кислоту, а частицу Н-B-Pin, которая уже не способна вызывать изомеризацию продукта реакции.
На основе целевого производного были синтезированы эпоксид и первичный спирт ( рис. 6. ):
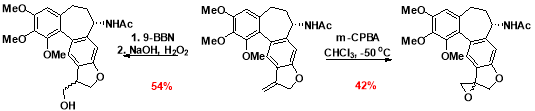
Рис. 6. Синтез эпоксида и спирта
Попытки синтезировать производные с циклопропановым и азиридиновым циклами не привели к желаемому результату.
Помимо соединений с фурановым циклом D , была предпринята попытка синтезировать колхициноиды, содержащие пятичленный лактонный цикл D согласно следующей схеме:
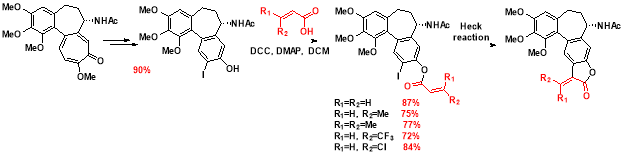
Вначале также был синтезирован иодо-колхинол, который далее ацилировали α,β-ненасыщенными кислотами в условиях реакции Штеглиха. Сложные эфиры иодо-колхинола были получены с выходами 72–87 %. Далее полученные эфиры вводили в реакцию Хека. Однако вместо внутримолекулярного кросс-сочетания сложноэфирная связь гидролизовалась под воздействием основания, находящегося в смеси, с образованием иодо-колхинола.
[1] Работа выполнена при поддержке гранта РНФ № 19–13–00158.

