Для обеспечения эффективного возделывания сельскохозяйственных культур, высокого качества продовольствия и сохранности урожая следует использовать улучшенные сорта и гибриды сельскохозяйственных культур, а также непрерывно совершенствовать средства защиты растений.
В целях защиты растений практикуются различные методы (например, агротехнический, биологический, иммунологический, физико-механический, биофизический) и средства (например, химические, биологические).
Интенсивные технологии выращивания растений не исключают возможности применения средств химической защиты (неорганические, органические, биогенные). Химические средства защиты позволяют предотвратить распространение инфекций, быстро уничтожить болезни и вредителей растений, помогают бороться с сорняками, уменьшить или предотвратить потери урожая.
Тем не менее, не существует абсолютно безвредных химических средств, так как они обладают побочным отрицательным воздействием. Химические средства могут накапливаться и вызывать нарушение функционирования жизненно важных органов, иммунной системы, различные заболевания. Сопутствующие токсичные соединения (фториды, тяжелые металлы и т. д.) средств химической защиты загрязняют продукты питания, окружающую среду, снижают качество сельскохозяйственной продукции.
Создание эффективных и безопасных биологических средств защиты сельскохозяйственных культур от заболеваний, возбудителями которых становятся различные фитопатогенные микроорганизмы, является одной из актуальных биотехнологических задач. Наибольший интерес представляют биопестицидные препараты на основе живых культур микроорганизмов, которые обладают способностью синтезировать различные антимикробные соединения.
Перспективной основой для разработки биопестицидных препаратов являются бактерии рода Pseudomonas (Pseudomonas aeruginosa, синегнойная палочка), синтезирующие более 300 различных антимикробных соединений, в число которых входят антибиотики ароматической природы, известные благодаря способности подавлять развитие возбудителей заболеваний сельскохозяйственных растений. P. aeruginosа может одновременно образовывать комплекс до 6 пигментов феназинового ряда, состав (качественный и количественный) которых зависит от условий культивирования, компонентов среды, индивидуальных особенностей бактериальных штаммов и источников выделения. Феназины характеризуются уникальным механизмом антимикробного действия и высокой активностью, а также способностью улучшать проникновение минеральных солей в растения [1].
В данной работе мы рассмотрим условия культивирования бактерий P. aeruginosa для увеличения выхода антибиотиков феназинового ряда.
По сравнению с типичными противогрибковыми препаратами, феназины имеют более широкий спектр действия. Они препятствуют развитию не только фитопатогенных грибов, но и целого ряда фитопатогенных бактерий — Acidovorax avenae, Erwinia carotovora, Pseudomonas syringae, Xanthomonas campestris [2].
Антибиотики феназинового ряда (феназины или дибензодиазины) — большая группа низкомолекулярных гетероциклических азотсодержащих соединений, синтезируемых в ходе реакций шикиматного пути, которые имеют различные химические и физические свойства в зависимости от типа и расположения функциональных групп. Наиболее распространенные производные феназина приведены на рисунке 1:
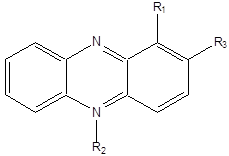
Рис. 1. Типичное строение феназиновых антибиотиков
R1, R2, R3 = 0 — феназин;
R1:COOH феназин-1-карбоновая кислота; OH — 1-оксифеназин (гемипиоцианин);
CONH2– феназин -1-карбоксамид (PCN) (оксихлрорафин);
R1 = О-, R2 = СH3 — пиоцианин;
R1 = COOH, R3 = OH — 2-оксифеназин-1-карбоновая кислота;
R1 = COOH, R2 = CH3–5-метилфеназин-1-карбоксилат.
Чаще всего феназины имеют интенсивное окрашивание и дают широкое разнообразие оттенков. Для них характерно несколько полос поглощения в ультрафиолете и не менее одной главной полосы в видимой области — 400–600 нм, которой феназины обязаны своей окраской. Большинство феназинов желтого цвета (λmax = 400–450 нм), тем не менее, иодинин пурпурный (λmax = 530 нм), а пиоцианин синий (λmax = 695 нм). Оксихлорорафин и его дигидропроизводное существуют в виде зеленого комплекса [3].
Для получения феназиновых пигментов мы использовали периодическое культивирование штамма P. aeruginosa — 67 на четырех средах различного состава: среда для культивирования гетеротрофных микроорганизмов РСА (Plate Сount Аgar), синтетическая минимальная среда М-9, среда Кинг В, применяемая для культивирования бактерий рода Pseudomonas, универсальная питательная среда ГРМ-бульон.
Таблица 1
Составы сред для культивирования P. aeruginosа — 67
|
РСА |
М-9 |
Кинг В |
ГРМ-бульон |
|
пептон — 20 г/л глюкоза — 10 г/л NaCl — 5 г/л KNO3–1 г/л |
пептон — 16,5 г/л глюкоза — 2 г/л NaCl — 2 г/л NH4Cl — 4 г/л KH2PO4–12 г/л Na2HPO4–23,3 г/л |
пептон — 20 г/л глицерин — 10 г/л К2HPO4–1,5 г/л MgSO4·7H2O — 1,5 г/л |
панкреатический гидролизат рыбной муки — 8 г/л пептон ферментативный — 8 г/л NaCl — 4 г/л |
При температуре 23˚С мы выращивали бактерии без аэрации в колбах Эрленмейера.
Экстракция феназинов проводилась на 3-e, 5-е и 7-е сутки культивирования по методике, предложенной M. E. Levitch и E. R. Stadtman [4]. Разделение хлороформенных экстрактов феназиновых соединений проводилось методами тонкослойной и колоночной хроматографии. Силикагель был использован в качестве неподвижной фазы. Подвижная фаза была выбрана на основе научных исследований [5, 6]. Наиболее эффективное разделение смеси феназинов наблюдалось в системе гексан — этилацетат (3:2). Данная система была использована в качестве подвижной фазы в колоночной хроматографии для разделения экстрактов феназинов. Полученные элюаты анализировали на наличие феназиновых производных с помощью тонкослойной хроматографии в системе гексан — этилацетат (3:2).
Максимальная оптическая плотность для феназина была определена путем длинноволнового сканирования с помощью УФ-видимого спектрофотометра. Хлороформ был использован в качестве контрольного образца, было использовано сканирование длиной волны из диапазона 200–600 нм. Полученные спектры сравнивали со стандартными. Пересчет концентрации полученных феназинов осуществляли с помощью молярных коэффициентов поглощения.
Результаты исследования показали, что при экстракции феназинов из всех использованных сред на 3-й день культивирования в культуральной жидкости находится только одно вещество, на 5-й и 7-й дни обнаружены два вещества.
Разделение феназинов проводилось при помощью ТСХ с использованием системы смеси растворителей гексан — этилацетат (3:2 об / об). ТСХ анализ показал наличие трех соединений, которые были разделены колоночной хроматографией. Два из полученных соединений были идентифицированы как феназин-1-карбоновая кислота (PCA) и 2-гидроксифеназин (2-OH P), путем сравнения спектров со стандартом. Структура третьего соединения еще не установлена.
На основе спектрального анализа полученных растворов феназинов были отобраны две среды, при культивировании на которых P. aeruginosa–67 выделяет наибольшее количество феназинов — РСА и Кинг В. Эти среды следует модифицировать для получения большего выхода феназиновых антибиотиков.
В заключение следует отметить, что интегрированная система защиты растений, сочетающая различные методы, является наиболее эффективной. Охрана здоровья человека и окружающей среды, получение биологически чистой продукции предусматривает рациональное и грамотное использование химических средств защиты, только в тех случаях, когда это действительно необходимо.
Литература:
1. Aunchalee N., Sukanya A., Chanokporn P., Paweena P., Saksit C. & Chalerm R. Synthetic, isolation of phenazine derivatives and their antimicrobial activities. Walailak J. Sci. and Tech., 2009, 6(1), pp. 78–91.
2. Aziz L. M., Hamza S. J., Abdul-Rahman I. A., Isolation and characterization of phenazine produced from mutant Pseudomonas aeruginosa, Al-Anbar J. Vet. Sci., Vol. 5 No. 1, 2012.
3. Hass D., Defaro G. Biological control of soil borne pathogens by fluorescent pseudomonas, Nature Reviews Microbiology, 1129, 2005.
4. Levitch M. E., Stadtman E. R. A study of the biosynthesis of phenazine-1-carboxylic acid — Archives of Biochemistry and Biophysics, 1964, Vol. 106, pp.194–199.
5. Mavrodi D., Blankenfeldt W., Thomashow L., Mental M., Phenazine compounds in fluorescent Pseudomonas spp. Biosynthesis and regulation. Annual review of Phytopathol, 2006, Vol. 44, pp. 417–445.
6. Samanta Saha, Thavasi R., Jayalakhsmi S. Phenazine pigments from Pseudomonas aeruginosa and their application as antibacterial agent and food colourants, Research Journal of Microbiology, 2008, Vol. 3, pp. 122–128.

