Введение
Бактерии рода Bacillus одна из наиболее обширных групп микроорганизмов. Род Bacillus привлекает большое внимание исследователей и практиков из различных отраслей. Собранные знания из различных наук указывают на достоинства Bacillus выступать в качестве продуцентов биологически активных веществ: ферментов, антибиотиков, инсектицидов. Высокая приспособляемость к различным условиям существования (наличие или отсутствие кислорода, рост и развитие в значительном диапазоне температур и т. д.) способствуют распространению бацилл в почве, воде, воздухе, пищевых продуктах и других объектах внешней среды. [2]
Бактерии рода Bacillus обладают выраженной антагонистической активностью в отношении широкого спектра патогенных и условно-патогенных микроорганизмов. Благодаря этому свойству, бациллы применяются во многих отраслях жизнедеятельности человека. Существенными характеристиками данных микроорганизмов являются: технологическое удобство на производстве, стабильность при хранении и экологическая безопасность.
В различных источниках описаны положительные результаты антагонистического действия представителей рода Bacillus , в том числе В. subtilis по отношению к различным патогенным и условно-патогенным микроорганизмам: Leuconostoc mesenteriodes, Staphylococcus aureus, St. Epidermidis, Mycobacterium smegmatis, Escherichia coli .
Поэтому есть возможность использования бактерий рода Bacillus как основу состава биопротравителей в сельском хозяйстве, для проведения комплекса мероприятий по улучшению качества семенного материала гороха овощного ( Pisum sativum L.) сорта Фокор. [4]
Актуальность. Использование качественного семенного материала обеспечивает стабильный и высокий урожай такой важной зернобобовой культуры, как горох. Возбудители многих болезней растений способны инфицировать семена, приводить к снижению их посевных качеств. Кроме того, больные семена могут быть источником инфекции. Поэтому применение качественных и безопасных, для окружающей среды, протравителей является важным методом сохранения семян и будущего урожая [5].
Научная новизна заключается в том, что проведены посевы 10 штаммов бактерий рода Bacillus subtilis на твёрдые питательные среды. Проверена биосовместимость штаммов между собой. Определены наиболее эффективные штаммы сенной палочки, способных к подавлению патогенных микроорганизмов — бактерии родов Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum . , при помощи 2х различных методов определения антагонистических свойств бактерий.
Гипотеза: бактерии рода Bacillus subtilis способны проявлять антагонистические свойства к патогенным бактериям родов Pseudomonas и Xanthomonas, а значит их возможно использовать в протравливании культуры гороха овощного ( Pisum sativum L.) сорта Фокор.
Объект исследования: 10 различных штаммов бактерий рода Bacillus subtillis.
Предмет исследования: патогенные микроорганизмы бактериального происхождения — бактерии родов Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum .
Цель проекта: изучить антагонистические свойства сенной палочки (бактерии рода Bacillus subtilis) к бактериям родов Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum для использования её в качестве протравителя.
Задачи проекта:
— приготовить питательные среды для выращивания микроорганизмов;
— провести посевы микроорганизмов бактериального происхождения;
— контроль полученных культур по методу Грамма;
— проверить биосовместимость штаммов бактерий сенной палочки между собой;
— определить наиболее эффективные штаммы бактерий рода Bacillus subtilis проявляющие антагонистические свойства к патогенным бактериям родов Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum .
Методы исследования:
— обзор литературы;
— микробиологические методы определения антагонистических свойств бактерий;
— микроскопирование;
— обработка результатов;
— определение возможности защиты семян и посадочного материала от патогенных микроорганизмов используя препараты на основе бактерий рода Bacillus subtilis .
I. Использование биопреператов для протравливания семян гороха овощного
Современная защита растений предусматривает систему многообразных экологически, экономически и токсикологически допустимых методов, поддерживающих численность вредных организмов ниже экономического порога вредоносности.
Агротехнический метод наиболее рационально совмещает вопросы защиты растений от сообществ вредных организмов в общей технологии возделывания гороха с экологически безопасной охраной окружающей среды. Развитие химического метода борьбы с вредными организмами базируется на принципах постоянного совершенствования эффективности, экологичности, избирательности и экономичности средств защиты в целях сохранения безопасности окружающей среды [9].
Высокий и качественный урожай гороха практически невозможно получить без обработки семян протравителями и посевов пестицидами. Выбор протравителя должен быть основан на результатах фитоэкспертизы семян. На основании фитоэкспертизы семян принимают решения о необходимости протравливания (при зараженности семян комплексом фитопатогенов более 15 %), а на основании таксономического состава патогенов подбирают наиболее эффективный протравитель по семенам.
Одним из основных способов защиты семенного материала является предпосевное протравливание семян. Этот прием защищает растение не только на стадии прорастания, но и в течение последующих этапов роста и зачастую может отодвинуть срок последующих опрыскиваний. Протравливание следует рассматривать как обязательный прием по агротехнике возделывания зерновых и зернобобовых культур.
Протравливание семян — это важнейший этап в технологии возделывания позволяющий с небольшими затратами защищать культуру от семенной и почвенной инфекции, не только в стадии прорастания, но и в течение последующих этапов роста и развития. Зараженные семена имеют пониженную энергию прорастания и всхожесть, растения из сильно зараженных семян часто совсем не развиваются или бывают ослабленными, низко продуктивными. Кроме того, больные семена создают очаги инфекции, от которых заражаются здоровые, в первую очередь, соседние растения [10].
Подготовка семенного материала, а также выбор правильного протравителя — это возможность не допустить развитие болезни и получить хорошие здоровые всходы [11].
Для правильного выбора препарата необходимо знание биологии возбудителя. Уничтожить инфекцию, сохраняющуюся на поверхности семян, под пленкой, а также предупредить проникновение её из почвы можно с помощью контактных протравителей.
Действующее вещество протравителя должно соответствовать видовому составу фитопатогенных грибов, найденных при исследовании семян; выбранный препарат должен не только контролировать семенную инфекцию, но и на стадии прорастания защитить их от почвенной инфекции; продолжительность защитного действия протравителя должно быть максимально длительным.
В настоящее время предлагается сравнительно небольшой набор химических фунгицидов (Скарлет, Винцит, Виннер, ТМТД) для защиты гороха от возбудителей аскохитоза, плесневения семян и корневых гнилей. Инсектицидные протравители для защиты ряда культур от комплекса почвообитающих и наземных вредителей на горохе не зарегистрированы.
Так, по результатам исследований, проведенным сотрудниками Всероссийского НИИ защиты растений МСХ РФ в 2014–2015 гг. на сорте гороха Фокор, установлено, что использование смесей Скарлет, 0,4 л/т + Круйзер, 0,8 л/т и ТМТД, 6 л/т + Табу, 0,8 л/т при протравливании семян способствовало повышению всхожести на 8,3–11,7 % по отношению к контролю и на 4,2–8,6 % по сравнению с раздельным применением препаратов [12].
II. Собственные исследования
Согласно инструкции по охране труда ИОТ-008-2013 запрещена какая-либо работа учащихся с ядохимикатами, инсектицидами и гербицидами. Соблюдая правила техники безопасности и полагаясь на литературные данные, мы рассматриваем возможность использования бактерий рода Bacillus subtilis для подавления роста патогенных бактерий родов Pseudomonas и Xanthomonas на прорастающих семенах гороха овощного.
Работа выполнена в феврале 2023 года на базе кафедры микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы Ульяновского ГАУ с использованием биоматериалов, оборудования и техники кафедры.
2.1 Материалы и методы
2.1.1. Материалы
Биоматериал
Штаммы бактерий Bacillus subtilis : B.s 1, B.s 2, B.s 3, B.s 4, B.s 5, B.s 6, B.s 7, B.s 8, B.s 9, B.s 10; Pseudomonas stutzeri: P.s 7959N, P.s 3503, P.s 7959N, P.s 12844; Xanthomonas campestris и Pectobacterium carotovorum полученные из музея культур кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ ФГБОУ ВО Ульяновский ГАУ и обладали типичными свойствами для своих видов и родов.
Питательные среды и реактивы
Питательный бульон для культивирования микроорганизмов (ФБУН ГНЦПМиБ, Россия, г. Оболенск), агар бактериологический (ФБУН ГНЦ ПМБ, Испания), ГРМ-агар (ФБУН ГНЦПМиБ, Россия, г. Оболенск).
Микро-ГРАМ-НИЦФ набор реагентов для окраски микроорганизмов по методу Грама ТУ 9398–002–39484474–2002 (ЗАО НИЦФ, РФ).
Оборудование и лабораторная посуда
Термостат ТС-80М-2, автоклав ГК-100–3, шкаф сушильно-стерилизационный ШСС-80п УХЛ 42, холодильник бытовой “Бирюса” СПО 4М1–16–4М1, дистиллятор, микроскоп «Биомед-6» с видеофотонасадкой, набор лабораторной посуды.
2.1.2. Методы
Настоящая работа выполнялась с использованием общепринятых микробиологических методов определения антагонистических свойств бактерий.
Посев на жидкие питательные среды:
1) Посев производят из бульона или агара, содержащего изучаемую культуру, вносят культуру при помощи бактериологической петли, рабочую часть которой предварительно прожгли в пламени горелки, в стерильные пробирки, содержащие жидкие питательные среды.
2) Пробирки с посеянной культурой помещают в термостат при температуре 37 ºC.
3) Учет результатов осуществляют через 24.
Посев на плотные питательные среды:
1) Посев производят из разведений гомогенизированного материала (или из бульона, содержащего изучаемую культуру) штрихом при помощи бактериологической петли, рабочую часть которой предварительно прожгли в пламени горелки, на стерильные чашки Петри, содержащие питательные среды.
2) Чашки Петри переворачивают вверх дном и помещают в термостат при температуре 37 ºC.
3) Учет результатов осуществляют через 24 часа (посев на МПА).
Для посева микроорганизмов на плотные питательные среды в работе использовались метод перпендикулярных штрихов и метод капель. Подробное описание метода указано в Приложении.
2.2 Результаты собственных исследований
2.2.1 Приготовление и контроль культур
2.2.1.1 Микроскопия окрашенных мазков по методу Грама
Из исследуемых штаммов бактерий Bacillus subtilis и P. stutzeri был приготовлен фиксированный мазок культуры, это были двухсуточные мазки с МПА, культивированные при 37 о С.
Фиксированные мазки были окрашены по инструкции в наборе реагентов для окраски микроорганизмов по методу Грама (НИЦФ Россия, Санкт-Петербург).
Метод окрашивания бактерий по Граму основан на различной способности микроорганизмов удерживать в клетке красители трифенилметанового ряда — кристаллический фиолетовый или генциановый фиолетовый. Сущность метода основана на различии в химическом составе и строении клеточной стенки бактерий.
Как уже было указано, все бактерии по этому признаку делят на две группы:
— грамположительные — красящиеся по Граму;
— грамотрицательные — не красящиеся по Граму
Подробная методика окрашивания бактерий по Граму указана в Приложении.
После такой обработки грамположительные бактерии окрашиваются в фиолетовый или синий цвет, а грамотрицательные — в красный.
После проведённого окрашивания приготовленные микропрепараты поместили под микроскоп для проведения микроскопического исследования, по результатам которого было видно, что бактерии рода Bacillus subtilis являются грамположительными, т. к. препараты имеют фиолетовую окраску Бактерии рода Pseudomonas stutzeri после окраски имели красный цвет, что означает их принадлежность к грамотрицательным бактериям.
2.2.1.2 Исследование культуральных свойств на МПБ
Согласно прописи, были приготовлены среды. Через 24 ч суточные культуры бактерий штаммов B. subtilis 1, 3, 4, 5, 6, 7, 8, 9, 10; P. stutzeri 7959N. с МПБ были засеяны в пробирку со средой.
|
|
|
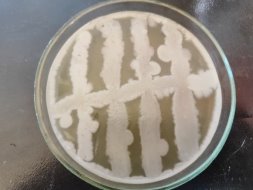
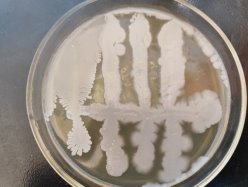
При культивировании штаммов B. subtilis 1, 2 3, 4, 5, 6, 7, 8, 9, 10; P. stutzeri 3503, 7959N, 12844, 7959N. на питательном бульоне при температуре культивирования 37˚С через 24 часа наблюдается активный рост.
При культивировании бактерий рода B. Subtilis можно наблюдать колонии, которые могут выглядеть гладкими, грубыми или слизистыми. Его края могут быть вытянуты посередине или быть волнистыми. Аналогично, средний размер колоний составляет от 2 до 4 мм в диаметре.
При культивировании бактерий рода P. Stutzeri можно наблюдать колонии, напоминающие кратеры вулканов. Сморщенные, кораллоподобные, более мукоидные по периферии, непигментированные или красновато-коричневые колонии, легко снимаются с питательной среды.
2.2.2 Оценка биосовместимости штаммов бактерий рода Bacillus subtilis
2.2.2.1 Оценка биосовместимости штаммов бактерий рода Bacillus subtilis в отношении друг друга методом перпендикулярных штрихов
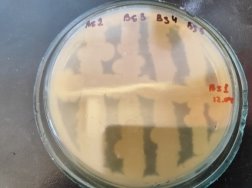
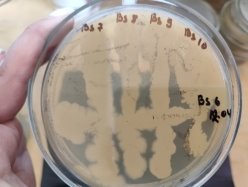
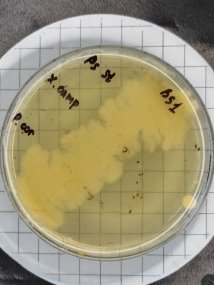
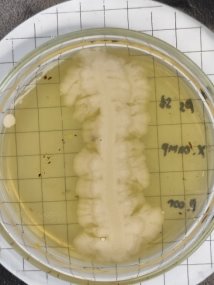
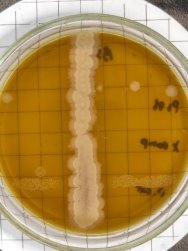
Согласно методу перпендикулярных штрихов, на поверхности агаровой среды в чашке Петри посеяли штрихом экспоненциальные культуры исследуемых штаммов B. subtilis 1, 6 на 2 чашки Петри и инкубировали при температуре 37°С в течение 24 часов. Затем перпендикулярно от края чашки к штриху выросших культур B. subtilis 1, 6 посеяли штрихом экспоненциальные культуры тест-штаммов B. subtilis 2, 3, 4 и 5 на одной чашке Петри, 7, 8, 9, 10 на второй чашке Петри. Чашки Петри инкубировали при температуре 37°С в течение 24 часов. На границе со штрихом роста бактерии зоны ингибирования отсутствовали.
|
|
|
|
|
|
Таблица 1
Результаты изучения антагонистических свойств методом перпендикулярных штрихов штаммов B . subtilis 1, 6 по отношению к штаммам B . Subtilis 2–5 и 7–10
|
Названия штаммов |
B. subtilis 2 |
B. subtilis 3 |
B. subtilis 4 |
B. subtilis 5 |
B. subtilis 7 |
B. subtilis 8 |
B. subtilis 9 |
B. subtilis 10 |
|
B. subtilis 1 |
+ |
+ |
+/- |
+ | ||||
|
B. subtilis 6 |
+ |
+ |
+ |
+/- |
2.2.2 Оценка антагонистической активности штаммов в отношении пектобактерий
Выбрав метод штрихов, как наиболее оптимальный для определения антагонистической активности штаммов-кандидатов бактериальной композиции в отношении друг друга, дальнейшие исследования проводили при помощи этого метода.
Для изучения способности штаммов-кандидатов бактериальной композиции Bacillus subtilis подавлять рост патогенных бактерий выбрали ряд микроорганизмов, обладающими патогенными свойствами в том числе и в отношении продукции растениеводства: бактерий Pseudomonas studzeri , Xanthomonas campestris и Pectobacterium carotovorum
Проявление антагонистической активности бактерий рода Bacillus subtilis к фитопатогенам определяли по зонам ингибирования между штамм-кандидатом и исследуемой тест-культурой. Если изучаемый штамм-антагонист оказывал антимикробное действие в отношении изучаемых патогенов, то последние росли на расстоянии от его штриха, которое и являлось количественной мерой антагонистической активности. Антагонистическую активность в отношении фитопатогенов определяли модифицированным методом агаровых блоков и выражали в виде ингибирующей активности. Чем выше уровень антагонистических веществ, выделяемых бациллами, тем больше зона задержки роста тест-штаммов. Высокий уровень продукции антибиотических веществ штаммом бацилл обеспечивает зону задержки роста тест-штаммов не менее 10–15 мм.
Таблица 2
Результаты изучения антагонистических свойств методом штрихов штаммов B. subtilis по отношению к фитопатогенным бактериям
|
Названия штаммов |
Pseudomonas studzeri |
Xanthomonas campestris |
Pectobacterium carotovorum |
|
B. subtilis 1 |
+ |
+ |
+ |
|
B. subtilis 2 |
+/- |
- |
+/- |
|
B. subtilis 3 |
- |
- |
+ |
|
B. subtilis 4 |
- |
+ |
+/- |
|
B. subtilis 5 |
+ |
- |
+ |
|
B. subtilis 6 |
- |
+/- |
+/- |
|
B. subtilis 7 |
+/- |
- |
- |
|
B. subtilis 8 |
+ |
+ |
+ |
|
B. subtilis 9 |
- |
- |
+ |
|
B. subtilis 10 |
+/- |
+/- |
- |
Было выявлено, что бактерии рода Bacillus subtilis проявляют антагонистическую активность разной степени выраженности в зависимости от штамма микроорганизма. Установлено, что наибольшую антагонистическую активность в отношении фитопатогенных бактерий Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum проявили штаммы бактерий Bacillus subtilis 1 и 8 . Наименьшей антагонистической активностью обладали остальные штаммы бактерии Bacillus subtilis.
|
|
|
|
|
|
III. Результаты исследования антагонистических свойств
1) После проведённого окрашивания приготовленные микропрепараты поместили под микроскоп для проведения микроскопического исследования, по результатам которого было видно, что бактерии рода Bacillus subtilis являются грамположительными, т. к. препараты имеют фиолетовую окраску. Бактерии рода Pseudomonas stutzeri после окраски имели красный цвет, что означает их принадлежность к грамотрицательным бактериям.
2) Оценка биосовместимости штаммов бактерий рода Bacillus subtilis в отношении друг друга методом перпендикулярных штрихов показала, что различные штаммы бактерии B. subtilis биосовместимы между собой и не угнетают рост друг друга
|
Названия штаммов |
B. subtilis 2 |
B. subtilis 3 |
B. subtilis 4 |
B. subtilis 5 |
B. subtilis 7 |
B. subtilis 8 |
B. subtilis 9 |
B. subtilis 10 |
|
B. subtilis 1 |
+ |
+ |
+/- |
+ | ||||
|
B. subtilis 6 |
+ |
+ |
+ |
+/- |
3) Анализ антагонистической активности в отношении патогенных бактерий. Результаты определения антагонистической активности изученных штаммов в отношении патогенов представлены в табл. 3. В зависимости от ширины зоны угнетения роста микробных тест-объектов можно выделить высокую (от 11 до 30 мм), среднюю (в пределах 4–10 мм) и слабую (до 4 мм) антагонистическую активность.
Все штаммы показали наличие бактерицидного действия средней и слабой степени в отношении других использованных в опыте фитопатогенных бактерий — Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum . Зона угнетения роста составляла в среднем 2–10 мм в зависимости от вида тест-объекта. Таким образом, все изученные штаммы бактерий B. subtilis подавляли рост патогенных бактерий, хотя и в различной степени.
Наибольшее антагонистическое действие в отношении фитопатогенных бактерий Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum проявили штаммы бактерий Bacillus subtilis 1 и 8 . Остальные штаммы бацилл проявили к данному патогену среднюю антагонистическую активность.
|
Названия штаммов |
Pseudomonas studzeri |
Xanthomonas campestris |
Pectobacterium carotovorum |
|
B. subtilis 1 |
+ |
+ |
+ |
|
B. subtilis 2 |
+/- |
- |
+/- |
|
B. subtilis 3 |
- |
- |
+ |
|
B. subtilis 4 |
- |
+ |
+/- |
|
B. subtilis 5 |
+ |
- |
+ |
|
B. subtilis 6 |
- |
+/- |
+/- |
|
B. subtilis 7 |
+/- |
- |
- |
|
B. subtilis 8 |
+ |
+ |
+ |
|
B. subtilis 9 |
- |
- |
+ |
|
B. subtilis 10 |
+/- |
+/- |
- |
IV. Выводы и рекомендации
4.1 Выводы
В ходе нашего исследования был проведен анализ антагонистической активности штаммов бактерий вида Bacillus subtilis по отношению к бактериям вида Pseudomonas studzeri, Xanthomonas campestris и Pectobacterium carotovorum. Высокую антагонистическую активность проявили штаммы 1 и 8 бактерий вида Bacillus subtilis , что свидетельствует о возможности использования «сенной палочки» в качестве основы препарата для обработки растений от болезней, возникающих из-за бактерий Pseudomonas и Xanthomonas. Наша гипотеза подтверждена.
4.2 Рекомендации
По результатам проведенного нами исследования мы предполагаем возможным использования препарата на основе определенных штаммов бактерий вида Bacillus subtilis для протравливания семян гороха овощного ( Pisum sativum L.) сорта Фокор от патогенных микроорганизмов: бактерии родов Pseudomonas и Xanthomonas от заболевания гороха-бактериоз.
Для обеззараживания семян их опрыскивают культурой микроорганизма, разведённой в воде. Стерилизуется не только поверхность семени, но и зона корня, куда переходят микроорганизмы и начинают там размножаться.
При высадке рассады их корни смачивают взвесью в воде соответствующих микробов-антагонистов. Водную взвесь микробов можно также использовать для опрыскивания надземных частей повреждённых растений, а также для профилактических целей.
Литература:
- Андрюков Б. Г., Тимченко Н. Ф. Базовые методы описательной статистики в микробиологических исследованиях // Здоровье. Медицинская экология. Наука, 2018. — Т. 53. — № 4. — С. 29–36.
- Бабич О. О., Просеков А. Ю., Сухих С. А., Милентьева И. С. Изучение антагонистической активности микроорганизмов рода Bacillus // Векторы развития современной науки, 2020. — № 1. — С. 3–6.
- Блинкова Л. П., Семенов Т. А., Бутова Л. Г., Матюша Г. В., Фомкина И. П., Карташова Т. А. Антагонистическая активность свежевыделенных штаммов бактерий рода Bacillus // Журнал микробиологии, эпидемиологии и иммунобиологии, 2018. — Т. 71. — № 5. — С. 71–72.
- Кирик М., Піковський М. / Діагностика хвороб насіння гороху та сої// Пропозиція. — 2017. — № 1. — С. 116–120
- Бухарин О. В., Валышев А. В., Гильмутдинова Ф. Г. и др. Экология микроорганизмов человека. Екатеринбург: УрО РАН, 2022. 546 с.
- Вечернина, Н. А. Практикум по микробиологии. — Барнаул: Изд-во Алтайского государственного университета, 2021. — 78 с.
- Виноградова А. В., Козлова Г. А. Культивирование микроорганизмов. — Пермь: Изд-во Пермского национального исследовательского политехнического университета, 2018. — 97 с.
- https://www.syngenta.kz/news/zernovye/semennaya-infekciya-zernovyh-kultur (10.01.2022г.)
- Семенов А. В. Антагонизм как результат межмикробных отношений // Бюллетень Оренбургского научного центра УрО РАН, 2018. — № 1. — 8 с.
- Семенов С. С., Былгаева А. А. Перспективы применения спорообразующих бактерий рода Bacillus в сельском хозяйстве Якутии // Международный научно-исследовательский журнал, 2020. — № 5–3 (36). — С. 100–102.