В настоящей работе осуществлен подбор оптимальных условий для извлечения бактериохлорофилла а из биомассы бактерий Rhodobacter Sphaeroides.
Ключевые слова: бактериохлорофилл а, БХЛ а, порфирины, фотодинамическая терапия, фотосенсибилизатор, Rhodobacter Sphaeroides.
Рак остается одной из главных проблем общественного здравоохранения и второй причиной смертности во всем мире: по данным ВОЗ в 2020 году 9,6 млн. человек скончались от онкологических заболеваний. Фотодинамическая терапия (ФДТ) является клинически одобренным и быстро развивающимся методом лечения онкологических заболеваний (внесена в стандарты лечения с 2012 года). Данный метод неинвазивен и основывается на накоплении в опухоли фотосенсибилизатора (ФС), который под действием света с определенной длиной волны вызывает образование активных форм кислорода, что приводит к апоптозу и некрозу опухолевых тканей [1]. Возможности современной онкологии значительно расширились с появлением ФДТ, которая обладает рядом преимуществ по сравнению с конвенциональной терапией рака: локальность действия, т. е. минимальная токсичность для нормальных тканей, отсутствие механизмов резистентности, а также отсутствие послеоперационных осложнений при сохранении функции пораженного органа [2].
Фотосенсибилизирующий агент является одним из ключевых звеньев в реализации фотодинамического эффекта в опухолевой клетке [2]. На современном этапе развития метода ФДТ все ФС принято разделять на три группы (рис.1): ФС первого поколения — порфирины 1 , а именно гематопорфирин и его производные (Фотофрин, Фотогем), ФС второго поколения — производные хлорофилла а 2 и бактериохлорофилла а 3 , фталоцианины 4 и нафталоцианины 5 (Фоскан, Фотолон, Радахлорин) и ФС третьего поколения (модифицированные хлорины и бактериохлорины) [3].
Перспективными ФС для ФДТ, поглощающими в ближнем ИК диапазоне спектра, являются бактериохлорины, поскольку их терапевтическое окно поглощения (760–850 нм) открывает широкие возможности для диагностики и лечения злокачественных новообразований [4]. Поиск новых фотосенсибилизаторов ведется как среди синтетических бактериохлоринов, так и среди природных пигментов. Последние привлекают особое внимание, так как значительно быстрее выводятся из организма и подвергаются биодефадации, что существенно снижает побочные эффекты ФДТ. В РТУ МИРЭА на кафедре ХТБАСМиОХ был разработан препарат на основе О -пропилоксим- N -пропоксибактериопурпуринимида 6 (рис. 2), который показал высокую фотоиндуцированную противоопухолевую активность в системе in vitro и in vivo , 100 %-ное торможение роста опухоли и 90 % излеченности животных за счет селективного накопления в опухоли и быстрого выведения из организма [5].
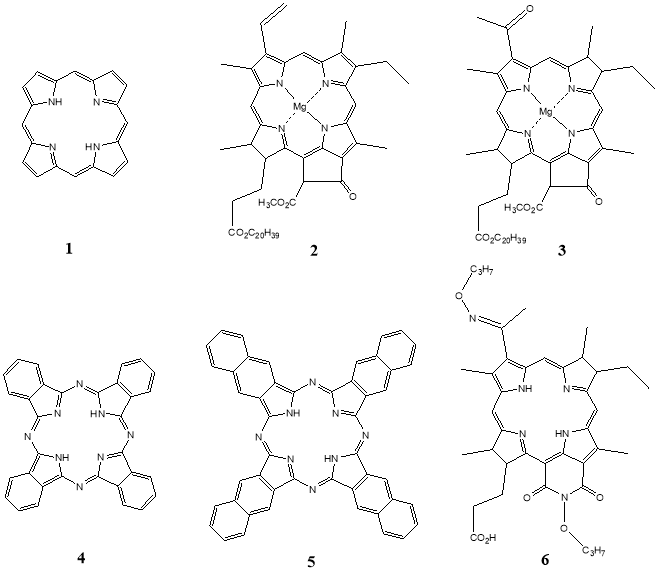
Рис. 1. Структуры тетрапиррольных ФС
Сырьем для получения данного ФС является бактериохлорофилл а 3 (рис. 3), который продуцируется пурпурными бактериями ( Rhodobacter Sphaeroides , Rhodobacter Roseapersiana и Rhodobacter Capsulatа ) [5].
Бактериохлорофилл а (БХЛ а ) обладает характерным интенсивным поглощением в ближней инфракрасной части электромагнитного излучения, где эндогенные хромофоры не поглощают и что позволяет глубоко проникать через ткани [6]. Таким образом, данный пигмент является крайне ценным сырьем для синтеза перспективных препаратов третьего поколения для ФДТ.
Известен способ получения БХЛ а , основанный на экстракции пигментов метанолом из биомассы пурпурных бактерий, упаривании экстракта под вакуумом, с последующей очисткой бактериохлорофилла a с помощью высокоэффективной жидкостной хроматографии [7]. К недостаткам этого метода следует отнести: 1) потери БХЛ a на стадиях упаривания и ВЭЖХ очистки за счет интенсивного окисления, 2) низкую производительность и выход процесса по бактериохлорофиллу a, 3) высокую стоимость и сложность процесса ВЭЖХ. В группе проф. А. Ф. Миронова был предложен метод выделения БХЛ а из биомассы пурпурных бактерий изопропанолом [8], с последующим центрифугированием, декантированием и экстракцией в делительной воронке. Процесс экстрагирования проводили два дня. Выход целевого продукта составлял 0,3 г на 250 г биомассы. К недостаткам данного метода относится: 1) время экстрагирования, составляющее два дня, 2) недостаточная извлекаемость бактериохлорофилла а из биомассы. Цель настоящей работы заключается в оптимизации процесса экстрации бактериохлорофилла а из природного сырья и получение большого количества БХЛ а .
Материалы и методы
Использованные в работе растворители были очищены и подготовлены по стандартным методикам. БХЛ а выделяли из биомассы пурпурных бактерий Rhodobacter Sphaeroides. Все реакции проводили при защите от прямого света. Электронные спектры получены на спектрофотометре Ultrospec 2100 pro (США) в кварцевых кюветах толщиной 10 мм. Экстракты были анализированы с использованием ультравысокоэффективной жидкостной хроматографической системе «Dionex UltiMate RS 3000», совмещенной гибридным масс-спектрометром высокого разрешения «Q-Exactive». Условия анализа ВЭЖХ-МС/МС: Предколонка Thermo Scientific Hypersil Gold aQ 10x2.1, диаметр частиц сорбента 3 мкм; Колонка Thermo Scientific Hypersil Gold aQ 150x2.1, диаметр частиц сорбента 3 мкм; ПФ А: 0,1 % Муравьиной кислоты в деионизированной воде; ПФ Б: изопропиловый спирт.
Обсуждение результатов
На первом этапе исследования проводились эксперименты по подбору оптимального экстрагента для извлечения бактериохлорофилла а из биомассы. Экстрагент должен обладать селективностью, т. е. способностью предпочтительно извлекать один из двух (или более) компонентов раствора (показатель характеризует выход и качество целевого продукта). Поэтому предпочтительным следует считать тот экстрагент, который извлекает максимальное количество одного компонента и минимальное количество остальных [9]. В качестве возможных экстрагентов были предложены следующие системы: изопропанол: этанол (в объемном соотношении 1:1); метанол; этанол; этилацетат: бутилацетат (в объемном соотношении 2:3). Содержание БХЛ а в экстракте определяли спектрофотометрически по величине оптической плотности в максимуме его поглощения в диапазоне λ = 760–780 нм.
По 1 г биомассы бактерий Rhodobacter Sphaeroides помещали в конические колбы, добавляли 10 мл каждого экстрагента. Смеси перемешивали в течение 30 минут при комнатной температуре, а затем центрифугировали от остатков клеток бактерий. Надосадочную жидкость анализировали на спектрофотометре. О количестве БХЛ а , перешедшего из биомассы в экстракт, судили по величине оптической плотности в характерном для БХЛ а максимуме поглощения. Результаты измерений представлены в таблице 1.
Таблица 1
Оптическая плотность БХЛ
|
Состав экстрагента |
Оптическая плотность БХЛ а , в диапазоне поглощения λ= 760–780 нм |
|
изопропанол: этанол (1:1) |
1,726 |
|
метанол |
1,674 |
|
этанол |
1,622 |
|
этилацетат: бутилацетат (2:3) |
1,064 |
На основании значений оптической плотности можно сделать вывод, что максимальной извлекающей способностью обладает система изопропанол: этанол.
Полученный экстракт был проанализирован с помощью ВЭЖХ-МС/МС. Для оценки селективности выбранного экстрагента подбирали соотношения изопропанола и этанола. Были предложены соотношения изопропанола и этанола соответственно: 1:1, 2:3, 3:2. В конические колбы помещали по 1 г биомассы бактерий
Rhodobacter Sphaeroides
и добавляли необходимое количество растворителей. По положению пика в масс-спектре определяли массу зарегистрированного иона, а по площади — относительное количество ионов данного типа. Поскольку площадь пика любого компонента прямо пропорциональна массе этого компонента в разделяемой смеси, то рассчитывали массовую долю бактериохлорофилла
а
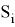
Таблица 2
Массовая доля БХЛ а в экстракте
|
Изопропанол: этанол |
Содержание БХЛ а, % | ||
|
1:1 |
2:3 |
3:2 | |
|
БХЛ а |
8,69 |
4,55 |
5,17 |
Можно заключить, что наибольшей селективностью обладает система изопропанол: этанол в объемном соотношении 1:1.
В процессе масштабирования выделение БХЛ а проводили в течение двух часов в лабораторном стеклянном реакторе, объемом 1 л снабженный роторной мешалкой и подводом инертного газа (БХЛ а подвергается окислительной деградации в присутствии кислорода воздуха). Используемый инертный газ может представлять собой аргон, азот или гелий. Выход целевого продукта по сравнению со стандартной методикой не уменьшается и составляет 0,9 г на 250 г.
Выводы
Таким образом, нами было показано, что в ходе подбора условий извлечения БХЛ а сокращается время экстракции с двух суток до двух часов; также установлено, что наиболее селективным экстрагентом для извлечения БХЛ а из биомассы Phodobacter Sphaeroides является система изопропанол: этанол (в объемном соотношении 1:1). Данное усовершенствование потенциально позволит существенно снизить время синтеза и стоимость активных фармацевтических субстанций на основе бактериохлоринов.
Литература:
- Пантюшенко, И. В. Новый высокоэффективный ИК-фотосенсибилизатор для фотодинамической терапии рака / И. В. Пантюшенко, М. А. Грин, Р. И. Якубовская, Е. А. Плотникова, Н. Б. Морозова, А. А. Цыганков, А. Ф. Миронов // Вестник МИТХТ. — 2014. — № 3. — С. 3–10.
- Грин, М. А. Разработка таргетных наноструктурированных фотосенсибилизаторов на основе бактериохлорофилла а для фотодинамической терапии рака / М. А. Грин, Н. В. Суворов, П. В. Островерхов, М. А. Каплан, А. Г. Мажуга, А. Ф. Миронов // Российский биотерапевтический журнал. — 2017. — № 16. — С. 28–33.
- Миронов А. Ф. Разработка сенсибилизаторов второго поколения на основе природных хлорофиллов // Рос. хим. журнал. 1998. Т. 1, № 4, C. 23–26.
- Mironov A. F., Grin M. A., Nochovny S. A., Toukach F. V. Novel cycloimides in the chlorophyll a series. // Mendeleev Commun. 2003, Vol. 4, p. 156–158.
-
Пат. 2521327 Российская Федерация,
- Грин, М. А. Серосодержащие производные бактериохлорофилла а и наноструктурированные фотосенсибилизаторы на их основе / М. А. Грин, И. В. Пантюшенко, П. В. Островерхов, Е. А. Плотникова, Н. Б. Морозова, А. Г. Мажуга, А. Ф. Миронов // Российский биотерапевтический журнал. — 2016. — Т. 15. –№ 1. — С. 27–28.
- Berger, G.; Kleo, J.; Andrianambinintsoa, S.; Neumann, J. M; Leonhard, M.// Preparation and purification of chlorophylls, bacteriochlorophylls and of their derivatives. // J. Liq. Chromatogr., 1990, 13(2), P. 333–344.
-
Пат. 2144085 Российская Федерация,
- Pandey, R. K. Porphyrins as Photosensitizers in Photodynamic Therapy / K. M. Kadish, K. M. Smith, R. Guilard / In: The Porphyrin Handbook / Ed.: K. M. Kadish — Boston: Academic press, 2000. P. 157–230.

