Ювенильный ревматоидный артрит (ЮРА) — хроническое аутоиммунное системное воспалительное заболевание соединительной ткани, занимающее ведущее место среди ревматических заболеваний детского возраста. [1,2,3] Известно, что нарушения микроэкологии кишечника способствуют повышению проницаемости слизистой оболочки для липополисахарида грамотрицательных микроорганизмов, что приводит к развитию иммунных нарушений и персистенции хронического иммунного воспаления. [4,5,6,7]
Коррекция нарушений дисбиоза кишечника при ЮРА, как одного из наиболее эффективно модифицируемых факторов риска СИБР, позволяет снизить вероятность его развития.
В настоящее время не существует исследований, доказавших преимущественное влияние различных режимов пробиотической и сорбционной терапии на коррекцию нарушений антиэндотоксинового иммунитета и СИБР у пациентов с ЮРА. Проблема реабилитации детей больных ЮРА в периоде ремиссии заболевания является актуальной. [8,9,10]
Цель исследования: повышение эффективности санаторно-курортной реабилитации детей с ревматоидным артритом в периоде ремиссии на основании изучения антиэндотоксинового и общего иммунитета и проявлений синдрома избыточного бактериального роста путем дифференцированной коррекции выявленных нарушений.
Материалы и методы:
Был проведен эксперимент на лабораторных животных, экспериментальная модель сопоставима к детскому возрасту человека. Адьювантный артрит был смоделирован у 24 крыс в возрасте 12–14 дней, весом 14–16г. путем сенсибилизации организма животного введением 0,01мл адъюванта Фрейнда однократно, внутрибрюшинно. Затем через 5 суток на протяжении 13 недель вводился адъювант Фрейнда (1 мкг на 1 животное 3 раза в неделю) подкожно над коленным суставом. У всех экспериментальных животных к 16-й неделе развивался полиартрит с преимущественной локализацией в тазобедренных, коленных суставах. Забор материала проводился через 15 недель с момента моделирования РА и через 19 недель после лечения препаратами). Для морфологических исследований изымались участки тонкого и толстого кишечников у 12-х больных животных с моделированным артритом и в группе с коррекцией, а также образцы органов, взятые от 6-ти здоровых животных в качестве группы контроля.
Трансмиссионная электронная микроскопическая (ТЭМ) проводилась по стандартной методике.
Нами было обследовано 117 пациентов с ЮРА находившихся на санаторно — курортном лечении в санатории «Здравница» г. Евпатория из них 58 % составили девочки, что соответствует международным данным. Преобладала СФ ЮРА 86 пациентов, что составило 73,51 %.
В исследовании большинство детей (68 %) были старше 12 лет и длительность заболевания более 3-х лет была у 48 % детей.
Для определения синдрома избыточного бактериального роста и диагностики нарушений транзита по кишечнику у пациентов с ЮРА использовался Н2-водородный дыхательный тест с лактулозой.
Иммунологичесие методы: твердофазный иммуноферментный анализ (анти-ЛПС-IgA, анти-ЛПС-IgM, анти-ЛПС-IgG),проточная лазерная цитофлуориметрия с использованием флуоресцентных коньюгатов моноклональных антител (определение субпопуляций лимфоцитов периферической крови (CD3+/CD16+, CD3-/CD16+), микротурбиди-метрический метод (IgA, IgM, IgG), ИФА (CD3, CD4, CD8).
Результаты исследования и их обсуждение:
В эксперименте на лабораторных животных в клинической картине адьювантного артрита на 2 сутки исследования наблюдалась первичная воспалительная реакция в месте введения адьюванта в виде гиперемии и отека.
К 6-й неделе развивался полиартрит, более выраженный в коленных и тазобедренных суставах задних конечностей, который характеризовался увеличением суставов в объеме, ограничением подвижности суставов, снижением мышечного тонуса.
Анализ электроннограмм позволил определить ультраструктурные изменения клеточных и внеклеточных компонентов слизистой тонкой кишки, характерные для ревматоидного артрита, отображающие признаки хронического системного воспаления.
Определялись ослабление межклеточных контактов между эпителиальными клетками слизистой тонкой кишки, проявляющееся отеком, разрыхлением и очаговой деструкцией демосом. В расширенных межклеточных промежутках выявлены клетки воспалительного ряда, преимущественно лимфоциты. Нарушения в энтероцитах ворсин характеризовались дистрофическими и деструктивными изменениями ультраструктур клеток, причем выраженность таких изменений неоднородна. Обнаруживались единичные очаги эрозий с воспалительным инфильтратом, представленные большим количеством эозинофилов, тучных клеток, макрофагов и лимфоцитов.
Исследования слизистой толстой кишки в условиях моделированного ЮРА у экспериментальных животных свидетельствовало о том, что наряду с дистрофическими и деструктивными изменениями в клетках, имели место и компенсаторно-приспособительные процессы, развивающиеся в связи с длительно протекающим системным аутоиммунным воспалением. Цилиндрические эпителиальные клетки призматической формы имели на своей апикальной поверхности хорошо выраженные микроворсинки, на поверхности которых локализовался слой гликокаликса, выполняющий барьерную защитную функцию, как и в тонком кишечнике. В некоторых участках слизистой толстой кишки появляются дефекты микроворсинок. Плотность их разряжена, изменена форма и угол наклона, некоторые микроворсинки фрагментированы.
При сопоставлении результатов электронномикроскопического исследования ультраструктуры слизистой тонкого кишечника до лечения и после сорбционной и пробиотической терапии, выявлено уменьшение воспалительных и дистрофических процессов с отсутствием признаков деструкции в обеих группах.
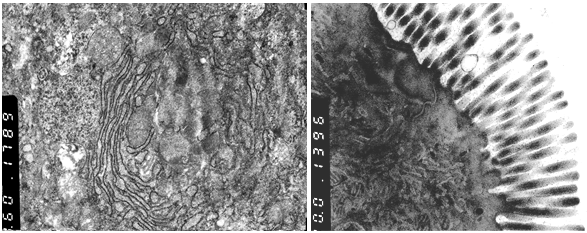
Рис. 1. Группа с Атоксилом, цистерны ГЭС (стрелка). ТЭМ. Увеличение 6500 (слева). Группа с Бифиформ Бэби Микроворсинки (Мкв) энтероцитов. Митохондрии (М). ТЭМ. Увеличение 7400 (справа)
В толстой кишке ультраструктура эпителиальных клеток в группе с пробиотической терапией приближалась к норме. Бокаловидные клетки имели большое количество слизистых вакуолей, находящихся в состоянии экзоцитоза, хорошо развитые канальцы ГЭС, расположенные вокруг ядра с плотным конденсированным хроматином по периферии, что свидетельствовало о регенераторной функции эпителиоцита.
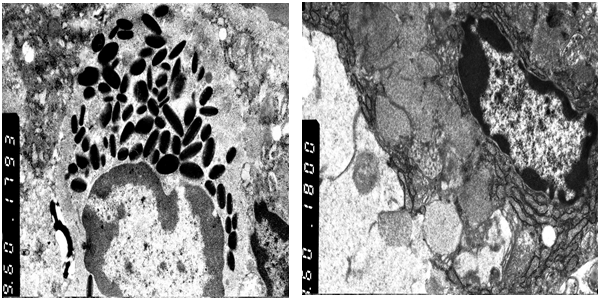
Рис. 2. Группа с Атоксилом. Эозинофил в воспалительном инфильтрате толстой кишки. Увеличение 5000 (слева). Группа с Бефиформ Бэби. Бокаловидная клетка в эпителии толстого кишечника. ТЭМ. Увеличение 4800 (справа)
Для определения наличия синдрома избыточного бактериального роста и изменения скорости транзита по кишечнику нами была проведена оценка показателей уровня водорода в выдыхаемом воздухе. В результате нашего исследования установлена клинически значимая распространенность СИБР у больных ЮРА, в особенности среди пациентов с суставно-висцеральной формой. СИБР выявлен у 21 (24,4 %) при СФ ЮРА и у 23 (74,2 %) пациентов с СВФ ЮРА.
Определено, что сочетание данных патологий при суставно-висцеральной форме сопровождается статистически более значимым повышением уровня водорода в выдыхаемом воздухе до 60 минуте, что косвенно свидетельствовало о наиболее высокой степени бактериального обсеменения тонкого кишечника среди этих пациентов. Независимо от формы ЮРА, мы диагностировали снижение моторики желудочно-кишечного тракта, клиническая значимость которого была обусловлена не только суставно-висцеральной формой ЮРА, но и присутствием СИБР.
При оценке показателей клеточного звена иммунитета у пациентов с ЮРА нами выявлено достоверное увеличение показателей CD 3 и CD 8 в группах с СФ и СВФ ЮРА, что свидетельствовало о напряженности иммунитета.
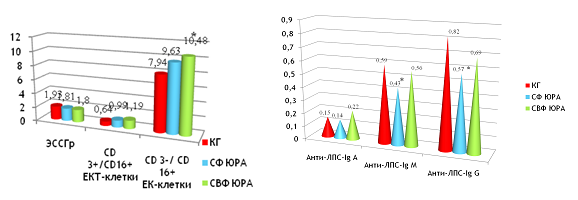
Рис. 3. Клеточное звено АЭИ Гуморальное звено АЭИ
При оценке клеточного звена АЭИ мы не выявили достоверных достоверных изменений показателей, но показатели ЭССГр, уровни ЕК- и ЕКТ- клеток имели тенденцию к повышению в обеих группах пациентов.
При анализе показателей Анти-ЛПС-IgA, Анти-ЛПС-IgM и Анти-ЛПС-IgG между детьми КГ и группами детей с СФ ЮРА и СВФ ЮРА нами не было выявлено дост отличий от ГК. Однако, отмечалась выраженная тенденция к повышению, особенно Анти-ЛПС-IgG. Тенденция к повышению Анти-ЛПС-IgA, Анти-ЛПС-IgM и Анти-ЛПС-IgG, что следует рассматривать как маркеры персистирующего флогогенного влияния ЛПС грамотрицательных бактерий при ЮРА у детей и его вкладе в отсутствие достижения иммунологической ремиссии через 6 и более месяцев после обострения заболевания.
Коррекция выявленных нарушений на санаторно-курортном этапе лечения проводилась 117 детям с ЮРА в периоде ремиссии. Все пациенты получали стандартный комплекс СКЛ.
Для дифференцированной коррекции выявленных нарушений нами были выбраны препараты Атоксил и Бифиформ комплекс.
Каждая группа пациентов (СФ ЮРА и СВФ ЮРА) была разделена на три подгруппы, в зависимости от получаемой терапии. Первые подгруппы из обеих групп получали Атоксил, вторые Бифиформ комплекс и третьи подгруппы на фоне СКЛ получали комбинированную терапию Атоксилом и Бифиформ комплексом.
В результате нашего исследования установлено, что среди пациентов с СФ после терапии в присутствии СИБР отмечалась положительная динамика уровней водорода до 90 минуты (р < 0,05). Однако, у 20 % пациентов уровни водорода в выдыхаемом воздухе снижались ниже 20 ppm, что говорило о сохранении СИБР у данных пациентов.
Применение комбинированной терапии симбиотик + сорбент привело к нормализация скорости транзита по тонкой кишке (120 мин, р < 0,05) в группе пациентов с суставной формой ЮРА.
Применение монотерапии пробиотиком в группе пациентов с СВФ ЮРА показало снижение уровней водорода до 60 минуты (р < 0,05). Однако у части пациентов уровни водорода в выдыхаемом воздухе не снижались ниже 20 ppm.
Применение комбинированной терапии в группе с суставной формой ЮРА показало значимое снижение уровней водорода по сравнению с монотерапией (на 30 и 60 минутах, р < 0,05).
Оба режима нормализовали скорость моторики.
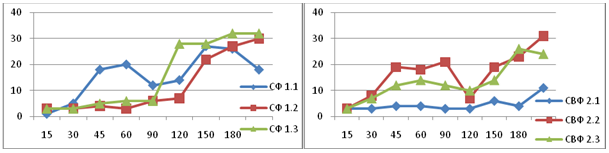
Рис. 4. СИБР у пациентов с СФ ЮРА СИБР у пациентов с СВФ ЮРА
Уровень CD3 достоверно снизился в группе пациентов, получавших комбинированную терапию Атоксилом и Бифиформ комплекс и достиг уровня показателей в контрольной группе пациентов. Уровень CD8 достоверно не изменяется, а CD4 достоверно повышается в группе пациентов, получавших получавших комбинированную терапию Атоксилом и Бифиформ комплекс.
В группе пациентов с СВФ ЮРА только показатели CD 4 достоверно отличались до и после лечения.
После проведенной терапии уровни ЕК и ЕКТ клеток достоверно снижались в группе получавших комбинированную терапию Атоксилом и Бифиформ комплекс на фоне СИБР при СФ ЮРА и достоверно не отличались от группы контроля. Также отмечалось достоверное снижение в группе с терапией Атоксилом при СФ ЮРА без СИБР.
При СВФ уровни ЕКТ клеток имели тенденцию к снижению, но достоверно не уменьшались в группе с Атоксилом. В группе с СВФ ЮРА с выявленным СИБР при терапии Бифиформ комплекс отмечалось достоверное снижение этих показателей. А в группе с комплексной терапией достоверно снизился и достиг уровня контрольной группы.
ЕК клетки достоверно снижались в группе СВФ ЮРА и СИБР и достигли уровня контрольной группы при терапии комбинированной терапии Атоксилом и Бифиформ комплекс.
Анти-ЛПС -Ig А достоверно снижался в подгруппе терапии Бифиформ комплекс и достигал показателей КГ при терапии комбинированной терапии Атоксилом и Бифиформ комплекс в группе пациентов с СФ ЮРА. Анти-ЛПС-IgG не изменялся ввиду малой длительности исследования (2 недели). IgM снижался существенно при терапии Атоксилом и достоверно снижался при терапии комбинированной терапии Атоксилом и Бифиформ комплекс на фоне СИБР.
При СВФ ЮРА имелась тенденция к снижению уровня Анти-ЛПС-IgA в группе с терапией Бифиформ комплекс и достоверно снижалась в группе комбинированной терапии Атоксилом и Бифиформ комплекс.
Снижение уровня Ig M до уровня КГ отмечалось при назначении комбинированной терапии Атоксилом и Бифиформ комплекс.
Выводы:
При изучении морфоструктуры тонкого и толстого кишечника у крыс с адьювантным артритом выявлены выраженные воспалительные и эрозивно-деструктивные изменения как в тонком, так и к толстом кишечнике.
Синдром избыточного бактериального роста у больных ЮРА в периоде ремиссии достоверно чаще диагностирован при суставно-висцеральной форме ЮРА (74,2 %), чем при суставной форме ЮРА (24,4 %) При суставно-висцеральной форме ЮРА 54 % детей выявлено снижение моторики и скорости пассажа по тонкой кишке.
Детям с СВФ ЮРА в периоде ремиссии проводить водородный дыхательный тест с лактулозой для диагностики синдрома избыточного бактериального роста и нарушений моторно-эвакуаторной функции кишечника, а с СФ ЮРА по показаниям.
Установлено, что показатели водородного дыхательного теста при СФ ЮРА достигали уровня КГ детей только при дополнении СКЛ препаратами Атоксил и Бифиформ комплекс; при СВФ ЮРА только при применении данного комплекса наметилась тенденция к улучшению.
Установлено влияние дифференцированных комплексов СКЛ на показатели общего иммунитета: при СФ ЮРА только при дополнении СКЛ Бифиформ комплекс снизился уровень общего IgА (р>0,05), при СВФ ЮРА уровни общих IgА, IgM и IgG не изменялись; показатели клеточного звена иммунитета достоверно улучшались только при дополнении СКЛ препаратами Атоксил и Бифиформ комплекс — снижался уровень CD3 (р<0,05) и повышался уровень CD4 (р<0,05), достигая значений КГ детей. При СВФ ЮРА, за период наблюдения, не выявлено динамики общих IgА, IgM и IgG. При СКЛ с препаратами Атоксил и Бифиформ комплекс уровень CD4 достоверно повышался (р<0,05), но оставался в пределах референтных значений нормы.
Показатели гуморального антиэндотоксинового иммунитета снизились при СФ ЮРА без СИБР: Анти-ЛПС-IgА (р<0,05) при дополнении СКЛ препаратом Бифиформ комплекс и комбинацией препаратов Атоксил и Бифиформ комплекс; при СВФ ЮРА с СИБР достоверно снизились уровни Анти-ЛПС-IgM (р<0,05) и Анти –ЛПС-IgG (р<0,05) только при применении СКЛ дополненного препаратами Атоксил и Бифиформ комплекс.
Показатели клеточного звена иммунитета улучшились при СФ ЮРА: достоверно снизились CD3+/CD16+ (р<0,05) и CD 3-/CD 16+ (р<0,05) при дополнении СКЛ препаратом Атоксил и комплексом Атоксил и Бифиформ комплекс; при СВФ ЮРА с СИБР достоверно снизились CD3+/CD16+ (р<0,05) и CD 3-/CD 16+ (р<0,05) только при дополнении СКЛ комплексом Атоксил и Бифиформ комплекс.
У пациентов с ЮРА вне активности воспалительного процесса не выявлено полной иммунологической ремиссии: достоверное повышенные уровней CD3 и CD8 при ЮРА (р<0,05), по сравнению с КГ детей указывало на напряженность иммунитета.
Литература:
1. Lovel, 2001. Lovel DJ: juvenaile rheumatoid arthritis and juvenaile spondyloarthrpathy. In: Klippel JH, ed. Primer on the Reumatic Diseases, 12th ed.. Atlanta: Arthritis Foundation; 2001.
2. Maini R. N. Pathogenesis of Rheumatoid Arthritis. Internal. Zeitschrift fur arztliche Fortbildung, 1994, № 23. S. 59–63
3. Волосовец А. П. Ювенильный ревматоидный артрит: интеграция мирових стандартов лечения в практику детской кардиоревматологии Украины / А. П. Волосовец // Таврический медико-биологический вестник. — 2009. — Т.12, № 2. — С. 6–10.
4. Алексеева Е. И. Ювенильный артрит: возможности медикаментозного и немедикаментозного лечения на современном этапе. Часть 2. Алгоритм биологический терапии юношеского артрита/ Е. И. Алексеева, Т. М. Бзарова //Лечащий врач. — 2011. — № 9. — С.60–66.
5. Передерий В. Г., Швец Н. И.,. Ткач С.М и др. Место дыхательных тестов в диагностике заболеваний органов пищеварения. // Сучасна гастроентерол. і гепатол. — 2000. — № 1. — С.21–25.
6. Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process // Gastroenterology. 2006. Vol. 130 (5). P. 1377–1390.
7. Яковенко Э. П. и др. Синдром избыточного бактериального роста в кишечнике — клиническое значение и вопросы терапии // Consilium medicum. 2006. Экстравыпуск. С. 3–8.
8. Насонов Е. Л. Ревматоидный артрит: проблемы и значение персонифицированной медицины/ Е. Л. Насонов //Терапевтический архив. — 2012. — Т. 84, № 5. — С.5–9.
9. Анализ отдаленных результатов санаторно-курортного лечения детей с ювенильным ревматоидным артритом / [О. И. Гармаш [и др.] // Вестник физиотерапии и курортологии. —2008. —№ 2. —С.127.
10. Клиническая характеристика больных ювенильным ревматоидным артритом, поступивших на санаторно-курортный этап реабилитации / [Н. В. Савелко [и др.] //Вестник физиотерапии и курортологии. — 2010. — № 6. — С.86–89.
11. Психофизиологический и иммунный статус больных ревматоидным артритом/ [Т. Я. Абрамова [и др.] //Медицинская иммунология. — 2008. — Т. 10, № 1. — С.43–50
12. Ревматоидный артрит и ювенильный ревматоидный артрит: новые методы диагностики аутоиммунных нарушений / А. В. Александров, О. В. Новикова, О. В. Парамонова и др.// Аллергология и иммунология. –2011. —№ 3. —С.280.
13. Санаторно-курортное лечение детей с ювенильным ревматоидным артритом, получавших базисную терапию: материалы науч.-практич. конференции (Современные проблемы педиатрии) 7–8 октября 2011г., г. Алушта/ О. И. Гармаш, Т. С. Сколотенко, О. Е. Витринская [и др.] //Вестник физиотерапии и курортологии. — 2011. — Т. 17, № 3. — C.106–107.
14. Europen convention for the protection of vertebrate animals used for experimental and other scientific purposes.- Council of Europ, Strasbourg, 1986.- 53 p.

